植酸酶的高密度发酵、制备及其应用研究
龙 跃 杨 博 王永华 吴晓英 齐振雄
植酸酶是催化植酸及其盐类水解成肌醇和磷酸的一类酶的总称。磷是动物体内一种必需的矿物质,在参与体内正常的新陈代谢中起着重要的作用。磷还是骨骼的重要成分。畜禽必须从饲料中摄取足够的磷,才能维持正常的生命活动。如果饲料中缺磷,会导致畜禽生长发育迟缓,骨骼和牙齿发育不良,动物生产性能降低等不良后果。在饲料中添加植酸酶,可以提高饲料的利用率,降低饲料系数和饲料成本,改善许多水产动物的生长性能,促进其生长,所以植酸酶的应用潜力很大。饲料中添加植酸酶可以减少磷酸二氢钙的添加量,从而减少了磷源的浪费,同时降低了磷的排泄量,进而减少了磷对水体环境的污染。
巴斯德毕赤酵母(Pichia pastoris)表达系统是目前最优秀、应用最广泛的外源基因表达系统之一。它不但克服了大肠杆菌表达系统不能表达结构复杂的蛋白质,表达的蛋白多形成包涵体,背景蛋白多,表达量不很高等缺陷,还具有与真核生物极其相似的分泌途径和很强的真核蛋白质修饰功能,并且其自身分泌的蛋白质很少且易于高密度发酵,因此,在表达和分离纯化异源蛋白质等方面具有很强的优势。本研究主要是对本实验室保存的毕赤酵母产植酸酶基因工程菌的发酵工艺条件进行优化研究,确定产酶的最佳发酵条件,初步研究酶学特性,并且投入小规模的实际应用,为今后大规模工业化生产植酸酶提供参考。
1 材料与方法
1.1 菌种
巴斯德毕赤酵母基因工程菌,甲醇营养型,由华南理工大学生物科学与工程学院生物化工实验室保存。
1.2 培养基
种子培养基:YPD液体培养基;固体平板培养基:液体YPD培养基加2%琼脂;摇瓶生长培养基:BMGY;摇瓶甲醇诱导表达培养基:BMMY;发酵生长培养基:26.7 ml/l 85%磷酸、0.93 g/l CaSO4·2H2O、18.2 g/l K2SO4·2H2O、14.9 g/l MgSO4·7H2O、7.13 g/l KOH、40 g/l甘油、4.35 ml/l微量元素;补料生长培养基:50%甘油、12 ml/l微量元素;诱导表达培养基:100%甲醇、12 ml/l微量元素;微量元素:6 g/l CuSO4·5H2O、0.08 g/l NaI、3 g/l MnSO4·H2O、20 g/l ZnSO4·7H2O、65 g/l FeSO4·7H2O、0.5 g/l CoCl2·6H2O、0.02 g/l硼酸、5 ml/l浓硫酸(上述培养基均按“Invitrogen Pichia Fermentation Process Guidelines”推荐方法配制)。
1.3 实验方法
1.3.1 摇瓶发酵
将菌种接于YPD平板,30℃培养2 d,4℃保藏;在平板上挑取单菌落接种至液体100 ml YPD中,28~30℃、250~300 r/min摇至菌体浓度OD600=2~6(对数生长,大约16~18 h);按10%接种量接种100 ml BMGY摇瓶中,28~30℃、250~300 r/min培养18~24 h;室温1 500~3 000 g离心5 min收集细胞,去除上清,用相同体积BMMY重悬细胞,进行诱导表达,加盖两层灭菌纱布或干酪包布,放入摇床28℃中继续生长。每隔24 h,加入甲醇至终浓度为1%以继续诱导。检查培养基的量,确保正确加入甲醇,因为蒸发作用会减少培养基的体积,诱导72 h后取样测酶活力。
1.3.2 发酵罐发酵
种子制备:从YPD平板挑取单菌接种到100 ml种子培养基中,28~30℃、250~300 r/min培养16~18 h,做为一级种子;按10%接种量接入200 ml种子培养基中,28~30℃、250~300 r/min培养24 h,做为二级种子。
发酵罐准备:30 L发酵罐中,装入发酵生长培养基,按10%接种量将二级种子接种在28℃进行菌体生长培养,培养20 h,以18 ml/(L·h)流加50%甘油作为碳源补加4 h,使菌体达到一定的浓度,通过流加甲醇的补料方式,维持DO≥20%并且在26℃下进行诱导产酶。pH值用氨水和磷酸调节。每隔4~6 h取1 ml培养基至1~5 ml离心管,室温用水平离心机最大转速离心2~3 min。这些样品用于分析表达水平及确定诱导后收集细胞的最佳时间。
1.3.3 酶活测定方法
酶活定义:样品在植酸钠浓度为5.0 mmol/l,温度37℃,pH值5.50的条件下,每分钟从植酸钠中释放1 μmol无机磷,即为一个植酸酶活性单位,以U表示。
2 结果与分析
2.1 发酵条件的优化
2.1.1 甲醇添加量对表达量的影响
将10 ml菌液接入100 ml生长培养基BMGY中培养24 h,离心后将菌体转入相同体积含有甲醇百分比浓度分别为 0.5%、1%、1.5%、2%的诱导培养基BMMY上进行诱导培养,24 h后补加相同浓度的甲醇,诱导培养72 h后产酶结果如图1。由图1可以看出,甲醇百分比浓度为1.5%时酶活力达到最高,但甲醇浓度较高,达到2%时,酶活力开始下降。在重组毕赤酵母的高密度发酵中,控制适宜的甲醇浓度十分重要。甲醇浓度过低,AOX1启动子不能有效启动,外源基因则不能高效转录;甲醇浓度过高,会对细胞产生毒害。因此,甲醇浓度是实现外源蛋白高水平表达的保证。
2.1.2 诱导温度对表达量的影响
将10 ml菌液接入100 ml生长培养基BMGY中培养24 h,离心后将菌体转入相同体积含有1%甲醇诱导培养基 BMMY 中,分别在 22、26、30、34 ℃的条件下诱导培养72 h后产酶结果如图2。由图2可以看出,采用不同的温度进行蛋白诱导时,在22℃时酶活偏低,原因可能是温度过低,抑制了细胞的活性,但26℃和30℃相比,温度越低越有利于目的蛋白的表达,原因可能是低温有利于降低蛋白合成速率与新生成肽链的折叠速率,低的蛋白合成速率及折叠速率有利于新生肽链的正确折叠。
2.1.3 生长时间对表达量的影响
将10 ml菌液分别接入100 ml生长培养基BMGY 中分别培养 18、20、22、24、26、28 h,离心后将菌体转入制好的甲醇浓度1%的相同体积培养基BMMY中条件下诱导72 h后产酶结果如图3。由图3可以看出,在生长20 h后进行诱导表达植酸酶酶活力较高,24 h后酶活力呈现下降趋势,原因可能是因为诱导前菌种处于平稳期中后期,细胞的产酶能力减弱。

图1 甲醇浓度对植酸酶表达的影响

图2 诱导温度对植酸酶表达的影响

图3 生长时间对植酸酶表达的影响
2.1.4 发酵时间对表达量的影响
从发酵开始,每隔4 h,取发酵液样品测其OD600值和湿重,以最大转速离心2~3 min,保留上清液,发酵结束后测其植酸酶酶活大小,结果见图4。由图4可知,细胞在培养20 h后,进入对数生长期,经过4 h的补加甘油后,菌体密度迅速增加达到OD600=173,实现高密度发酵,在24 h,以4 ml/(L·h)的甲醇流加速度进行诱导表达,由图4可以看出,发酵24~108 h(诱导时间0~84 h)酶活逐渐呈上升趋势,发酵108 h(诱导时间84 h)后,虽然菌体浓度一直增大,但酶活力开始下降。随着时间的延长,植酸酶表达水平开始下降。原因有两点:随着细胞的生长,细胞同时也会分泌大量的蛋白酶,表达外源细胞被水解;二是随着发酵时间延长,受发酵条件的限制,菌体进入平稳期后期,表达蛋白的能力逐渐丧失。

图4 发酵时间对植酸酶表达及菌体生长的影响
2.1.5 流加甲醇补料策略对表达量的影响
在诱导补加甲醇期间,分别采用不同的补料流加策略——甲醇: 甘油为4:0、5:0、5:1、5:2、6:0,其他条件一致的情况下,结果如图5。由图5可知,随着甲醇和甘油的流加速度增大,菌体浓度OD600不断升高,在甲醇流加速度高于5 ml/(L·h)后,菌体浓度开始下降,溶氧(DO)逐渐变大,说明此时甲醇在发酵液中开始积累,对细胞的生长产生抑制作用。在诱导阶段混合流加碳源过程中,甘油流速超过1 ml/(L·h)时,酶活力开始下降,但菌体浓度还是持续上升,说明甘油在发酵液中作为第一碳源首先被利用,对甲醇的诱导作用形成抑制。因此,该结果表明,最佳的诱导补料策略是混合碳源补料,并且甲醇:甘油为5:1。
2.1.6 诱导pH值对表达量的影响
用氨水和磷酸调节诱导期的pH值,取不同水平为 5.5、5.0、4.5、4.0、3.5,其他条件一致。结果如图 6。由图6可知,随着诱导期pH值的变小,菌体浓度OD600也不断降低,但是酶活力的曲线呈先增大后变小的趋势,说明在pH值为4.0~5.0之间,较低的pH值不适合细胞生长,但有利于植酸酶的表达,原因是诱导剂甲醇对细胞有一定的毒性,不利于高密度的发酵,但是低pH值抑制了蛋白酶的活性,提高了单位酶活力。在pH值低于4.0的情况下,由于细胞总浓度的偏低,导致了单位酶活的降低,pH值为4.0时的植酸酶活性比pH值为4.5时的植酸酶活性提高了近20%,因此,既利于生长又利于植酸酶表达的pH值为4.0左右。

图5 甲醇补料策略对植酸酶表达及菌体生长的影响
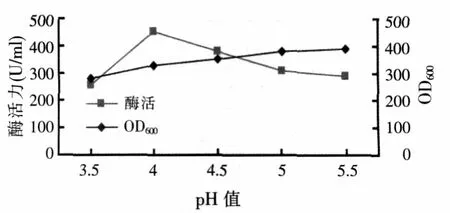
图6 诱导pH值对植酸酶表达及菌体生长的影响
2.2 植酸酶的酶学特性及制备
2.2.1 植酸酶的最适pH值和温度耐受性
将产酶菌种诱导84 h后,取培养液离心,上清液进行酶活性检测。酶活检测底物为植酸钠,用一系列缓冲溶液配制,pH值范围为3~10,结果如图7所示,植酸酶在pH值3~6之间能保持55%以上的活力,pH值为5时,酶活力最高。植酸酶在最适pH值下,活性中心的各个氨基酸残基侧链质子化或去质子化解离较容易,使得催化反应能迅速、高效进行。过酸或过碱都会对酶活性中心氨基酸残基侧链的解离程度造成影响,阻碍反应的顺利进行。
分别将酶液在50~90℃条件下进行10 min耐热性处理后进行酶活性检测,如图8。由图8可以发现,在50~70℃内酶活力逐渐下降,而在70~90℃酶活力开始上升,并且在90℃时能保持75%的酶活力,具有良好的高温耐热性。饲料加工需经过制粒工艺,在制粒过程中有一个短暂的高温过程,一般的植酸酶活性在此高温下大幅度地不可逆丧失,所以饲料中真正得到推广利用的植酸酶必须具有良好的热稳定性。
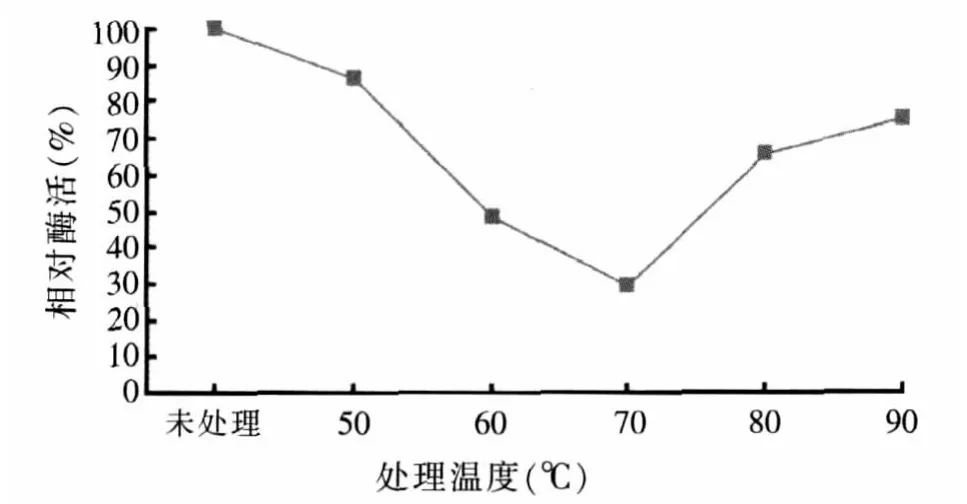
图8 不同温度下植酸酶的耐热性能
2.2.2 不同浓缩方法对植酸酶活力的影响
硫酸铵沉淀法:取酶液,缓慢加入研磨的硫酸铵粉末,边加边搅拌,待硫酸铵全部溶解后继续搅拌10~15 min,使硫酸铵的饱和度分别达到20%、30%、40%、50%、60%,10 000 r/min离心 20 min,沉淀用适量乙酸缓冲液溶解后,测其植酸酶酶活,酶活损失都在50%以上。
超滤法:将发酵后的液体用水平离心机,4℃、11 000~12 000 r/min离心10~15 min后,取上清液,经过30 kD的膜包超滤浓缩,工艺流程如图9。超滤后的酶液体积为超滤前的1/10,单位酶活提高了大约9倍,损失率小于10%。

图9 植酸酶后处理工艺流程
2.2.3 不同稳定剂对植酸酶稳定性的影响
将金属离子、阴离子、多糖、多元醇和表面活性剂等复合稳定剂处理浓缩后的植酸酶并进行饲料加工。分别将未处理和处理后获得的饲料放在编织袋中,取刚加工后、保存1个月及2个月后饲料中的样品检测植酸酶的活性,与加入饲料前测定的活性比为其在饲料中保存的活性存留率,结果如图10所示,添加稳定剂可增加植酸酶的稳定性,保存2个月后酶活存留率仍有50%以上。盐的添加能显著改善酶的稳定性,盐类主要存在离子键作用,当酶的活性中心含有离子作为配位体时,盐离子就能稳定酶的构象并且可作为水分子的替代物占据水的位置,排除自由水对酶造成的不稳定化影响。而多羟基化合物既可通过氢键与酶蛋白表面分子相连结,也能通过氢键有效地与外部水分子相连结,使酶蛋白分子稳定。
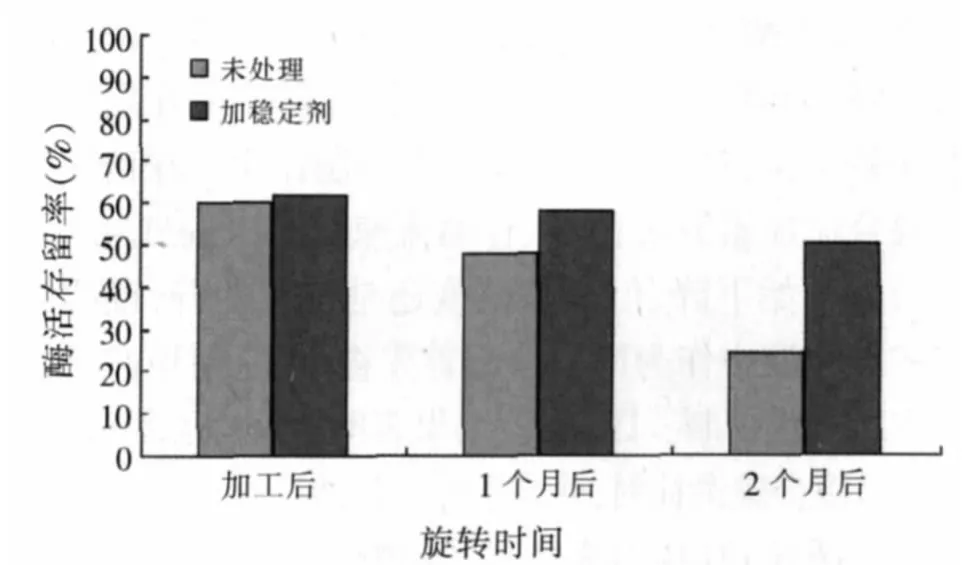
图10 复合稳定剂对植酸酶稳定性的影响
2.3 植酸酶在草鱼养殖中的应用
酶液经浓缩,添加稳定剂后投入小规模养殖实验。采用初始平均体重5.3 g的草鱼作为实验对象,平行实验3组,每缸30尾,实验时间56 d,根据表1的配方对比本实验植酸酶的实际应用价值,由图11可知,本实验室植酸酶添加量0.08%时,单尾平均增重率达到75%,添加磷酸二氢钙1.5%,单尾平均增重率76%,基本可以完全替代磷酸二氢钙,但需进一步放大实验确定。

表1 饲料配方(%)

图11 不同配方对单尾平均增重率的影响
3 结论
发酵条件主要包括培养基、接种量、pH值、培养温度、溶氧、甲醇浓度、诱导时间等,本研究以该菌株在摇瓶发酵条件优化为前提的基础上,在30 L发酵罐中进行放大优化实验得到最佳发酵条件为:生长时间20h、甲醇流加速度 5 ml/(L·h)、诱导期甘油流速1 ml/(L·h)、诱导pH值4,诱导时间84 h、诱导温度26℃,酶活力可达到454 U/ml,比未优化前提高289%。初步对酶学性质研究表明该酶的pH作用范围为3~6,并且在90℃处理后,仍然可以保持75%的活性,具有一定的耐热性。
酶液经过超滤浓缩损失率小于10%,加入复合稳定剂投入饲料加工后酶活存留率大于60%,保存2个月仍有50%以上,投入到草鱼养殖实际的应用中,得到结果当添加比率为0.08%时基本可以完全替代磷酸二氢钙,说明本实验室毕赤酵母工程菌具有大规模生产应用的前景。
[1]Sreekrishna K,Brankamp R G,Kropp K E,et al.Strategies for optimal synthesis and secretion of heterologous proteins in the methylotrophic yeast Pichia pastoris[J].Gene,1997,190(1):55-62.
[2]Hong F,Meinander N Q,Jonsson L J.Fermentation strategies for improved heterologous expression of laccase in Pichia pastoris[J].Biotechnology and Bioengineering,2002,79(4):438-449.
[3]Romanos M.Advances in the use of Pichia pastoris for high-level gene expression[J].Current Opinion in Biotechnology,1995,6(5):527-533.
[4]洒荣波,石贵阳,王正祥.基因工程菌Pichia pastoris高密度培养条件的摇瓶研究[J].食品研究与开发,2005,26(2):52-56.
[5]全国饲料工业标准化技术委员会.GB/T18634-2002[S].中华人民共和国国家标准.
[6]刘志伟,黄玉亭,张铁鹰,等.国标法测定植酸酶活性存在问题的探讨[J].中国饲料,2006(18):29-31.
[7]窦烨,王清路,李俏俏.毕赤酵母工程菌发酵条件的优化[J].食品工业科技,2008(6):168-171.
[8]金虎,肖杰,段生兵,等.毕赤酵母流加培养诱导生产植酸酶的流加控制策略[J].食品与发酵工业,2006,32(10):9-16.
[9]李洪钊,李亮助,孙强明,等.巴斯德毕赤酵母表达系统优化策略[J].微生物学报,2003,43(2).
[10]谢子文,王红宁.毕赤酵母工程菌产植酸酶补料分批发酵研究[J].中国酿造,2007(6):9-13.
[11]付石军,孙建义.改善植酸酶热稳定性的策略[J].中国饲料,2007(14):26-28.
[12]刘梅英,彭健,刘敏跃,等.从后处理工艺提高植酸酶热稳定性的研究进展[J].饲料工业,2007,28(11):1-3.

