手性咪唑环芳识别氨基酸甲酯的作用模式研究
娄永峰向明礼杨明理
(1.四川大学华西医院生物治疗国家重点实验室,成都,610041;2.四川大学化工学院,成都,610065)
科研与开发
手性咪唑环芳识别氨基酸甲酯的作用模式研究
娄永峰1,2向明礼1杨明理1
(1.四川大学华西医院生物治疗国家重点实验室,成都,610041;2.四川大学化工学院,成都,610065)
采用Gaussian 03在B3LYP/6-31G(d)水平上分别优化手性咪唑环芳受体和氨基酸甲酯配体,并在同样条件下计算NBO电荷。用AutoDock Vina将优化后的受体、配体进行对接,获得相应复合物的最稳定构象。以复合物亲和能和配体侧链电子电荷指数,建立了表达复合物稳定常数的定量关系模型。从单体的NBO电荷分布、复合物最稳定构象等方面分析探讨,发现静电吸引、受体配体间的空间匹配和氢键作用等,是影响手性咪唑环芳选择性识别氨基酸甲酯的主要影响因素。
咪唑环芳 分子力学 密度泛函理论 分子识别 氨基酸甲酯
1 前言
环芳是一类具有特殊结构的有机化合物。1949年,C.J.Brown和A.C.Farthing发现了一种很独特的化合物,其结构为由两个次乙基桥从对位连接起来的面对面的苯环。该化合物被直观地命名为“二对二甲苯”[1]。1951年,Donald J.Cram和H.Steinberg为研究刚性分子中不饱和中心间的电子相互作用,合成得到了一系列包括C.J.Brown和A.C.Farthing之前发现的化合物。他们将这些“面对面”的苯环环状大分子取名为“对位环芳(paracyclophane)”[2]。随着研究的深入,“环芳”的内涵和外延不断地得到一步步拓展[3],并逐渐形成为一门倍受关注的环芳化学[4],Donald J.Cram也因为对环芳研究的独特贡献而获得1987年的诺贝尔化学奖[5]。
几十年来,有关环芳的研究一直受到持续关注。环芳已广泛应用于人工酶模拟[5-6]、手性识别[7-9]、超分子[10]、分子催化[5,11]、抗菌[12]等领域。咪唑环芳更为特殊。咪唑是生物体系的重要基团[8]。含咪唑环的一些化合物具有抗炎活性[13],并对细胞色素P450酶有抑制活性[14]。再加上咪唑衍生物难于合成等诸多因素[15-17],使得咪唑环芳的研究,更引人瞩目。
但是迄今,环芳研究工作的注意力几乎都集中在合成品种不同功能各异的环芳以及发展新的合成方法[4,6,18-19]方面,人们对于环芳识别氨基酸甲酯的分子作用机制的认识[9,20],未见深入研究的相关文献。而手性咪唑环芳受体对D构型氨基酸甲酯配体,表现出不同寻常的识别能力[17]。其作用机制值得深入探讨。
2 研究方法
2.1 单体结构和复合物构象的获取
目前还没有该手性咪唑环芳受体[17]的晶体结构,也没有该受体识别丙氨酸甲酯(LA)、苯丙氨酸甲酯(LF)、亮氨酸甲酯(LL)色氨酸甲酯(LT)、和缬氨酸甲酯(LV)后形成复合物的晶体结构数据。而没有环芳受体与配体间形成的复合物的可靠三维结构数据,要深入探究其间的分子识别机制,几乎无从下手。
对于受体和配体的单体结构,我们采用Chem-Bio3D构建,用Gaussian 03[21]在B3LYP/6-31G(d)理论水平上进行几何构型优化得到。优化后的手性咪唑环芳受体的三维结构图,如图1(a)所示。
用AutoDock Vina[22]将此前优化过的单体进行对接。为了充分考虑分子识别时的空间互补效应,将配体作全柔性处理。AutoDock在评价分子间的相互作用时,特别考虑了氢键和疏水相互作用。经“迭代局域搜索全局优化”[22]算法计算,得到最稳定的复合物的构象。
2.2 识别模式和复合物稳定常数的定量表达
在选择性的分子络合中,受体、配体的结合位点间的互补性和复合物中配体的空间位阻是关键因素,而静电作用、范德法力、氢键等也是形成分子复合物的推动力[5-6,23-25]。有鉴于此,对手性咪唑环芳受体和氨基酸甲酯配体,在构型优化的基础上,在同样的理论水平上进行了NBO电荷计算。
对Vina对接时所计算的亲和能的构成[22]进行分析可知,其亲和能的计算考虑了空间效应、排斥效应、氢键、疏水作用,以及分子的柔性。为此,以Vina所计算的亲和能为核心参数,建立起表达复合物稳定常数的定量关系模型,以便进一步深入探讨该手性咪唑环芳与配体分子间的识别机制。

式(1)中,K为复合物稳定常数计算值;ΔE为Vina计算的分子间相互作用的亲和能;ECI为氨基酸侧链的电子电荷指数[26],α、β为待定参数,γ为截距。
3 结果与讨论
3.1 手性咪唑环芳识别氨基酸甲酯的作用模式
NBO电荷计算表明,手性咪唑环芳的负电荷,大都集中在环芳的几个N、O原子上。在咪唑环两端起桥接作用的4个C原子,也带有相当数量的负电荷。而在氨基酸甲酯上,氨基N上的负电荷最多,达-0.70左右,其次是羰基O和酯O,所带负电荷约为-0.50;而氨基H最具极性,所带正电荷在0.30左右。手性咪唑环芳受体对氨基酸甲酯的识别,静电相互作用不可忽视。
从实验数据(见表1)可知,手性咪唑环芳受体A与五个配体相互作用形成的复合物,其稳定程度可分为三档;复合物A-LT最稳定;其次是A-LF。余下的三种稳定性最差。

图1 经优化后的手性咪唑环芳(A)三维棒状结构图(a),受体与丙氨酸甲酯(b)受体与色氨酸甲酯(c)相互作用的最低能量构象图(为便于观察,隐去了配体中的非极性氢原子;红色:氧原子;蓝色:氮原子;灰色:碳原子;白色:氢原子)
将最稳定的复合物A-LT(图1c)和稳定性最差一档的复合物A-LA(图1b)的构象进行对比分析,可以发现该手性咪唑环芳识别氨基酸甲酯的作用模式特征。首先是静电作用。色氨酸甲酯带负电的羰基O对着环芳上一个咪唑环的H;而其带负电的酯甲基C,指向环芳上一个吡啶的H。同时,两个极性的氨基H分别指向环芳上的两个羰基O。在复合物A-LA中,也有类似的电荷匹配现象。其次是空间匹配。在最稳定的A-LT复合物中,色氨酸甲酯的C端嵌在由吡啶环为墙、咪唑环为底的凹槽中,而其苯并吡咯侧链则“枕”在链接另一个吡啶环和咪唑环的侨链上。犹如人坐在沙发。而在A-LA复合物中,由于受体的空间大,配体的体积小,丙氨酸甲酯在其中犹如小脚穿大鞋般,匹配性差。另外还有氢键作用。在A-LT中存在氢键作用。色氨酸甲酯的一个氨基H与受体上的一个羰基O仅距2.08Å,且O-H-N间呈现接近180°的角度。在A-LA中,丙氨酸甲酯的氨基 H 与受体上的羰基 O相距达2.40Å,且O-H-N夹角接近150°。因此可以认为,该手性咪唑环芳对氨基酸甲酯的选择性识别,是静电吸引、空间匹配和氢键等因素在起重要作用。
3.2 复合物稳定常数的定量表达
简单地分析一下表1中的数据,地注意到,Vina测定的复合物间的亲和能ΔE与实验测定的复合物的稳定常数间有较好的相关性。同时我们认为,静电相互作用可能对复合物稳定性有很大的贡献。因此,将Vina计算的复合物的亲和能以及氨基酸侧链的电子电荷指数作为主要贡献项(具体数据详见表1),对式(1)进行最小二乘拟合,得到表达复合物稳定常数的定量表达式:

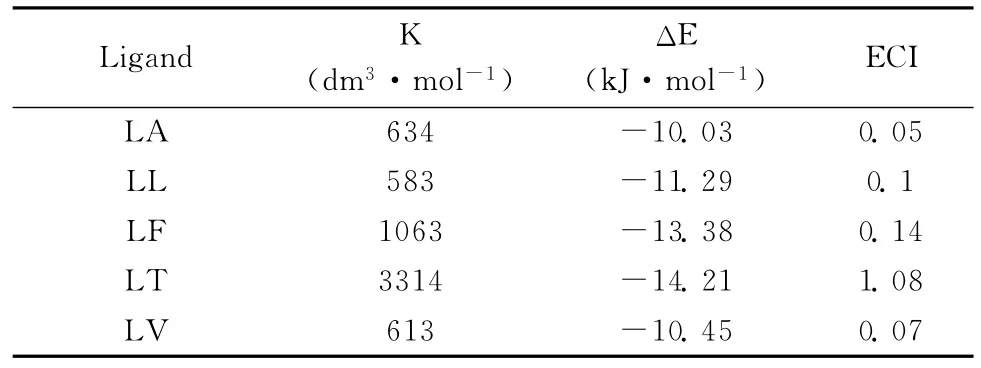
表1 与各配体相应的复合物稳定常数、亲和能,以及氨基酸侧链电子电荷指数
根据式(2),考察各因素对复合物稳定度的贡献可以看到,A-LT的亲和能最大,色氨酸甲酯的侧链电子电荷指数最大,该复合物也最稳定;A-LA、ALL和A-LV的亲和能以及他们的配体侧链电子电荷指数,都属最小一档,它们的稳定度也在最差的一档。
图2表达的复合物稳定常数计算值与实验值间的关系,表明以Vina计算的亲和能为核心参数,外加氨基酸侧链的电子电荷指数,可以用于定量表达该手性咪唑环芳对一系列氨基酸甲酯的选择性识别。
4 结论
(1)静电吸引、空间互补和氢键作用等,是影响手性咪唑环芳对氨基酸甲酯选择性识别的主要因素。为实现环芳对氨基酸甲酯的高度选择性识别,应该至少从上述三个方面考虑,设计相应的环芳。
(2)在缺少准确的三维结构数据的情况下,用量子力学方法优化单体结构,应用AutoDock Vina,将受体、配体对接,可以获得复合物的最稳定构象。
(3)根据亲和能等数据,可以建立表达复合物稳定常数的定量关系模型。这可能将有助于环芳在分子识别、人工酶模拟等方面的认识和应用。
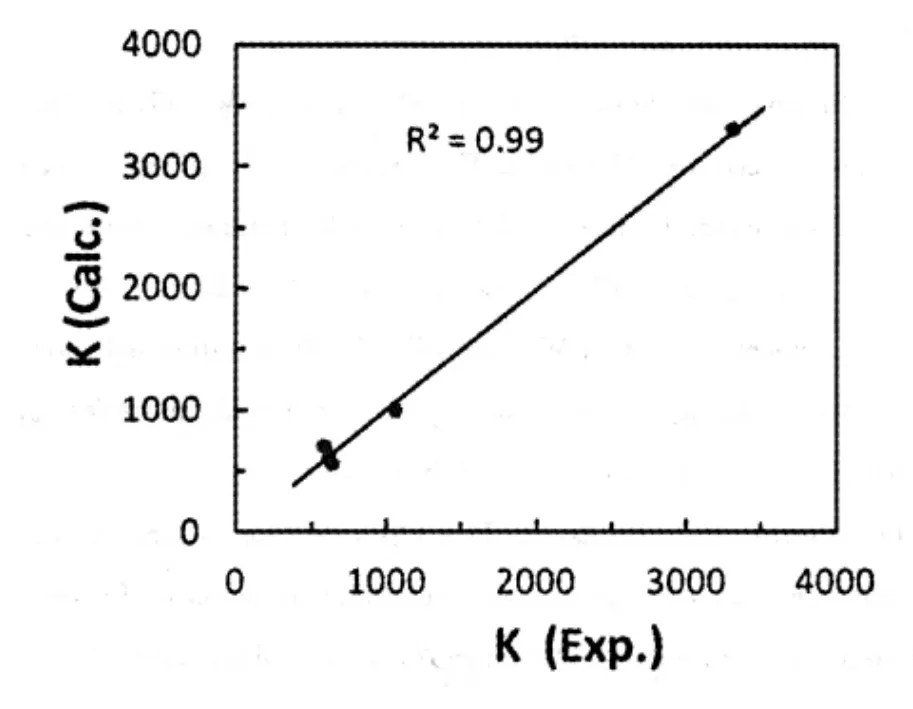
图2 复合物稳定常数实验值与计算值间的关系曲线
[1]Brown,C.J.;Farthing,A.C.,Preparation and Structure of Di-p-Xylylene.Nature 1949,164,915-916.
[2]Cram,D.J.;Steinberg,H.,Macro Rings.I.Preparation and Spectra of the Paracyclophanes.J.Am.Chem.Soc 1951,73,(12),5691-5704.
[3]Cram,D.J.;Cram,J.M.,Cyclophane chemistry:bent and battered benzene rings.Acc.Chem.Res 1971,4,(6),204-213.[4]Boekelheide,V.,Syntheses and properties of the[2n]cyclophanes.Top.Curr.Chem 1983,113,87-143.
[5]Cram,D.J.,The design of molecular hosts,guests,and their complexes.J.Incl.Phenom.1988,6,(4),397-413.
[6]Cram,D.J.;Cram,J.M.,Design of complexes between synthetic hosts and organic guests.Acc.Chem.Res 1978,11,(1),8-14.
[7]Newcomb,M.;Toner,J.L.;Helgeson,R.C.;et al.,Hostguest complexation.20.Chiral recognition in transport as a molecular basis for a catalytic resolving machine.J.Am.Chem.Soc 1979,101,(17),4941-4947.
[8]Yuan,Y.;Gao,G.;Jiang,Z.;et al.,Synthesis and selective anion recognition of imidazolium cyclophanes.Tetrahedron 2002,58,(44),8993-8999.
[9]Xu,X.-W.;Wang,X.-L.;Wu,A.-M.;et al.,Synthesis and molecular recognition of novel multiimidazole cyclophanes.J.Heterocyclic Chem.2009,46,(6),1137-1141.
[10]Camacho,D.H.;Salo,E.V.;Ziller,J.W.;et al.,Cyclophane-based highly active late-transition-metal catalysts for ethylene polymerization.Angew Chem Int Ed 2004,43,1.
[11]Poyatos,M.;Mata,J.;Peris,E.,Complexes with Poly(N-heterocyclic carbene)Ligands:Structural Features and Catalytic Ap-plications.Chem.Rev.2009.
[12]Melaiye,A.;Sun,Z.;Hindi,K.;et al.,Silver(I)-midazole Cyclophane gem-Diol Complexes Encapsulated by Electrospun Tecophilic Nanofibers:Formation of Nanosilver Particles and Antimicrobial Activity.J.Am.Chem.Soc 2005,127,(7),2285-2291.
[13]Lombardino,J.G.;Wiseman,E.H.,Preparation and antiinflammatory activity of some nonacidic trisubstituted imidazoles.J.Med.Chem.1974,17,(11),1182-1188.
[14]Verras,A.;Kuntz,I.D.;Ortiz de Montellano,P.R.,Computer-assisted design of selective imidazole inhibitors for cytochrome p450 enzymes.J Med Chem 2004,47,(14),3572-9.
[15]Yan,J.M.;Jiang,Z.L.;Liu,W.Q.;et al.,Synthesis of Imidazole Cyclophane as Ligand of Binuclear Metalloprotein Models.Chinese Chem.Lett.1997,8,393-396.
[16]Garrison,J.C.;Simons,R.S.;Talley,J.M.;et al.,Synthesis and structural characterization of an imidazolium-linked cyclophane and the silver complex of an N-heterocyclic carbene-linked cyclophane.Organometallics 2001,20,(7),1276-1278.
[17]You,J.;Yu,X.;Xiang,Q.;Lan,et al.,Novel chiral imidazole cyclophane receptors:synthesis and enantioselective recognition for amino acid derivatives.Chem.Commun.2001,2001,(18),1816-1817.
[18]Alcalde,E.;Alemany,M.;Gisbert,M.,A Direct Synthetic Approach to Novel Quadrupolar[14]Azolophanes.Tetrahedron 1996,52,(48).[19]Hindi,K.M.;Siciliano,T.J.;Durmus,S.;et al.J.Med.Chem.2008,51,(6),1577-1583.
[20]Du,C.-P.;You,J.-S.;Yu,X.-Q.;et al.,Homochiral molecular tweezers as hosts for the highly enantioselective recognition of amino acid derivatives.Tetrahedron:Asymmetry 2003,14,3651-3656.
[21]Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al,Gaussian 03,Revision C.02;Gaussian,Inc.:Wallingford CT,2004.
[22]Trott,O.;Olson,A.J.,AutoDock Vina:Improving the Speed and Accuracy of Docking with a New Scoring Function,Efficient Optimization,and Multithreading.J Comput Chem 2009,31,(2),455-461.
[23]Alcalde,E.;Mesquida,N.;Pérez-García,L.;Hydrogen bonded driven anion binding by dicationic[14]imidazoliophanes.Chem.Commun.1999,(3),295-296.
[24]Murakami,Y.;Kikuchi,J.-i.;Hisaeda,et al.,Artificial Enzymes.Chem.Rev.1996,96,721-758.
[25]Langford,S.;Stoddart,J.,Self-assembly in chemical systems.Pure Appl.Chem.1996,68,1255-1260.
[26]Collantes,E.R.;III,W.J.D.,Amino Acid Side Chain Descriptors for Quantitative Structure-Activity Relationship Studies of Peptide Analogues.J.Med.Chem.1995,38,2705-2713.
Abstract:The structures of a chiral imidazole cyclophane acceptor and a series of amino acid methyl ester ligands were optimized by employing Gaussian 03 at the B3LYP with 6-31G(d)basis set.Then NBO charge distribution of the acceptor and ligands was calculated at the same level.The ligands were docked to the acceptor separately by using AutoDock Vina that resulted in the most stable conformations of complexes and affinity energy of the complexes were got consequently.A quantitative relationship between the experimentally determined stable constant and the calculated value including affinity energy and electronic charge index of side chain of amino acids was built.It was pointed out by discussion that electrostatic attraction,steric complementarity and hydrogen bond interaction are the main factors which mainly influence the recognition of chiral imidazole cyclophane for amino acid methyl esters.
Key words:imidazole cyclophane;molecular mechanics;density functional theory;molecular recognition;amino acid methyl ester
Exploration on the Molecular Recognition of a Chiral Imidazole Cyclophane for a Series of Amino Acid Methyl Esters
Lou Yongfeng1,2,Xiang Mingli1,Yang Mingli1
(1.National Key Laboratory of Biotherapy,West China Hospital,West China Medical School,Sichuan University,Chengdu 610041;2.Chemical Engineering college,Sichuan University,Chengdu 610065)

