高载药量萘普生微乳的制备及其抗炎镇痛作用实验研究Δ
李菁,王颖莉,李鹏,徐珍,谢茵,田青平#(.山西医科大学药学院,太原市 03000;.山西中医学院,太原市 03004)
高载药量萘普生微乳的制备及其抗炎镇痛作用实验研究Δ
李菁1*,王颖莉2,李鹏1,徐珍1,谢茵1,田青平1#(1.山西医科大学药学院,太原市 030001;2.山西中医学院,太原市 030024)
目的:制备载药量高的萘普生微乳,并对其进行抗炎、镇痛作用的初步药效学研究。方法:以聚山梨酯-80为表面活性剂、十四酸异丙酯为油相、乙醇为助表面活性剂,用相转变温度法制备萘普生微乳。以1%的双氯芬酸钠凝胶剂作为阳性对照药,低、中、高剂量的萘普生微乳分组局部涂抹给药后分别用二甲苯诱导小鼠耳廓肿胀、卡拉胶诱发大鼠足跖肿胀以研究萘普生微乳的抗炎作用;用热板法和扭体法观察萘普生微乳对小鼠的镇痛作用。结果:所制微乳载药量达4.2%。中、高剂量的萘普生微乳给药后能显著抑制二甲苯所致小鼠耳廓肿胀及卡拉胶所致大鼠足跖肿胀,并能明显提高小鼠的痛阈,减少小鼠醋酸刺激的扭体次数(P<0.01或P<0.05)。与阳性对照药比较,中、高剂量的萘普生微乳均显示相近或更强的抗炎镇痛作用。结论:采用相转变温度法制备的萘普生微乳对大鼠及小鼠的炎症及痛反应模型均有抑制作用,有望成为萘普生的新型给药制剂。
萘普生微乳;药效学;抗炎镇痛作用;大鼠;小鼠
萘普生是一类优良的非甾体类抗炎药,对类风湿性关节炎、骨关节炎、强直性脊椎炎、痛风、运动系统(如关节、肌肉及腱)的慢性变性疾病及轻、中度疼痛如痛经等,均有肯定疗效[1]。萘普生口服吸收迅速而完全,单次给药后2~4 h血浆浓度达峰值,但缺点是口服给药易引起“峰谷效应”及对胃黏膜有损伤[2]。
经皮给药是非甾体抗炎镇痛药有效给药途径之一,它可以提高患部药物浓度,增强局部抗炎作用,避免对胃肠道的不良反应[3]。微乳是一种外观透明、各向同性、能够自发形成、粒径小于100 nm的热力学稳定体系。它的最大优点是能提高难溶性药物的溶解度和经皮渗透能力,因而被广泛用作水难溶性非甾体类抗炎药如美洛昔康、布洛芬、酮洛芬[4~6]的局部透皮给药载体。本研究以聚山梨酯-80为表面活性剂、十四酸异丙酯为油相、乙醇为助表面活性剂,用相转变温度法制备了萘普生微乳,并对其进行了抗炎镇痛作用的初步药效学研究。
1 材料
1.1 动物
由山西医科大学实验动物中心提供。昆明种小鼠,♂,体质量22~25 g;♀,体质量18~22 g,动物合格证号:医动字第090102。Wistar大鼠,♂,体质量150~170 g,动物合格证号:医动字第090101。
1.2 试药
萘普生原料药(浙江车头制药有限公司,批号:N070708,含量:99.6%);聚山梨酯-80(天津基准化学试剂有限公司);肉豆蔻酸异丙酯(IPM,上海邦成化工有限公司);二甲苯(分析纯,天津市天新精细化工开发中心);卡拉胶(天津市博迪化工有限公司);双氯芬酸钠凝胶(武汉马应龙药业集团股份有限公司,批号:H10950214,规格:0.1g·10g-1);萘普生微乳(山西医科大学药学院制备,批号:G001,载药量:4.2%);其余试剂均为色谱纯或分析纯。
1.3 仪器
FA1104型电子天平(上海民桥精密科学仪器有限公司);千分尺(北京第二量具厂);8 mm打孔器(黄骅市亚龙仪器仪表厂)。
2 方法
2.1 微乳的制备
以聚山梨酯-80为表面活性剂、乙醇为助表面活性剂、十四酸异丙酯为油相,按表面活性剂与助表面活性剂质量比为1∶1,油相与混合表面活性剂质量比为1∶9,水含量为60%,用水滴定法制备空白微乳。
药物只有溶解后才能透过皮肤[4~6]。萘普生在聚山梨酯-80中的溶解度高出在IPM(10.25 mg·mL-1,32℃)中10倍,因此本文采用先将萘普生溶解在表面活性剂中的方法制备载药微乳。萘普生用药量大(口服剂量为1 500~2 500 mg· d-1),低的载药量可能影响其临床应用。为提高微乳载药量,本文使用了相转变温度法。将萘普生溶入聚山梨酯-80后,按上述空白微乳处方比例加入助表面活性剂、油相,搅拌均匀后,在磁力搅拌下,逐滴加入蒸馏水,直至混合均匀后,加热到80℃以上,当混合物变混浊,并出现泡沫后,撤去热源并在室温下冷却,直至澄清、透明、微黄色的微乳形成。本文以载药量为4.2%的萘普生微乳进行初步药效学研究。
2.2 抑制二甲苯致小鼠耳廓肿胀实验
取小鼠50只,♂,随机均分为5组,即低、中、高剂量(27、54、162 mg·kg-1)的微乳组,空白对照组(相当于中剂量组给药体积的空白微乳)和1%的双氯芬酸钠凝胶(阳性对照组,0.02 g)[7]。给药1 h后小鼠右耳涂20 μL二甲苯致炎,以左耳作对照。30 min后颈椎脱臼处死小鼠,沿耳廓基线剪下双耳,用直径8 mm的不锈钢圆冲沿耳缘相同部位冲下,用电子天平称重,以左右耳重差作为肿胀度,比较组间差异,并计算抑制率,肿胀抑制率=(空白对照组耳肿胀度一给药组耳肿胀度)/空白对照组耳肿胀度×100%。
2.3 抑制卡拉胶致大鼠足跖肿胀实验
取大鼠50只,♂,随机均分成5组。给药前用千分尺测定各大鼠右后肢的正常足上下径。低、中、高剂量组分别按18、36、108 mg·kg-1的萘普生微乳给药。阳性对照组大鼠涂抹1%的双氯芬酸钠凝胶0.2 g[7]。空白对照组则给予相当于中剂量组给药体积的空白微乳。给药1 h后,于各鼠右后足跖中部皮下注入1%的卡拉胶0.1 mL致炎。于致炎后30、60、90、120、240、360 min,用千分尺测定致炎侧足的上下径,计算各组的肿胀度和最大肿胀抑制率。肿胀抑制率=(空白对照组平均肿胀度-给药组平均肿胀度)/空白对照组平均肿胀度×100%。肿胀度=致炎后的足上下径-致炎前的足上下径。
2.4 抑制醋酸致小鼠扭体反应实验[3]
取小鼠120只,♀♂各半,随机均分为5组。各组小鼠用8%硫化钠腹部去毛,去毛面积不小于1.5×1.5 cm2。在去毛处,低、中、高剂量组分别按27、54、162 mg·kg-1的萘普生微乳给药。阳性对照组涂抹1%的双氯芬酸钠凝胶0.02 g。空白对照组则给予相当于中剂量组给药体积的空白微乳。给药30 min后每只小鼠腹腔注射0.6%的醋酸0.2 mL。观察记录注射致痛剂后15 min内小鼠扭体次数,计算镇痛抑制率。镇痛抑制率=(空白对照组扭体次数-给药组扭体次数)/空白对照组扭体次数×100%。
2.5 热板法测定小鼠痛阈值
将热板置于水浴槽上并与水面接触,调节恒温装置,控制水温为(55±0.5)℃。将小鼠逐只放在热板上,测定各小鼠的正常痛反应(舔后足或抬后足并回头)时间,即痛阈值。每只测2次,每次间隔5 min,以平均值在5~30 s内为合格。选出初试合格的♀小鼠120只,随机平均分为5组。萘普生微乳低、中、高剂量组分别按27、54、162 mg·kg-1给药。阳性对照组涂抹1%的双氯芬酸钠凝胶0.02 g[7]。空白对照组则给予相当于中剂量组给药体积的空白微乳。给药后分别记录15、30、45、60、90、120 min时小鼠的痛阈值,如小鼠在热板上60 s无反应按60 s计算。用下列公式计算痛阈提高百分率:痛阈提高百分率=(用药后痛阈值-用药前痛阈值)/用药前痛阈值× 100%[8]。
2.6 统计学分析
3 结果与分析
3.1 萘普生微乳对二甲苯所致小鼠耳肿胀的影响
各组小鼠耳廓肿胀度及抑制率结果见表1。
表1 各组小鼠耳廓肿胀度及抑制率比较(±s,n=10)Tab 1 Comparison of ear edema in mice and inhibition rate among those groups(±s,n=10)
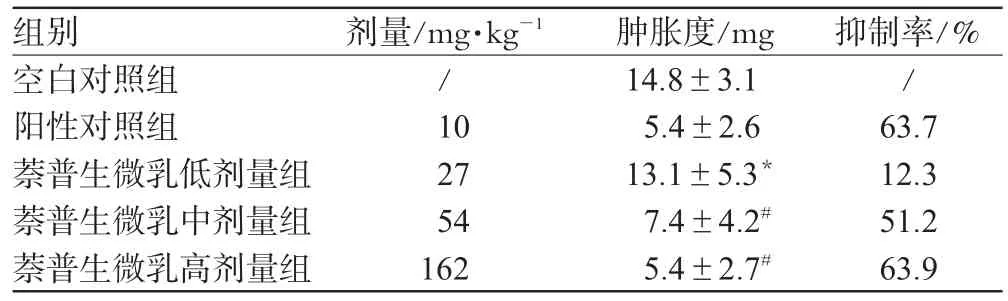
表1 各组小鼠耳廓肿胀度及抑制率比较(±s,n=10)Tab 1 Comparison of ear edema in mice and inhibition rate among those groups(±s,n=10)
与阳性对照组比较:*P<0.05,#P>0.05vs.positive control group:*P<0.05,#P>0.05
组别空白对照组阳性对照组萘普生微乳低剂量组萘普生微乳中剂量组萘普生微乳高剂量组剂量/mg·kg-1/ 10 27 54 162肿胀度/mg 14.8±3.1 5.4±2.6 13.1±5.3*7.4±4.2#5.4±2.7#抑制率/% / 63.7 12.3 51.2 63.9
由表1可见,与空白对照组比较,萘普生微乳中、高剂量组抑制率分别为51.2%和63.9%,可明显抑制二甲苯所致小鼠的耳廓肿胀(P<0.05)。低剂量组抑制作用不明显,与空白对照组比较无统计学差异(P>0.05)。萘普生中、高剂量组与阳性对照组比较无统计学差异(P>0.05),但低剂量组有统计学差异(P<0.05)。
3.2 萘普生微乳对卡拉胶致足跖肿胀作用的影响
各组大鼠足跖肿胀度及抑制率结果见表2。
如表2所示,卡拉胶致大鼠足跖肿胀作用在致炎后60~90 min达到高峰。与空白对照组比较,萘普生中、高剂量组能够显著抑制卡拉胶所致大鼠的足跖肿胀,低剂量组也表现出一定的抑制作用。低剂量组在2 h以后,抑制作用几乎消失;中剂量组在2 h抑制作用最强,之后逐渐减弱;高剂量组在2 h后抑制作用增强,直至6 h时还能维持较高的抗炎作用,抑制率达60%以上。
3.3 萘普生微乳对醋酸致小鼠扭体反应的影响
各组小鼠扭体反应结果见表3。
如表3所示,与空白对照组比较,萘普生各剂量组和阳性对照组均能明显抑制醋酸所致小鼠腹部疼痛,减少扭体反应的发生(P<0.05)。萘普生各剂量组的抑制作用具有明显的剂量依赖性。与阳性对照组比较,萘普生中、高剂量组无统计学差异(P>0.05),低剂量组有统计学差异(P<0.05)。
表2 各组大鼠足跖肿胀度及抑制率比较(±s,n=10)Tab 2 Comparison of pedal swelling in rats and inhibition rate among those groups(±s,n=10)
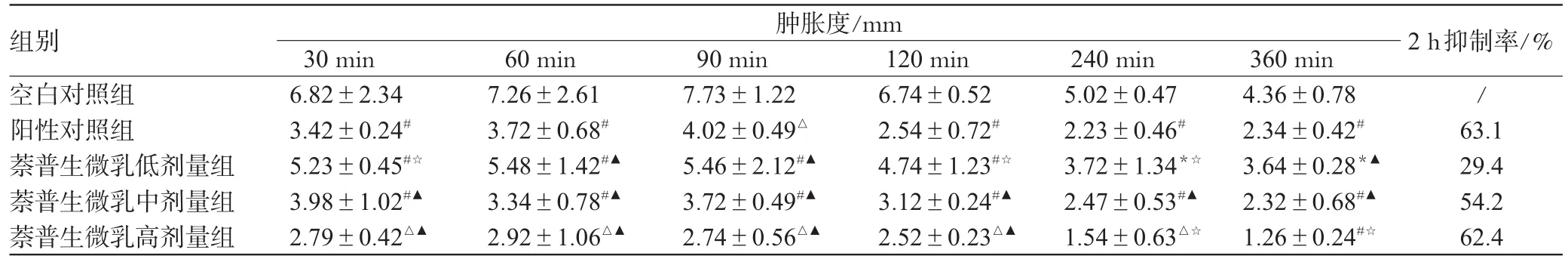
表2 各组大鼠足跖肿胀度及抑制率比较(±s,n=10)Tab 2 Comparison of pedal swelling in rats and inhibition rate among those groups(±s,n=10)
与空白对照组比较:*P>0.05,#P<0.05,△P<0. 01;与阳性对照组比较:▲P>0.05,☆P<0.05vs.blank control group:*P>0.05,#P<0.05,△P<0. 01;vs.positive control group:▲P>0.05,☆P<0.05
组别空白对照组阳性对照组萘普生微乳低剂量组萘普生微乳中剂量组萘普生微乳高剂量组肿胀度/mm 30 min 6.82±2.34 3.42±0.24#5.23±0.45#☆3.98±1.02#▲2.79±0.42△▲60 min 7.26±2.61 3.72±0.68#5.48±1.42#▲3.34±0.78#▲2.92±1.06△▲90 min 7.73±1.22 4.02±0.49△5.46±2.12#▲3.72±0.49#▲2.74±0.56△▲120 min 6.74±0.52 2.54±0.72#4.74±1.23#☆3.12±0.24#▲2.52±0.23△▲240 min 5.02±0.47 2.23±0.46#3.72±1.34*☆2.47±0.53#▲1.54±0.63△☆360 min 4.36±0.78 2.34±0.42#3.64±0.28*▲2.32±0.68#▲1.26±0.24#☆2 h抑制率/% / 63.1 29.4 54.2 62.4
表3 各组小鼠扭体次数及抑制率比较(±s,n=12)Tab 3 Writhing times and inhibition rate in each group(±s,n=12)
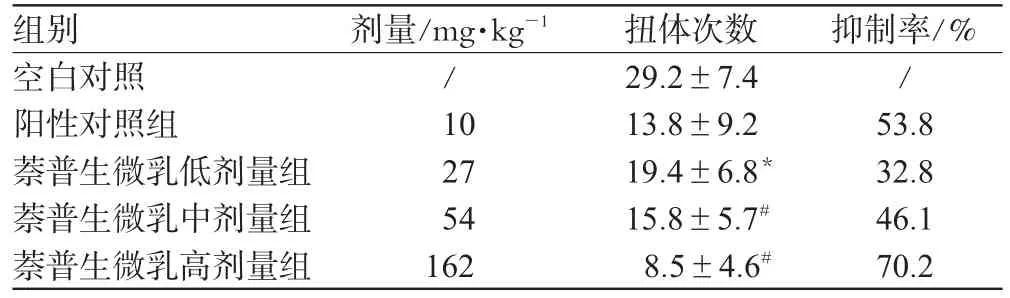
表3 各组小鼠扭体次数及抑制率比较(±s,n=12)Tab 3 Writhing times and inhibition rate in each group(±s,n=12)
与阳性对照组比较:*P<0.05,#P>0.05vs.positive control group:*P<0.05,#P>0.05
组别空白对照阳性对照组萘普生微乳低剂量组萘普生微乳中剂量组萘普生微乳高剂量组剂量/mg·kg-1/ 10 27 54 162扭体次数29.2±7.4 13.8±9.2 19.4±6.8*15.8±5.7#8.5±4.6#抑制率/% / 53.8 32.8 46.1 70.2
3.4 萘普生微乳对小鼠痛阈的影响
各组小鼠不同时间的痛阈提高百分率结果见表4。
如表4所示,与空白对照组比较,给药后阳性对照组和高、中剂量的萘普生组小鼠痛阈提高百分率明显升高。萘普生低剂量组对小鼠痛阈的提高程度小,45 min时达最大,但仅有35.6%,之后几乎没有改变。与阳性对照比较,萘普生中剂量组痛阈提高百分率无统计学差异(P>0.05)。高剂量萘普生组与空白对照组比较有显著性差异,在120 min内镇痛作用逐渐增强,且在120 min时达到最大,痛阈提高率达98%以上。
4 讨论
表4 各组小鼠痛阈提高百分率比较(±s,n=12)Tab 4 Rates of threshold of pain in each group(±s,n=12)

表4 各组小鼠痛阈提高百分率比较(±s,n=12)Tab 4 Rates of threshold of pain in each group(±s,n=12)
与空白对照组比较:*P>0.05,#P<0.05,△P<0. 01;与阳性对照组比较:▲P>0.05,☆P<0.05,★P<0.01vs.blank control group:*P>0.05,#P<0.05,△P<0. 01;vs.positive control group:▲P>0.05,☆P<0.05,★P<0.01
组别空白对照组阳性对照组萘普生微乳低剂量组萘普生微乳中剂量组萘普生微乳高剂量组剂量/mg· kg-1/ 10 27 54 162给药前痛阈/s 14±5.3 13±6.8 14±2.6 16±2.8 15±3.4痛阈提高百分率/% 15 min 10.6±4.7 41.2±8.2#29.2±18.3#▲49.2±19.2#▲64.8±16.7△▲30 min 12.2±3.2 43.6±12.7#31.4±16.7#▲51.2±23.6#▲71.2±43.4△▲45 min 16.1±2.7 60.3±21.4△35.6±24.4#☆60.4±32.8△▲76.3±22.6△▲60 min 14.9±8.2 92.2±17.6△31.7±15.6#★62.7±22.4△▲81.2±37.4△▲90 min 20.9±3.6 81.4±36.5△27.2±22.4*★61.2±23.6#▲94.2±54.6△▲120 min 22.1±9.4 60.3±21.6#26.7±13.4*☆53.8±40.3#▲98.2±43.7△☆
笔者发现,以相转变温度法制备萘普生微乳,可使微乳的载药量由原来最大值2.12%提高到4%以上。前期试验结果表明,微乳对萘普生的增溶机制是萘普生与表面活性剂在微乳中可形成氢键。萘普生分子结构中有羟基和羧基,本身能形成氢键;表面活性剂聚山梨酯-80分子结构中也有羟基和羰基,本身也能形成氢键。因加热有助于旧键的断裂和新键的形成,当采用相转变温度法时,原来分子本身之间的氢键断裂,形成更多的萘普生与聚山梨酯-80之间的氢键,使微乳的增溶能力增强。
本文以市售的1%双氯芬酸钠凝胶为阳性对照药,对萘普生微乳外用后的抗炎和镇痛作用进行了初步探讨。实验表明,低、中、高剂量的萘普生微乳能剂量依赖性地抑制醋酸致小鼠的扭体反应。中、高剂量的微乳能显著提高小鼠的痛阈,显示出与阳性对照药相近或更优的镇痛作用。
本实验以二甲苯致小鼠耳廓肿胀和卡拉胶致大鼠足跖肿胀实验来考查萘普生微乳外用后的抗炎效果。在卡拉胶诱发大鼠足跖肿胀实验中,笔者用千分尺厚度测量法计算肿胀度,避免了容积法测量时要将足跖多次浸泡在水中而引起的对药效的影响。抗炎实验结果表明,低、中、高剂量的萘普生微乳对二甲苯致小鼠耳廓肿胀和卡拉胶致大鼠足跖肿胀都有不同程度的抑制作用,萘普生中、高剂量组的抗炎效果更为显著。
综上所述,萘普生微乳局部外用后表现出较好的抗炎镇痛作用,表明萘普生经皮吸收效果良好,对急性炎症和肿胀都有肯定的疗效,为下一步开发其局部外用制剂提供了一定的基础。
[1]张伦.萘普生市场透析[J].中国药房,2003,14(6):326. [2]Brogden RN,Heel RC,Speight TM,et al.Naproxen up to date:a review of its pharmacological properties and therapeutic efficacy and use in rheumatic disease and pain states[J].Drugs,1979,18(4):241.
[3]杨其莲,卢静,张瑞雯,等.艾司氟比洛芬凝胶抗炎镇痛作用的药效学研究[J].中国新药与临床杂志,2006,25(4):266.
[4]Yuan Y,Li SM,Mo FK,et al.Investigation of microemulsion system for transdermal delivery of meloxicam[J].Int J Pharm,2006,321(9):117.
[5]陈华兵,翁婷,常雪灵.布洛芬微乳的制备及其透皮吸收研究[J].中国药学杂志,2004,39(1):42.
[6]Rhee YS,Choi JG,Chi SC,et al.Transdermal delivery of keto-profen using microemulsions[J].Int J Pharm,2001,228:161.
[7]徐叔云,卞如濂,陈修.药理实验方法学[M].第2版.北京:人民卫生出版社,1994:719、714、695.
[8]Ribeiro RA,Vale ML,Ferreira SH,et al.Analgesic effect of thalidomide on inflammatory pain[J].Eur J Pharmacol,2000,391(1~2):97.
Study on Preparation of Naproxen Microemulsion with High Drug-loading Rate and Its Anti-inflammatory and Analgesic Effect
LI Jing,LI Peng,XU Zhen,XIE Yin,TIAN Qing-ping(Dept.of Pharmacy,Shanxi Medical University,Taiyuan 030001,China)
WANG Ying-li(Shanxi College of Traditional Chinese Medicine,Taiyuan 030024,China)
OBJECTIVE:To prepare Naproxen microemulsion with high drug-loading rate and study its anti-inflammatory and analgesic effect.METHODS:Naproxen microemulsion was prepared by phase transfer temperature(PIT)method with polysorbate-80 as surfactants,alcohol as cosurfactant and isopropyl myristate as oil phase.1%dichlofenac sodium gel was used as positive control.High-dose group,medium-dose group and low-dose group were treated with Naproxen microemulsion.Then xylene and carrageenan were used to induce ear edema in mice and pedal swelling in rats respectively in order to study anti-inflammatory effect of Naproxen microemulsion.The hot-plate test and writhing test were adopted to study the analgesic effect.RESULTS:Drug-loading rate of preparation reached 4.2%.Xylene-inducing ear edema in mice and carrageen-inducing pedal swelling in rats were relieved significantly by treating with middle dose and high dose Naproxen microemulsion.The threshold of pain in mice was also increased and writhing times caused by acetic acid decreased(P<0.01 or P<0.05).Medium dose and high dose Naproxen microemulsion was equal or superior to positive control in anti-inflammatory and analgesic effect.CONCLUSION:Naproxen microemulsion prepared by PIT method shows obvious anti-inflammatory and analgesic effect in mice and rats,which may be a new type of naproxen preparation.
Naproxen microemulsion;Pharmacodynamics;Anti-inflammatory and analgesic effect;Rats;Mice
R 965;R971+.4
A
1001-0408(2010)05-0406-03
2009-06-03
2009-08-03)
Δ山西省科技厅农业科技攻关项目资助(2007032013)
*硕士研究生。研究方向:微乳透皮给药系统。E-mail:jing. lee@163.com
#通讯作者:副教授,博士。研究方向:药理学。电话:0351-4690955。E-mail:tianqp123456@163.com

