鸡白痢沙门氏菌CVCC578标准株VBNC研究模型的建立及鉴定
李 影,段 锐,孙晓媛,钱爱东,王伟利
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.吉林省辽源市畜牧总站,吉林辽源 136200;3.吉林出入境检验检疫局检验检疫技术中心,吉林长春 130062)
鸡白痢沙门氏菌CVCC578标准株VBNC研究模型的建立及鉴定
李 影1*,段 锐2,孙晓媛1,钱爱东1,王伟利3
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.吉林省辽源市畜牧总站,吉林辽源 136200;3.吉林出入境检验检疫局检验检疫技术中心,吉林长春 130062)
为建立活的非可培养状态(VBNC)研究模型,本研究利用液体LB和4℃联合条件对鸡白痢沙门氏菌CVCC578参考株的进行VBNC诱导,构建VBNC研究模型。同时依靠胎牛血清和程序性升温对处于该状态的菌体进行复苏,并对复苏前后的细菌进行了16S rRNA验证。结果表明:实验菌株经液体LB和4℃联合诱导后,可培养菌数在55 d后降至零,总菌数在整个观察期内基本不变,而活菌数在150 d后开始下降,180 d后下降显著,表明实验菌株可在55 d进入VBNC,而且维持时间至180 d。当进入该状态后,菌体形态可由杆状变为球杆或球形,并且菌体排列可由单在变为聚集。经复苏和16S rRNA鉴定后,“变态”的细菌被证实为沙门氏菌,而非杂污染菌。该实验为规范VBNC沙门氏菌的鉴定程序以及制订相应的国家检测标准提供了实验依据。
鸡白痢沙门氏菌;活的非可培养状态;复苏;16S rRNA
沙门氏菌是肠杆菌科中引起人类和动物发病及食物中毒的主要病原菌之一。据世界卫生组织的报告,1985年以来在世界范围内由沙门氏菌引起的已确诊的人类患病人数显著增加,在一些欧洲国家已增加五倍以上。在我国内陆地区,由沙门氏菌引起的食物中毒屡居首位[1]。食物中毒的主要来源是肉类食品,其中含有丰富的营养成分,适于沙门氏菌的繁殖,摄入后在沙门氏菌毒素的作用下发生食物中毒[2]。
目前,我国质检系统在细菌检测方面仍采用传统的细菌培养方法,这种方法只能检测出在培养基上可生长的细菌。然而对于一些进入了“活的非可培养状态”(Viable but non-culturable,VBNC)的细菌而言,无论是采用传统的培养技术或敏感性高的PCR技术及基因芯片技术也很难检测到,并且极易被认定是“死”菌。尽管细菌在不良环境中进入VBNC后,仍保持了致病性,但丧失了在培养基中生长的能力,成为“隐性”传染源[3]。因此,一旦沙门氏菌进入VBNC,以现行检测方法往往会造成漏检。然而,一定条件下VBNC菌的复苏,即恢复到可培养状态,可再次造成暴发性流行。为此,本研究以鸡白痢沙门氏菌为研究对象,通过建立和验证VBNC研究模型,旨在为进一步建立针对VBNC沙门氏菌的检测方法和制订相应的国家检验标准打下提供实验依据。
1 材料和方法
1.1 实验菌株 鸡白痢沙门氏菌CVCC578参考株,购自中国兽医药品监察所。
1.2 主要试剂 SS琼脂购自日本荣研化学株式会社,LIVE/DEADRBaclightTMBacterial Viability Kit(13152)购自Probes MoLecuLar公司,大豆蛋白胨和酵母粉购自英国Oxoid公司,标准胎牛血清、细菌总DNA提取试剂盒、PCR试剂均购自TaKaRa公司,DNA回收纯化试剂盒购自BioFlux公司等。
1.3 菌株培养 将实验菌株接种至含50 mL LB液体培养基的中,37℃,200 r/min,通气振荡培养过夜,当OD600nm接近0.7时终止培养。
1.4 VBNC状态诱导 取1 mL菌液至无菌离心管中,6 000 r/min离心5 min,弃上清,用灭菌生理盐水洗菌体2次,接入100 mL的LB液体培养基中,将细菌数调整菌数至108CFU/mL。然后将菌在4℃和需氧条件下培养。同时每隔5 d取平板计数,检查可培养菌数变化,同时按文献[4]进行荧光显微镜观察确定沙门氏菌的“活与死”,以及形态等变化情况,设立正常培养菌作为对照。
1.5 可培养菌数测定 取菌液1 mL,6 000 r/min,离心5 min,弃上清,用灭菌生理盐水洗菌体2次后,进行10倍系列稀释,取100 μL适当稀释度的菌液涂于SS平板上,37℃培养,次日观察计数菌落。当平板无菌落生长时,续续培养3 d,若仍无菌落出现,则菌落数计为1。
1.6 总菌数与活菌数测定 利用LIVE/DEAD试剂盒中的SYTO9和PI分别测定呈现绿色荧的活菌和呈现红色荧光的死菌,总菌数即为活菌与死菌之和。当可培养菌数降至零时,尚需每隔20 d~30 d测定总菌数与活菌数,具体操作参见文献[5]。
1.7 VBNC细菌复苏鉴定 取 VBNC菌 1 mL,6 000 r/min离心5 min,弃上清,用灭菌生理盐水清洗菌体沉淀2次,菌体沉淀用灭菌双蒸水100 μL溶解。加入200 μL的无菌胎牛血清,混匀,将其置于热程控循环仪孔内,按15℃,20 min~30 min 25℃,1 h~1.5 h 37℃,1 h~1.5 h程序对细菌进行孵育。其后,将菌液倒入SS液体培养基中,并放入气浴振荡摇床内,220 r/min,有氧培养,每隔1 h取样进行平板计数。同时设只添加胎牛血清且不含VBNC细菌液的SS培养基为对照。
1.8 16S rRNA鉴定 采用已发表的沙门氏菌通用引物[6-7]即 27-F:5'-AGAGTTTGATCMTGGCTC-3'和1492-R: 5'-GGTTACCTTGTTACGACTT-3', 其 PCR扩增片段约为1 500 bp。利用细菌总DNA提取试剂盒分别提取正常培养条件、VBNC状态及复苏后的细菌总DNA,具体操作按说明书进行。在PCR反应体系中依次加入 10×PCR Buffer 2 μL,dNTP Mixture(各2.5 mM)2 μL,上下游引物均为10 pmoL,ExTaq酶2.5 U,模板DNA 2 μL,最后用灭菌双蒸水补至50 μL,每次反应均设水为空白对照。按94℃8 min;94℃ 40 s、58℃1 min、72℃,90 s;30个循环,72℃10 min。扩增产物用1.0%的琼脂糖凝胶电泳检测,并用BioFlux公司的Biospin胶回收试剂盒回收。PCR产物由TaKaRa公司测序,应用在线Blast进行比对验证。
2 结 果
2.1 菌数测定结果 实验菌株的可培养菌数在培养25 d后可培养菌数急剧下降,同时到了35 d时下降较缓和,55 d后可培养数降为零。而测得总菌数和活菌数在55 d内随时间基本保持不变,说明确实存在无培养能力的活菌,表明实验菌株在55 d时进入了VBNC。由图1可知,尽管在186 d内总菌数仍基本不变,但活菌数却已经下降了105倍,特别是在180 d后,活菌数开始显著下降,这表明在55 d至180 d期间,实验菌株一直处于VBNC状态,即VBNC维持时间不超过125 d。
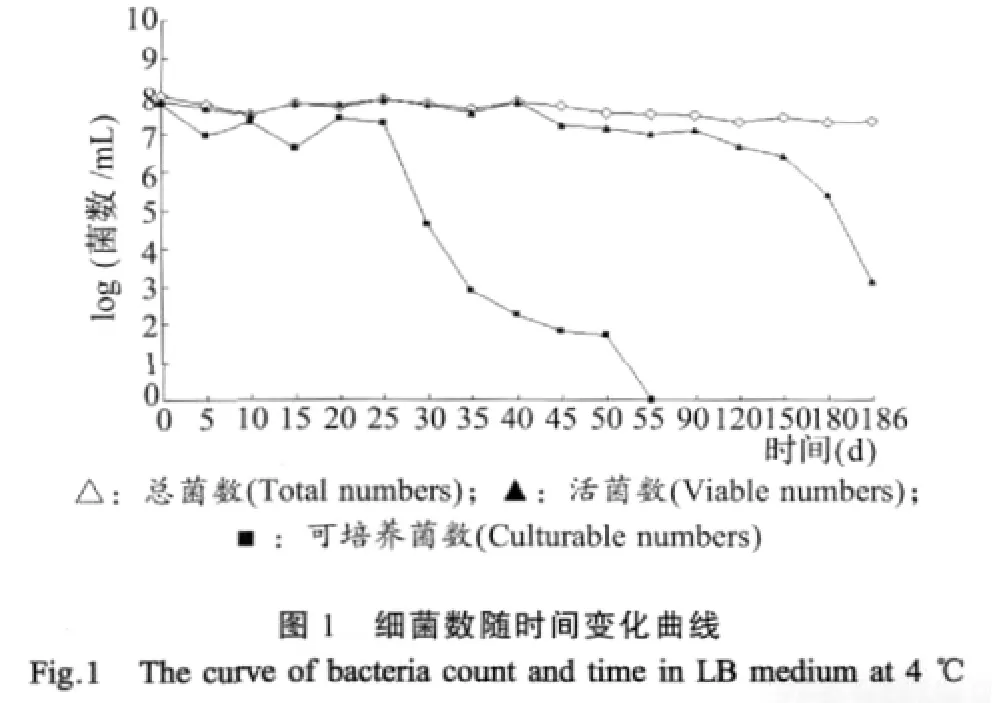
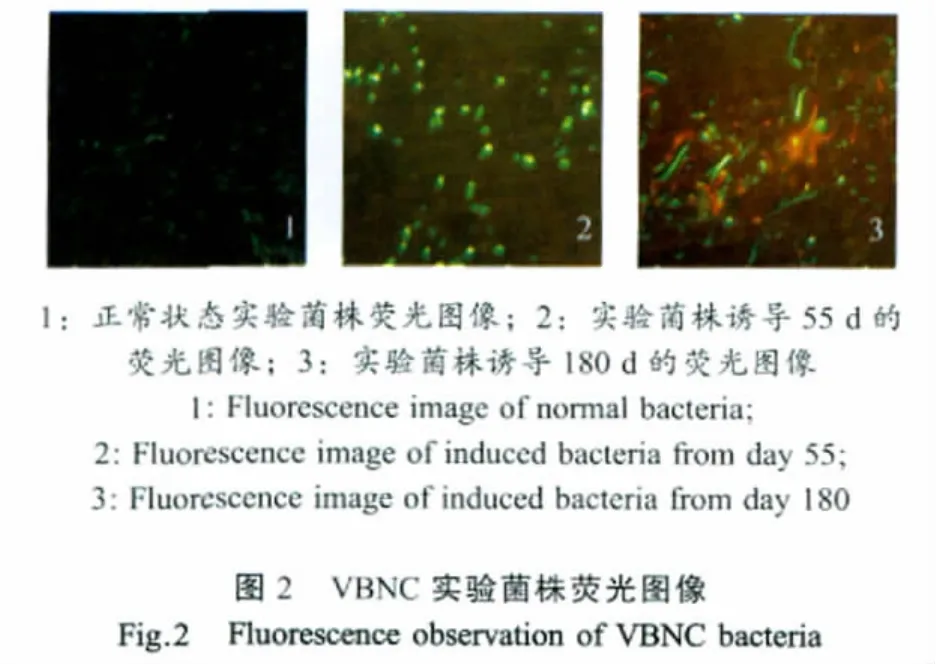
2.2 VBNC沙门氏菌荧光观察结果 实验菌株在正常状态下多为短小杆菌,并完全呈现绿色荧光(图2-1)。当可培养菌数降为零时(55 d),多数细菌菌体形态发生了变化,即由短杆变为球杆形,有的甚至为球形,同时还观察到个别呈现红色荧光的死菌(图2-2)。然而在VBNC维持期内(55 d~180 d)菌体的交联度明显增强,出现了“链杆菌”(图2-3)。并且在180 d后,红色死菌也明显增多,结合菌数测定结果可知,实验菌株在180 d后开始由VBNC状态转入真正的死亡期。
2.3 VBNC沙门氏菌复苏结果 选择55 d~180 d的VBNC菌液进行复苏。结果表明:55 d、85 d和100 d时的细菌能得到有效复苏,分别在4 h、6 h和6 h时可培养菌数突然显著增长,而且复苏的细菌数接近诱导前水平。由此表明,实验菌株在LB和4℃联合诱导可进入VBNC,在胎牛血清及程序升温条件下可重新恢复为可培养状态。但随着诱导时间延长,具有复苏能力的细菌逐渐减少,120 d后的VBNC细菌却无法实现复苏(表1)。

表1 VBNC沙门氏菌复苏结果Table 1 The resuscitation ofSalmonellafrom VBNC
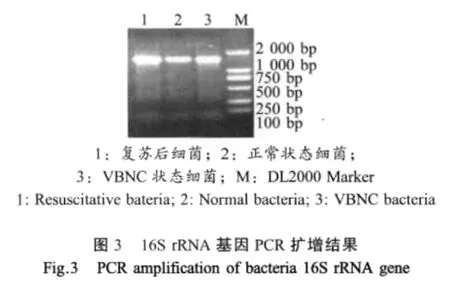
2.4 16S rRNA基因PCR扩增结果 PCR扩增产物在1%琼脂糖凝胶电泳上呈单一条带,约为1 500 bp,与预期大小相符(图3)。
2.5 序列分析结果 将经过PCR检测的产物直接测序(序列略),利用在线 Align two(or more)sequences using BLAST(bl2seq)功能分别比较了VBNC与正常,复苏后与正常,VBNC与复苏后等3种情况。经分析,这3种情况的核苷酸同源性分别为98%、97%和97%。由于16S rRNA序列的同源性大于97%的便可认为是同一种菌[8],故而证实了实验菌株在VBNC诱导与复苏过程中,在形态及排列方面所反映出的变化实为同一种细菌所呈现的,而非杂菌污染。
3 讨论
目前,被多数人接受和承认的判定细菌是否进入VBNC的依据仍源自于许怀恕等人于1982年提出的VBNC概念,即指细菌在不良环境中,细胞缩成球形,用常规方法(平板法、最大可能近似值法)培养时,不能生长繁殖,但仍然是活的一种特殊存在形式,在适宜条件下可恢复为可培养状态[9]。现将VBNC判定程序归纳如下:首先在可培养数为零前提下,总菌数要基本不变,活菌数可以有所变化,但不能显著或急剧下降。其次,进入VBNC后,菌体可在形态、体积、排列、蛋白质组成等某些或其它方面所有变化。再次,细菌可在正常与VBNC状态间自行转变,即应找到适合的诱导因素和适宜的复苏条件。最后,为消除杂菌污染等质疑,需利用分子生物学技术,如探针、16S rRNA等加以确定。在研究过程中,实验菌株在55 d时形态就已经发生改变,而且在VBNC维持期内细菌的聚集程度也逐渐增加,出现了一些“链杆菌”。因而为消除细菌因形态及排列变化所带来的质疑,本实验除提取55 d时VBNC菌的总DNA外,还随机选取了87 d、118 d和155 d时的VBNC菌DNA,16S rRNA方法所扩增的实为处于不同时期VBNC菌的DNA的混合物。
综合以上考虑,本研究在LB和4℃联合诱导55 d后,成功建立了鸡白痢沙门氏菌CVCC578参考株的VBNC研究模型。该模型完全符合细菌VBNC的定义,同时也具备如下生物学特点和意义。特点:1.丧失了在平板上生长繁殖能力,但经胎牛血清与程序性升温共同作用后可重新恢复可培养能力。2.模型中细菌形态发生变化(杆状变为球杆或球形),但经复苏和16S RNA鉴定,“变态”的细菌证实为沙门氏菌,而非杂菌污染。3.进入VBNC时间为55 d,维持时间为125 d,但复苏较好时机应选120 d前。意义:1.为VBNC细菌鉴定提供了值得参与和借鉴的研究程序和依据,使VBNC细菌的认定更加规范和具体。2.以沙门氏菌参考株用为研究对象,为制订和建立针对食源性沙门氏菌检测的国家标准做好前期研究工作。
[1]黄文宇,柳陈坚.食源性沙门氏菌检测方法的研究进展[J].生物技术,2009,19(3):95-98.
[2]王洪霞,张代涛,李志峰,等.汤卜逊沙门菌暴发分离株的鉴定及与丙型副伤寒沙门菌的鉴别[J].中国人兽共患病学报,2009,25(4):348-351.
[3]李影,王伟利,钱爱东.畜产中相关食源性致病菌“活的非可培养状态”的检测策略[J].中国动物检疫,2009,26(1):46-47.
[4]孙晓媛,钱爱东,李影.三株沙门氏菌VBNC状态诱导条件的筛选[J].中国预防兽医学报,2009,31(1):193-197.
[5]李影,魏忠彬,钱爱东,等.低浓度冰醋酸诱导的鸡源大肠杆菌活的非可培养状态的研究[J].中国兽医学报,2007,27(5):645-648.
[6]Corby-Harris V,Pontaroli A C.Geographical distribution and diversity ofbacteria associated with natural populations of Drosophila melanogaster[J].Appl Environ Microbiol,2007,73:3470-3479.
[7]李可,郑天凌,田蕴,等.南美白对虾肠道微生物群落的分子分析[J].微生物学报,2007,47(4):649-653.
[8]李永峰,任南琪,杨传平,等.16S rDNA测序快速鉴定废水生物处理系统目标细菌[J].哈尔滨工程大学学报,2005,26(6):806-810.
[9]Xu H S,Roberts N,Singleton F L,et al.Survival and viability of nonculmmblcE.coiland Vibrio cholerar in the estuarine and marine environment[J].Microb Ecol,1982,8(4):313-323.
Establishment of a model for viable but non-culturable withSalmonella pullorumCVCC578 standard strain
LI Ying1*,DUAN Rui2,SUN Xiao-yuan1,QIAN Ai-dong1,WANG Wei-li3
(1.College of Animal Science Jilin Agriculture University,Changchun 130118,China;2.Liaoyuan Animal Husbandry Stationary,Liaoyuan 136200,China;3.Jilin EntryExit Inspection and Quarantine Bureau,Changchun 130062,China)
In this study,the viable but non-culturable(VBNC)Salmonella pullorumCVCC578 standard strain was induced in LB medium at 4℃in order to establish a model for VBNC bacteria identificaction and detection.VBNCSalmonella pullorumwas resuscitated with fetal bovine serum and gradient incubated temperatures,and resuscitation and non-resuscitation of bacteria were identified by the presence of 16S rRNA.The results showed that the culturable counts ofSalmonella pullorumdecreased to zero by 55 days inducing.The total counts were unchanged with the prolonged inducing time,however viable count rapidly decreased by 180 days.TheSalmonella pullorumstrain entered VBNC at 55 days and non-culturable cells remained viable for up to 180 days.Cell shape changed from bacilus to coccus and cell alignment also changed from existing alone to gathering into VBNC.This studies established the foundation for VBNC cells identificaction and detection standard.
Salmonella pullorum;viable but non-culturable;resuscitation;16S rRNA
S852.61
A
1008-0589(2010)03-0179-04
*Correspondingauthor
2009-07-26
国家自然科学基金(30700594);高等学校博士学科点专项科研基金(20070193002)资助
李 影(1977-),女,吉林通化人,副教授,博士,主要从事动物微生物学教学与科研工作.
*通信作者:E-mail:thliying@163.com
(本文编辑:赵晓岩)

