补阳还五汤对老年黄斑变性实验性大鼠的干预研究
刘中文 潘晓燕 孔炳华 钟秀凤 吴君舒中山大学中山眼科中心·眼科学国家重点实验室(510060 )
补阳还五汤对老年黄斑变性实验性大鼠的干预研究
刘中文 潘晓燕 孔炳华 钟秀凤 吴君舒
中山大学中山眼科中心·眼科学国家重点实验室(510060 )
目的 探讨补阳还五汤对老年黄斑变性实验性大鼠的防护作用。方法 Sprague—Dawley(SD)大鼠随机分为三组:正常对照组、阳性对照组、补阳还五汤治疗组。通过2000Lux白色冷光源对SD大鼠进行24h持续性照射,建立视网膜光损伤模型。采用食道灌胃进药方法,于光照前24h及光照前30min2次用药。观察视网膜组织形态学改变;ERG检查视网膜功能;检查视网膜超氧化物歧化酶(superocide disnutase,SOD)活力及丙二醛(Malondialdehyde,MAD)和一氧化氮(Nitric Oxide,NO)的含量。结果 ①形态学检查:阳性对照组光感受器内外节排列紊乱,分界不清,外节膜盘叠状结构解离,呈空泡状变性,内节线粒体肿胀、内嵴增宽,外核层水肿、变性、变薄,约5-6个细胞核厚度,染色质聚集,核膜皱缩,可见较多染色质浓染及凋亡细胞。补阳还五汤治疗组视网膜结构清晰,内外节分界清楚,外核层排列整齐,约10~11个细胞核厚度,未见明显凋亡细胞改变。②ERG检查:正常大鼠ERG暗视混合反应b波振幅为268.663±95.252μν,阳性对照组b波振幅下降到光照前的29.68%,补阳还五汤治疗组b波振幅图是个升高到63.37%(P<0.05)。③SOD、MDA、NO检测:正常组SOD4.218±0.512U/gprot,阳性对照组SOD活力下降(P<0.05),补阳还五汤治疗组与阳性对照组对比其SOD活力明显升高(P<0.05)。正常对照组MDA、NO含量分别为0.139±0.023nmol/mgprot,0.282±0.046μmol/gprot阳性对照组MDA、NO含量明显升高(P<0.05),而补阳还五汤治疗组与阳性对照组对比,其MDA、NO含量明显下降(P<0.05)。结论 补阳还五汤可通过改善视网膜光损伤后的氧化应激状态,保护线粒体,改善能量代谢障碍,保护视网膜功能,实现对老年黄斑变性的防护。
补阳还五汤;老年黄斑变性;视网膜;自由基
老年黄斑变性(age-related macular degeneration,AMD)是黄斑区视网膜组织退行性病变,视网膜是视觉形成的重要结构,同时也是容易受到光损伤的部位。AMD发病机制与长期低强度光照的积累效果有关[1],视网膜损伤的发生部位也与AMD等病的病理改变近似[2],外层视网膜,尤其是光感受器外段最早受累。Klein等[3]发现,各种类型的AMD患病率随着年龄的增加而升高。而对于这种严重危害视力的疾病,目前尚无理想的治疗措施。因此防治AMD的研究对于防盲治盲具有重要意义。
1 资料与方法
1.1 实验动物及分组 选用健康无眼病成年SD大鼠42只,雄性,体重180~220g,由广东省医学实验动物中心提供。随机分为3组:正常对照组,阳性对照组,补阳还五汤组,每组各14只。
1.2 视网膜光损伤模型的制备 自制无色透明有机玻璃光照箱,20cm×20cm×20cm.光照箱四面具有排风孔。悬挂于自制光照架内,光照架的6个面分别放置一根白色冷光源荧光灯管。调节各荧光灯与光照箱之间的距离,使箱内各箱壁处光照强度为(2000±100)Lux(ST-80A数字式光照度检测仪,上海大光电仪器厂出产),箱内中心各方向照度 2000Lux,工作温度控制在22~25℃左右。所有试用大鼠均在12h明(30~50Lux)12h暗的明暗循环光环境中适应7天,光照前暗适应24h,然后逐只进入光照箱,接受24h持续光照射(早上8:00一次日早上8:00)。大鼠未经散瞳及麻醉,不限制活动和饮食,光照后送回暗环境中饲养。
1.3 给药方案 所有动物采用经食道灌胃进药方法。于光照前24h及0.5h给药,共2次。补阳还五汤组药物剂量:900mg/(kg·d),药物浓度为60mg/ml,正常对照组及阳性对照组大鼠每只灌水3ml灭菌水。
1.4 视网膜电图 使用日本Nihon Kohden公司产的Nerropack II MEB-5100型电生理仪记录视网膜电图(electroretinogram.ERG)信号反应。通频带0.5~100Hz,扫描时间100ms。刺激器为美国LKC公司产的2503型全视野刺激器,GrassPs22型闪光刺激器提供闪光。选用I1610.72cd.s/m2强度的闪光刺激记录暗视闪光ERG。参照ISCEV2004电生理检查标准,所有ERG操作均在微弱的红光下暗室内进行。动物暗适应2h后,双眼用复方托品酰胺眼液点眼一次散大瞳孔,5min后用10%水合氯醛腹腔注射麻醉,复方托品酰胺再点眼一次。待大鼠呼吸平稳,进入麻醉状态后,双眼点1%丁卡因表面麻醉。将大鼠固定于检查台上,测量眼安放自制环状铂金线电极(直径约占0.5mm)尽量与角膜接触,加1%甲基纤维素以润滑。参考电极为针状置舌下,接地电极置与尾部,用酒精擦拭皮肤,尽量使电极与皮肤接触。操作时关红光,单次白色闪光刺激,每眼测3次,每次间隔20秒。记录暗视混合反应,测b波振幅并进行统计分析。
1.5 视网膜组织形态学观察 光镜检查步骤:10%水合氯醛溶液(5ml/kg)腹腔注射深度麻醉动物,于眼球的12点钟方位缝线标记定位,断颈处死后立即取眼球,投入混合固定液(冰醋酸、甲醛、蒸馏水和95%乙醇按l:2:7:10配置)中固定,3小时后转移至4%多聚甲醛中固定过夜;沿标记缝线─视神经连线对剖眼球并取其颞侧,除去晶体,再沿标记缝线─视神经对剖取上方眼球;梯度酒精脱水;二甲苯透明;石蜡包埋;经视乳头旁开lmm纵向切片,制成5μm厚的切片;常规脱蜡,双蒸水水化,行常规苏木素一伊红(HE)染色;中性树脂封片。用数字摄像系统采集照片。电镜检查步骤如下:10%水合氯醛溶液(5ml/kg)腹腔注射深度麻醉动物,断颈处死后立即摘除眼球,常规于3%戊二醛中固定过夜,在解剖显微镜下,去除眼前节,保留眼杯,取视乳头颞侧lmm上方眼球壁全层1mm×lmm,再以1%四氧化锇后固定,丙酮及酒精逐级脱水,环氧树脂EPON812包埋,超薄切片,醋酸铀和柠檬酸铅染色,日立H-600透射电镜作超微结构观察及选择满意部位拍片。
1.6 视网膜组织超氧化物歧化酶(SOD)活性、丙二醛(MDA)、一氧化氮(N0)的含量的测定 试剂:考马斯亮兰蛋白测定试剂盒、SOD、MDA、N0试剂盒均购自南京建成生物工程研究所。步骤:10%水合氯醛腹腔注射麻醉后脱颈椎法处死动物,迅速摘除眼球。在冰环境中环形切开角巩膜缘,弃去眼前节和晶状体,外翻眼球壁,在解剖显微镜下全层钝性剥离视网膜,将同一大鼠两个眼球的视网膜组织合并作为一个标本,用滤纸吸去表面液体,以精密分析天平称取视网膜湿重,再用冰生理盐水配成2%的湿重,超声粉碎后匀浆。匀浆液于4℃低温离心机以3500rpm离心15min,取出上清液。首先测标本蛋白量,操作步骤按考马斯亮兰蛋白测定试剂盒说明。紫外分光光度计测标准管和测定管的吸光度,得出标准曲线的相关度(R2)须≥0.98且测定管蛋白浓度范围在0.3~0.7之间才进行SOD、MDA、N0检测。总SOD采用黄嘌呤氧化酶法测其活力,MDA采用硫代巴比妥酸法测其含量。N0采用硝酸还原酶法将NO3-还原为NO2-,比色法测定其浓度。
1.7 统计学分析 所有统计学分析采用SPSS10.0医学统计软件进行,结果以均数±标准差表示,各组均数比较采用单因素方差分析检验,P<0.05,差异有统计学意义。
2 结果
2.1 ERG检测 光照前后每只大鼠每个眼均测量3次,取其中间值为记录值。正常大鼠ERG暗视混合反应b波振幅为(268.663±95.252)μν,阳性对照组b波振幅下降到(80.986 ±26.286)μν,为光照前的29.68%,与正常组别比较差异有显著性(P<0.05),补阳还五汤组ERG暗视混合反应b波振幅分别为光照前的63.37%,与正常组比较差异有显著性(P<0.05),与阳性对照组比较差异有显著性(P<0.05)。见表1
2.2 形态学观察 ①正常对照组 光镜:视网膜形态正常,结构层次清楚,光感受器内外节排列整齐规则,分层清楚,结构清晰,着色均匀,外核层形态规整,约有12~13个细胞核厚度,RPE层排列整齐,形态正常。电镜:外节膜盘密集呈板层状整齐排列;内节线粒体丰富,排列规则,嵴连续,结构清晰,呈卵圆形或长梭形;外核层细胞核形态规则,染色质分布均匀。②阳性对照组 光镜:视网膜内、外节排列紊乱,分界不清,外节结构模糊,叠状结构解离,呈空泡装变性,未见正常结构;内节线粒体肿胀,内嵴增宽;外核层水肿、变性、变薄,每5~6个细胞核厚度,细胞间隙较大,染色质聚集,核膜皱缩,可见较多固缩细胞核。电镜:光感受器外节膜肿胀模糊,排列紊乱,膜间隙较大,出现分离、崩解、空泡变性;内节线粒体肿胀,嵴端断裂,部分空泡变性;外核层大量核膜皱缩、内陷,染色质聚集、浓度不均,可见较多凋亡细胞。③补阳还五汤组光镜:视网膜结构破坏较轻,内、外节分界清楚,结构清晰,外核层排列整齐,约10~11个胞核厚度。电镜:视网膜损伤轻,仅表现为外节膜盘排列轻度紊乱,内节线粒体轻度肿胀,外核层未见明显凋亡细胞的改变。各组视网膜RPE层排列较整齐形态规整,未见明显病理改变。内核层、节细胞层未见明显病理改变、炎症及坏死细胞。
2.3 SOD活力、MDA、NO检测 大量研究表明,视网膜光损伤是由于机体代谢失调,通过酶系统和非酶系统产生自由基,引发脂质过氧化,导致一系列损害所致。如表2所示,阳性对照组SOD活力较正常对照组明显降低(P<0.05),MDA和NO的含量明显升高(P<0.05),经过补阳还五汤治疗后,大鼠视网膜光损伤后SOD活力较阳性对照组有明显提高(P<0.05),NO的含量和MDA含量较阳性组有显著下降(P<0.05)。(见表2)
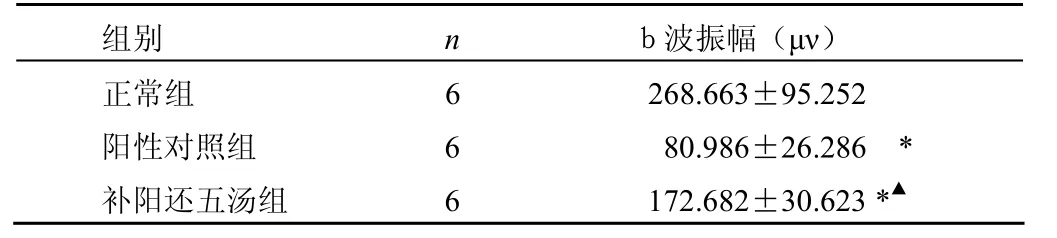
表1 ERG暗视混合反应b波振幅改变
3 讨论
老年黄斑变性是多发于45岁以上,患者的黄斑区视网膜组织退行性病变,包括黄斑区脉络膜玻璃膜疣,视网膜色素上皮区域性萎缩、黄斑区脉络膜新生血管膜、视网膜色素上皮细胞脱离、黄斑区盘状退行性变或盘状瘢痕等。视网膜是大脑的延伸,光感受器细胞也是终末分裂的神经细胞,有着复杂的神经活动。故我们考虑视网膜疾病的治疗可借鉴神经系统疾病的治疗方法。

表2 视网膜SOD活力、MDA、NO检测
视网膜光损伤是光照激发产生自由基,引起组织发生过氧化的结果[4]。一氧化氮(nitricoxide,NO)是一种活性很强的自由基,一种新型的神经递质,它参与机体多种生理和病理过程,内源性NO产生于L—精氨酸(L—arginine,L-Arg)的末端,其化学反应需要一氧化氮合酶(nitric oxide synthase,NOS)的催化,NOS有神经元型、诱导型和内皮型3种异构体,为合成NO的限速酶,广泛分布于视网膜的各层细胞中,正常生理状态视网膜组织中有NOS的表达,含NOS部位的NO可维持低浓度参与血液循环的调节和视觉信息的传递,但在某些病理状态下,视网膜内NOS表达可能增加,产生过量的NO,而高浓度的NO对视网膜组织具有毒性破坏作用[5],由于NO在体内的半衰期短(5~10s),迅速氧化生成稳定的亚硝酸盐(NO2-)和硝酸盐(NO3-),故可以通过测定NO2-/NO3-来间接地反映组织内的NO浓度[6,7]。视网膜受到光刺激后,视紫红质吸收光子,激发电离,产生大量自由基。NO与超氧自由基结合,分解出毒性更大的羟基自由基,NO还可通过被动转运很快离开细胞,而对邻近细胞产生毒性作用,此外还可通过介导谷氨酸等兴奋性氨基酸导致其受体依赖性钙通道的开放,致使Ca2+大量内流,而引起NOS活性升高,进而导致NO合成增多[8]。同时NO大量的释放又可造成神经组织的损害,反过来促使兴奋性氨基酸的释放,二者形成了恶性循环,加重对视网膜的损伤。在此过程中NOS成为二者联结的关键。过量的NO还可产生神经毒性作用,主要在于:①NO可引起细胞亚硝酸化,破坏DNA的螺旋结构,导致细胞损伤。②NO可与超氧阴离子反应生成超氧亚硝酸根离子,后者及其分解产物羟自由基可引起细胞毒性损伤。③NO可与含亚铁原卟啉基因的铁原子结合,形成亚硝酰铁络合物,从而抑制某些与细胞呼吸和DNA复制有关的关键酶的活性[9]。光损伤时过多的NO可生成过氧亚硝基,后者具有极强的氧化攻击力,使超氧化物歧化酶(Superocide Disnutase,SOD)发生酪氨酸硝基化而失活,从而破坏细胞的抗氧化系统并最终导致氧化损伤[10]。因此认为NO在视网膜光损伤起重要作用[11]。
补阳还五汤(黄芪60g,当归尾6g,地龙3g,赤芍药6g,川芎3g,桃仁3g,红花3g )由补气药和活血祛瘀药相配伍而成。临床研究表明对脑血栓、脑动脉硬化、冠心病等有确切疗效[11,12]。补阳还五汤能减少损伤过程中一氧化氮和氧自由基的生成,提示对心肌细胞的保护机制与清除氧自由基、抑制脂质过氧化作用有关[14]。本课题研究表明,补阳还五汤可通过改善视网膜光损伤后的氧化应激状态,保护线粒体,改善能量代谢障碍,保护视网膜功能,实现对老年黄斑变性的防护。
[1] Daniel T, Organisciak RM, Darrow LB, et al. Light history and age-related changes in retinal light damage. Invest Ophthalmol Vis Sci, 1998,39:1107-1116.
[2] Young RW. Solar radiation and age-related macular degeneration.Surv Ophthalmol, 1998,32:252.
[3] Klein R,Kiein B,Linton K. Prevalence of age-related maculopathy. The Beaver Dam Eye Study Ophthalmology,1992,99:9333-9943.
[4] 陈为亨,张惠蓉.眼光损伤性的自由机理[J].国外医学..眼科学分册,1992, 16:199.
[5] Mocada S, Palmer RM, Higgs EA. Nitric oxide: physiology, Pathophsiology, and pharmacology. Pharmacol Rev,1991,43:109-142.
[6] 余跃,陈新加,潭红,等.一氧化氮与疾病[M].北京:科学出版社,1998,54-55.
[7] Marletta MA . Nitric oxide synthase structure and mechanism. J Biol Chem,1993,268(17):12231-12234.
[8] Schousboe A,Frandsen A, Wahl P, et al. Neuro toxicity and excitatory aminoacieant agonists[J]. Neurotoxicology,1994,15:477-481.
[9] 金祥娜,万青.视网膜光化学损伤后MDA、SOD及NO浓度变化的研究[J].眼科研究,2005,23(3):301-303.
[10] Daiber A, Frein D,Namgaladze D, et al . Oxidation and nitrosation in the nitrogen monoxide/superoxide system. J Biol Chem, 2002, 277(14): 11822-11888.
[11] 张玲.补阳还五汤治疗老年病近况[J].安徽中医学院学报.1997,16 (5):63-64.
[12] 王临江,黄佩芳.补阳还五汤临床及实验研究进展[J].上海中医药杂志, 1995,3:39-41.
[13] 佟丽,沈剑刚,丘幸生,等.补阳还五汤抗缺氧再给氧乳鼠心肌细胞凋亡的实验研究[J].第一军医大学学报2002,22(1):39-42.
10.3969/j.issn.1672-2779.2010.18.168
1672-2779(2010)-18-0230-03
广东省卫生厅中医药管理局 [No:2008090]
2010-07-13)

