α2巨球蛋白与基质金属蛋白酶-2,9在重症急性胰腺炎中作用的研究
张颖毅 潘吉勇 宋永蔚 赵 华
1 辽宁省大连市第三人民医院普通外科(116023)
2 辽宁省大连市中心医院神经内二科(116023)
重症胰腺炎约占急性胰腺炎的10%~15%,病情笃重,常合并较多严重的并发症,病死率高达20%~30%[1],仍是目前较为棘手的急腹症之一。然而,目前SAP的发病机制尚不十分清楚,对SAP的研究也是多方面、多角度的[2]。在SAP的发生发展中,由于各种炎性因子的刺激,炎症细胞的过度表达,引起基质金属蛋白酶-2,9(MMP-2,9)大量释放[3-6],进一步刺激炎症细胞的分化,并引起其抑制剂α2-巨球蛋白在血清中的动态平衡失衡[3],增加SAP的死亡率。
人α2-M是一种大分子糖蛋白,α2-M的主要功能是结合、清除体内蛋白水解酶,被认为是体内一种重要的防御蛋白[3]。Lohr等研究发现,AP病程中伴有ECM的分解,并与病情的严重性相关,因而其可作为预测结果的指标,并间接证明MMP作为主要的基质分解酶在疾病的发生发展中起重要作用[4,6]。如何阻止MMP-2,9的活性表达,减少SAP,随着MMP-2,9及其抑制剂的深入研究,将成为SAP治疗的新靶点。
本实验目的在于探讨α2-M与MMP-2,9在重症急性胰腺炎(SAP)的相关机制并证实α2-M在SAP中的价值。降低胰腺出血坏死,炎细胞渗出率,从而避免继发多脏器的损害,为临床治疗提供一个新途径。
1 材料和方法
1.1 实验对象
动物:健康普通级成年SD大鼠40只,体重180~200g(由大连医科大学实验动物中心提供),雌雄不限。
1.2 实验方法
1.2.1 动物分组和SAP大鼠动物模型的制备
将大鼠按随机表法编号分组,分为实验组20只,对照组20只。大鼠术前12h禁食,不禁水,10%戊巴比妥钠30mg/kg经腹腔注射麻醉后,碘伏消毒,正中切口入腹,由十二指肠前壁阻断胆胰管进入十二指肠处开口,经胰头部沿胰腺被膜下插入一号皮试针头,以0.1mL/min速度匀速注入5%牛磺胆酸钠(1mL/kg,Sigma公司),10~30 min后见胰腺出现坏死样改变后逐层关腹。假手术组除胰腺被膜下不注入5%牛磺胆酸钠外,余同SAP组。动物成模后于24h活杀取材,检测有关指标。
1.2.1 胰组织学检查及胰腺损伤评分
(1)标本取材:成模后24 h活杀动物,迅速分离胰腺组织,经%4甲醛固定后制备成石蜡切片(3μm),并将石蜡切片进行苏木精-伊红染色(HE),光镜观察。(2)HE染色:(3)采用Grewal等的方法对胰腺组织损伤进行定量评估。
1.2.2 胰腺湿重活杀动物后,取胰腺组织立即用分析天平称湿重。
1.2.3 血清淀粉酶量测定
于成模后24h经大鼠右心室穿刺取血,在室温静置30 min后,以2500r/min离心,按试剂盒说明测定血清淀粉酶量。
1.2.4 血清α2-巨球蛋白的测定
于成模后24h经大鼠右心室穿刺取血,在室温静置30 min后,以2500r/min离心,采取ELISA法测定血清α2-巨球蛋白。试剂盒购自美国ADL公司,具体方法参见试剂盒按试剂盒说明。
1.2.5 免疫组化法观测MMP-2,9的表达
以特异性的大鼠MMP-2,9多克隆抗体,作免疫组织化学染色,观察胰腺组织中MMP-2,9的表达状况。活杀后取胰腺组织,经甲醛固定后制备成3μm厚的石蜡切片。具体方法参见试剂盒按试剂盒说明。
MMP-2,9的表达程度及范围通过光镜下观察。每批染色均设空白对照(用PBS代替第一抗体)和正常对照(正常胰腺显色)。结果与正常对照显色情况进行对比判定。MMP-2,9阳性标准[7,8]:胰腺毛细血管内皮细胞胞浆及细胞外基质细小的棕黄染色颗粒。随机观察5个高倍视野,阴性(-):无着色细胞;弱阳性(+):1个视野可见稀疏颗粒;中等强度阳性(++):2~4个视野可见颗粒;强阳性(+++):每个视野均可见弥漫性颗粒。
1.3 数据处理
数据用χ±s表示,应用SPSS10.0统计软件进行统计分析。计量资料两组间比较根据方差齐性与否采用t或t’检验;胰腺组织MMP免疫组化的等级资料采用非参数统计的秩和检验。P<0.05为差异有显著性。
2 结 果
2.1 两组大鼠胰腺组织损伤评分、胰腺湿重的比较
实验组胰腺组织损伤评分和胰腺湿重明显高于对照组(P<0.05)。见表1。
2.2 两组大鼠血清淀粉酶和α2-巨球蛋白含量的比较
实验组血清淀粉酶及α2-巨球蛋白含量明显高于对照组(P<0.05)。见表2。
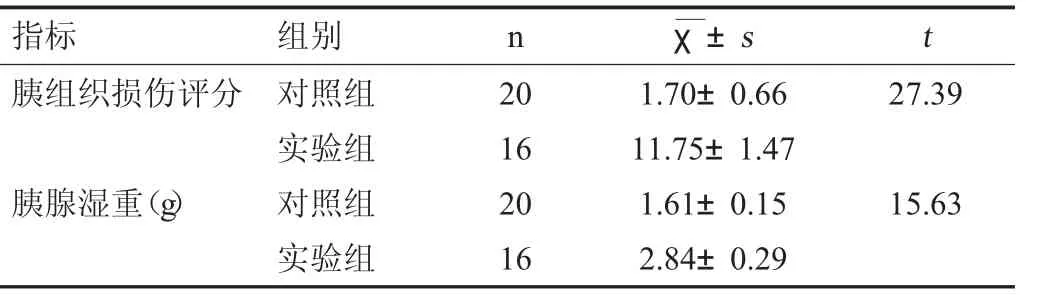
表1 两组胰腺组织损伤评分、胰腺湿重的比较
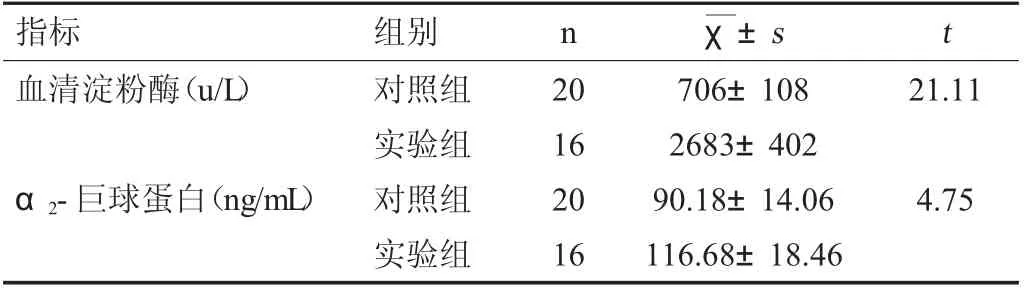
表2 两组血清淀粉酶和α2-巨球蛋白含量的比较
2.3 组织化学染色结果
正常大鼠胰腺形态规则,排列紧凑,无水肿、出血、坏死等(图1a)。SAP组肉眼可见胰腺坏死出血灶,光镜见间质肿胀,大量炎细胞浸润,红细胞渗出,腺泡细胞和脂肪坏死(图1b)。
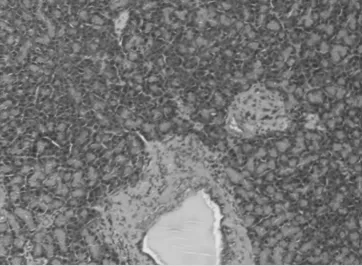
图1a 对照组胰腺(HE染色10×10)
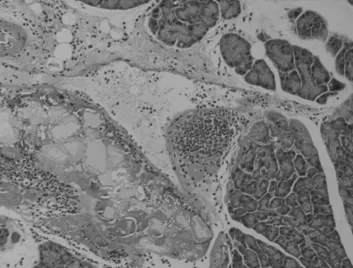
图1b SAP组胰腺 (HE染色40×10)
2.4 免疫组化染色结果
SAP组MMP-2,9呈高表达,可见胰腺毛细血管内皮细胞胞浆及细胞外基质细小的棕黄染色颗粒。SAP组MMP-2,9表达阳性率为100%,其中MMP-2强阳性有12例,MMP-9强阳性有9例。而对照组表达阳性率为10%,其中弱阳性2例。2组间比较差异有显著性 (P<0.01)。见表3,4。

表3 两组胰组织MMP-2的表达结果
3 讨 论
重症胰腺炎约占急性胰腺炎的10%~15%,病情笃重,仍是目前较为棘手的急腹症之一[1,9]。SAP是多因素共同致病的结果,但SAP的发病机制尚不完全清楚[2,9]。近年来,对于α2巨球蛋白(α2macroglobulins,α2-M)、基质金属蛋白酶(matrix metalloproteinases,MMPs)在SAP病理生理过程中的作用已成为急性胰腺炎研究非常活跃的领域,并取得显著进展[9,11]。本实验旨在通过检测SAP大鼠胰腺MMP-2,9的表达及血清中α2-M含量的变化,进一步探讨SAP发病机制,为临床及时采取措施干预SAP病情进展提供理论依据。
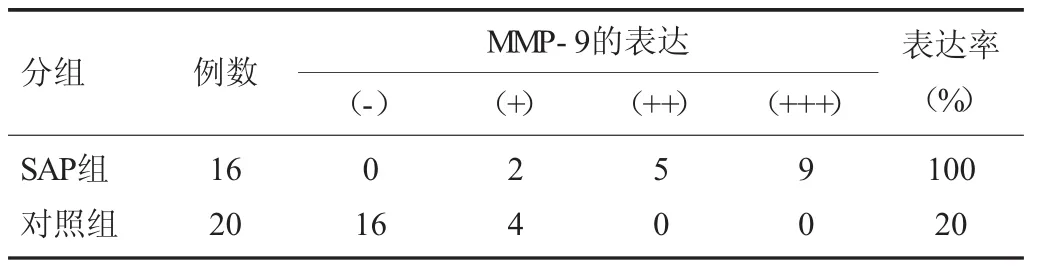
表4 两组胰组织MMP-9的表达结果
本实验结果显示,SAP组中MMP-2,9在胰腺组织内呈高表达,表现为毛细血管内皮细胞内及细胞外基质中棕黄色染色颗粒,而在对照组表达甚低(P<0.01),实验组胰腺损伤评分、胰湿重较对照组明显升高,实验组大鼠血清淀粉酶量及反映病情严重程度的指标与MMP-2,9的表达相一致,提示MMP-2,9与SAP病情的发生发展密切相关。
有研究表明,在正常情况下MMP-2,9表达甚微,而在异常情况下,炎症细胞被激活后,炎性因子大量释放,促进了MMP-2,9的异常高表达,从而参与病理过程加剧病情的发展[7,11]。我们通过免疫组化染色法观察SAP大鼠胰腺MMP-2,9的表达情况发现,MMP-2,9在对照组无表达或仅有个别弱阳性表达,而实验组大鼠则呈强阳性表达;通过组化HE染色还观察到大量白细胞迁移,浸润至周围组织,同时伴有毛细血管扩张、淤血,周围组织充血、坏死,脓肿形成。由此,我们发现在MMP-2,9呈阳性表达的同时中性粒细胞大量浸润至细胞间质内,而中性粒细胞本身可以释放多种炎性因子,进而推测病变组织中中性粒细胞的大量浸润与MMP-2,9的高表达密切相关。在Keck等的实验中发现在重症急性胰腺炎大鼠的肺匀浆和含中性粒细胞的上清液中,MMP-9高表达[8]。用中性粒细胞损耗试验消耗外周血中的白细胞后,肺组织中性粒细胞浸润减轻的同时,MMP-9表达亦随之降低,这表明高表达的MMP-9来源于中性粒细胞。免疫荧光研究也证实了浸润肺组织的中性粒细胞表达MMP-9[12],结合我们的实验观测进一步证明了这一推断。
在Muhs及Descamps等的实验中发现,SAP时肺通透性增加了2倍,肺匀浆MMP-2活性在ANP中3倍于正常对照组,腹水中MMP-2、9的活性增加[6]。Yamaguchi等在油酸诱导的急性胰腺炎大鼠中发现,MMP-2活性较诱导前显著增强,MMP-2mRNA表达升高12.3倍[10]。Yamaguchi等在蛙皮素和牛黄胆酸钠诱导的胰腺炎大鼠模型中也发现,Ⅳ型胶原沿基底膜亦呈连续性分布(不同于精氨酸诱导的胰腺炎模型)。而MMP-2在导管上皮的染色强度又与导管周围基底层的Ⅳ型胶原呈负相关[13,14]。可见MMP-2在急性胰腺炎中的激活和持续高表达,导致胰腺基底膜和间质中的Ⅳ型胶原降解,引起胰腺腺泡和导管上皮结构的破坏。
综合我们的实验结果及既往研究,我们认为SAP的病理演变过程可能为前炎症因子(TNF-α、IL-1β等)发挥着始动作用,刺激中性粒细胞和巨噬细胞表达增加,从而通过细胞黏附因子(ICAM-1、VCAM-1等)粘附于内皮细胞层并通过内皮细胞到达基底基质膜,激活体内信号转导,各种激酶活化之后使底物磷酸化,增强核因子的DNA结合活性,从而诱导MMP-2,9表达,最终通过MMP-2,9作用胰腺毛细血管,破坏基膜,令胰腺毛细血管通透性增加,使中性粒细胞和巨噬细胞穿透屏障迁移于ECM及腺泡内,继续释放MMP-2,9,加重结构破坏,使AP进展至SAP[11,18]。据此提示我们MMP-2及MMP-9可作为SAP病情判定的良好指标[19]。而Yokota等在蛙皮素诱导的急性胰腺炎中,MMP-1和MMP-2均明显升高;而MMP-9变化不大[7],这与本次实验结果不同,我们考虑可能由于不同的诱导剂所引起的胰腺炎模型,其炎症组织的病理变化不同所致。
作为体内最广谱的蛋白水解酶抑制剂[20],α2-M在大多数正常情况下其体内浓度不发生变化。我们的实验结果显示α2-M在实验组大鼠血清含量中升高显著,这与Bisaro等的研究结果相一致[2]。研究证实,基质金属蛋白酶家族是细胞外基质降解过程中的重要酶类,而α2-M对基质金属蛋白酶有抑制作用,它是重要的MMP清除剂,可以非特异性抑制和清除血浆中的MMP[19]。α2-M可用其特殊的“陷阱”机制,把蛋白酶紧紧包裹其中,阻断其与底物发生反应。α2-M的这种生理功能是否可以阻止MMP发挥作用仍需进一步研究[19]。Bisaro等发现在AP的血清中α2-M和MMP-2,9活性均有所增加,但MMP-2,9的增加总是高于α2-M[20],结合我们的实验结果推测可将测定血清中α2-M的活性作为评估SAP病情的一项指标。
综合本次实验及既往文献报道,均提示 MMP-2、MMP-9与α2-M的含量平衡失调是SAP发生发展的重要发病机制之一,我们对MMP-2,9及α2-M关系的深入研究,有望进一步阐明急性胰腺炎的发病机制。我们认为在诊治SAP患者过程中测定MMP-2,9的同时测定α2-M含量将更有利于提高SAP的预测与诊断,有助于临床及早采取治疗措施干预并阻断SAP的病理发展进程、减轻SAP对机体的损害、降低SAP患者的死亡率。
[1]Domínguez-Munoz JE.Advances in acute pancreatitis[J].Gastroenterol Hepatol,2008,4:70-75.
[2]Papachristou GI.Prediction of severe acute pancreatitis:current knowledge and novel insights[J].World J Gastroenterol,2008,14(41):6273-6275.
[3]Bísaro de Lorenc L,Ramos AM,Sánchez MC.Structural evaluation of plasma alpha2-macroglobulin in acutepancreatitis[J].Clin Chem Lab Med,2005,43(11):1183-1189.
[4]Löhr M,Hummel F,Martus P,Serum levels of extracellular matrix in acute pancreatitis[J].Hepatogastroenterology,1999,46(30):3263-3270.
[5]Aynaci M,Tuncyurek P,Nart D.Does matrix metalloproteinase activity predict severity of acute pancreatitis?[J].ANZ J Surg,2006,76(9):801-804.
[6]Muhs BE,Patel S,Yee H,Increased matrix metalloproteinase expression and activation following experimental acute pancreatitis[J].J Surg Res,2001,101(1):21-28.
[7]Yokota T,Denham W,Murayama K.Pancreatic stellate cell activation and MMP production in experimental pancreatic fibrosis[J].J Surg Res,2002,104(2):106-111.
[8]Keck T,Balcom JH 4th,Fernández-del Castillo C.Matrix metalloproteinase-9 promotes neutrophil migration and alveolar capillary leakage in pancreatitis-associated lung injury in the rat[J].Gastroenterology,2002,122(1):188-201.
[9]Werning C.Pancreatitis[J].Med Monatsschr Pharm,1984,7(3):68-69.
[10]Yamaguchi T,Kihara Y,Taguchi M,Persistent destruction of the basement membrane of the pancreatic duct contributes to progressive acinar atrophy in rats with experimentally induced pancreatitis[J].Pancreas,2005,31(4):365-372.
[11]Chen P,Yuan Y,Wang S,Zhan L,Serum matrix metalloproteinase 9 as a marker for the assessment of severe acute pancreatitis[J].Tohoku J Exp Med,2006,208(3):261-266.
[12]Keck T,Jargon D,Klünsch A,MMP-9 in serum correlates with the development of pulmonary complications in experimental acute pancreatitis[J].Pancreatology,2006,6(4):316-322.
[13]Yamaguchi T,Nakamura H,Kihara Y.Long-term overexpression of membrane type-1 matrix metalloproteinase and matrix metalloproteinase-2 in oleic acid-induced pancreatitis in rats[J].Pancreas,2002,24(4):348-356.
[14]Ng EK,Barent BL,Smith GS,Joehl RJ.Decreased type IV collagenase activity in experimental pancreatic fibrosis[J].J Surg Res,2001,96(1):6-9.
[15]Kruse P,Lasson A,Hage E.Proteases and protease inhibitors in cerulein-induced acute pancreatitis in rats[J].J Surg Res,1999,85(2):294-300.
[16]Georgiadis D,Yiotakis A.Specific targeting of metzincin family members with small-molecule inhibitors:progress toward a multifarious challenge[J].Bioorg Med Chem,2008,16(19):8781-8794.
[17]Lipka D,Boratyński J.Metalloproteinases[J].Structure and function Postepy Hig Med Dosw,2008,62:328-36.
[18]Ghajar CM,George SC,Putnam AJ.Matrix metalloproteinase control of capillary morphogenesis[J].Crit Rev Eukaryot Gene Exp,2008,18(3):251-278.
[19]Tu G,Xu W,Huang H,Li S.Progress in the development of matrix metalloproteinase inhibitors[J].Curr Med Chem,2008,15(14):1388-1395.
[20]Meng N,Li Y,Zhang H.RECK,a novel matrix metalloproteinase regulator[J].Histol Histopathol,2008,23(8):1003-1010.

