年龄或性别对循环内皮祖细胞数量的影响
黄河,李建芳,古秀雯,汤耀卿
(1.山西医科大学第一医院普外科,山西太原030001;2.上海消化外科研究所,上海200025;3.上海交通大学附属瑞金医院外科ICU,上海200025)
年龄或性别对循环内皮祖细胞数量的影响
黄河1,李建芳2,古秀雯3,汤耀卿3
(1.山西医科大学第一医院普外科,山西太原030001;2.上海消化外科研究所,上海200025;3.上海交通大学附属瑞金医院外科ICU,上海200025)
目的:研究年龄或性别对循环内皮祖细胞(cEPCs)数量的影响。方法:220例符合标准的健康成年志愿者均来自上海交通大学附属瑞金医院体检中心。所有志愿者根据年龄分为四组:<30岁组(n=54);30~49岁组(n=62);50~69岁组(n=59);>69岁组(n=45)。每个年龄组志愿者按性别再分组。以CD34+、CD133+、VEGFR-2+为表型标志,采用流式细胞学方法检测并对比志愿者cEPCs数量。结果:220例志愿者cEPCs数量不符合正态分布,因而取相应的自然对数值,使其符合正态分布。相同性别志愿者或全部志愿者的cEPCs数量自然对数值在不同年龄组组间无显著性差异(男性:F=1.234,P=0.301;女性:F=0.274,P=0.844;全部:F=1.078,P=0.359)。同时,在各年龄组或全部志愿者,男性和女性的cEPCs数量自然对数值之间无显著性差异(<30岁组:t=0.699,P=0.488:30~49岁组:t=0.772,P= 0.443;50~69岁组:t=-0.516,P=0.608;>69岁组:t=-0.480,P=0.634;全部:t=0.216,P=0.829)。结论:年龄或性别对cEPCs数量没有影响。
循环内皮祖细胞;年龄;性别
1997年,在成年人外周血中发现EPCs[1]以来,越来越多的研究显示,EPCs在机体出生后血管ECs损伤修复和新生血管形成中起重要作用[2-3]。近来的研究提示,循环中骨髓来源的EPCs可以修复内皮的损伤[2,4]。Hill等[5]总结了已有的研究后认为,cEPCs数量的变化可以反映血管内皮损伤的程度,对心血管疾病的预后具有重要预测意义,其预测价值甚至优于Framingham危险因素评分;但是,目前对EPCs如何发挥上述作用的机制还不清楚,甚至关于年龄或性别对cEPCs数量是否存在影响还存在争论。
研究显示,引起心血管疾病的危险因素,如高血压和吸烟可以使cEPCs的数量减少以及功能活性降低[6-7]。高龄也是心血管疾病的显著危险因素,但是关于年龄对cEPCs数量的影响还未达成一致的认识。有研究报道,随着年龄的增高,cEPCs的数量减少[6,8-9];也有研究显示,年龄和cEPCs的数量没有相关性[10-11]。同样由于缺少系统研究,另一个危险因素性别对cEPCs数量的影响也没有明确。
为了更好地了解EPCs在不同生理或病理条件下的作用,笔者通过对健康成年人群外周血EPCs数量的观察,来明确上述基本问题。
1 材料与方法
1.1 研究对象
均来自于上海交通大学附属瑞金医院体检中心的健康成年体检者。本次体检各项指标均正常,并除外有以下情况者:心血管疾病、高脂血症、糖尿病、急/慢性呼吸系统疾病、急/慢性炎症、自身免疫性疾病、肾功能不全、血液系统疾病、恶性肿瘤、器官移植受者、月经期女性,使用他汀类、血管紧张素转换酶抑制剂、激活蛋白C、雌激素或皮质醇类药物者,以及一年内有吸烟、手术或创伤及其后遗症者。
符合标准的志愿者(n=220,男女比例为110∶110)分为四个年龄组:<30岁组,n=54,男女比例为25∶29;30~49岁组,n= 62,男女比例为29∶33;50~69岁组,n=59,男女比例为31∶28;>69岁组,n=45,男女比例为25∶20。同时每个年龄组按性别再分组。
1.2 血样采集
入选体检志愿者,由肘静脉采集3 ml外周静脉血(普通肝素钠60 U/ml抗凝)用于EPCs检测。
1.3 流式细胞学检测
检测步骤与Neysan Rafat的叙述类似[12]。所有血样均在采集后4 h内处理。通过梯度离心法收集PBMCs;加入FcRblocking试剂孵化10 min,封闭非特异性结合;加入PECD133,PerCP-cy5.5-CD34和APC-VEGFR-2三种抗体,于4°C避光孵育30 min;相应同型对照抗体作为阴性对照;将细胞洗涤3次,去除未结合抗体,重新悬浮细胞于200 μl 1%多聚甲醛溶液中。FACSCalibur流式细胞仪(BD Biosciences)检测。每份样本收集950 000个细胞。CD34+、CD133+、VEGFR-2+细胞为EPCs13,以个/106PBMCs为单位,表示cEPCs数量。
1.4 统计学方法
柯尔莫哥诺夫-斯米尔诺夫方法(Kolmogorov-Smirnov Test)检验数据是否正态分布。如果数据不符合正态分布,则将数据转换为正态分布数据(通过取其自然对数的方法),再进行统计分析。方差分析或t检验统计分析组间差异。以P<0.05为有显著性差异。采用SAS 8.2软件包进行统计学分析。
2 结果
2.1 数据分布的正态性检验和数据的转换
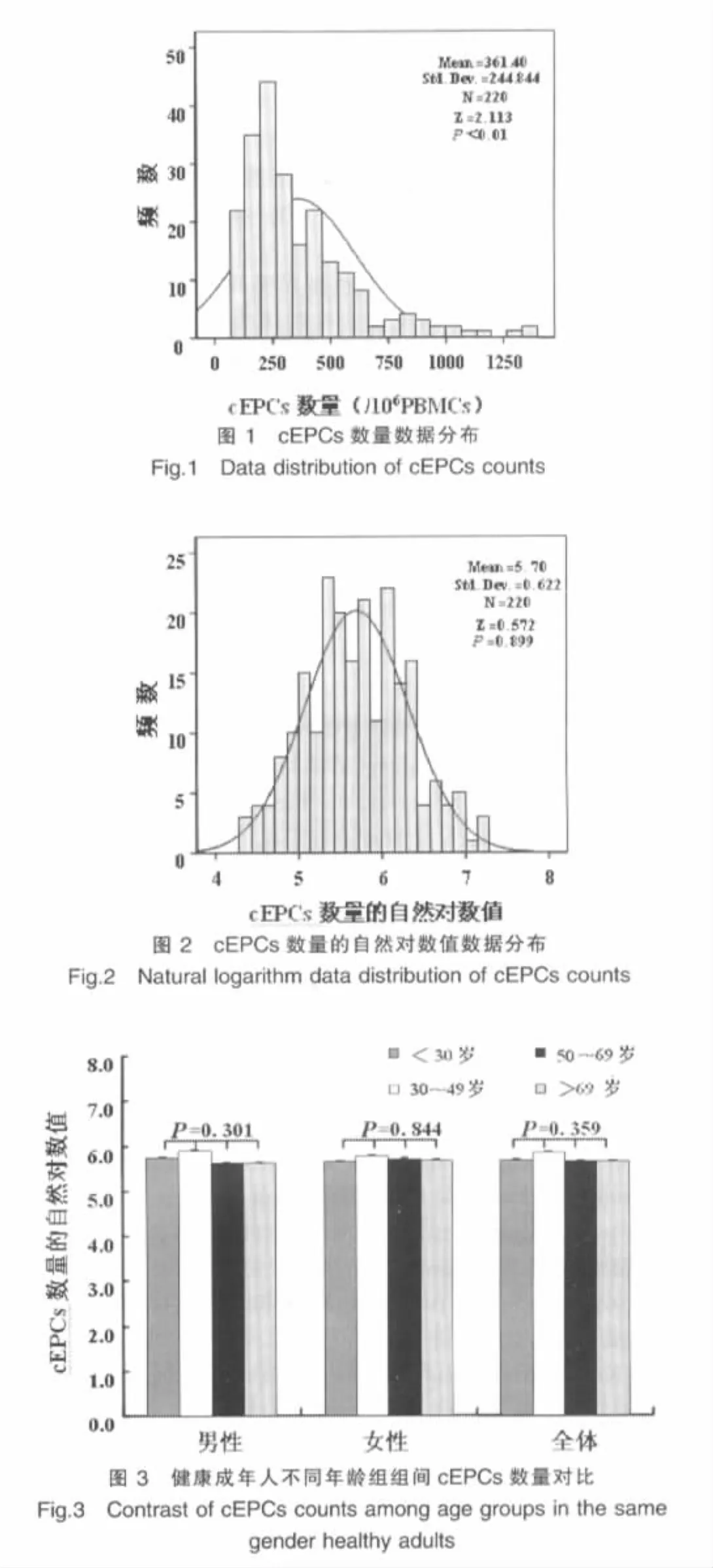
柯尔莫哥诺夫-斯米尔诺夫检验显示入选志愿者cEPCs数量数据不符合正态分布(Z=2.113,P<0.01),见图1。将数据分别取相应的自然对数值,检验转换后数据符合正态分布(Z=0.572,P=0.899),见图2。
2.2 年龄对cEPCs数量的影响
相同性别志愿者或全部志愿者的cEPCs数量自然对数值在不同年龄组组间无显著性差异(男性:F=1.234,P=0.301;女性:F=0.274,P=0.844;全部:F=1.078,P=0.359),见图3。
2.3 性别对cEPCs数量的影响
在各年龄组或全部志愿者,男性和女性的cEPCs数量自然对数值间无显著性差异(<30岁组:t=0.699,P=0.488;30~49岁组,t=0.772,P=0.443;50~69岁组:t=-0.516,P=0.608;>69岁组:t=-0.480,P=0.634;全部:t=0.216,P=0.829),见图4。
3 讨论
在笔者的研究中,排除已知对cEPCs数量有影响的因素后,年龄成为唯一的影响因素。通过对大样本(220例)健康成年人的观察,笔者发现,cEPCs数量并没有随着年龄增长而发生变化;而早期的一些研究[6,8-9]认为,高龄是使cEPCs数量减少的因素之一,但是随后的一些研究结果却与之相矛盾。Rebecca的研究发现,健康年轻人[(33±8)岁,n=9]与健康老年人[(66±8)岁,n=13]cEPCs数量无显著性差异。Yamada等[10]在肺炎患者研究中也显示年龄和cEPCs的数量无显著相关性(r=20.255,P=0.101 6)。这些研究的样本例数都有限,因而结论出现矛盾却说服力不足。

对于上述矛盾的结果,有学者提出假设,年龄增长可能影响的是cEPCs功能,而不是cEPCs数量[13]。然而,Morrison等[14]研究显示衰老的骨髓细胞仍然具有在衰竭骨髓居住和分化传代的能力,这就表明老化骨髓来源祖细胞仍然保持着全部功能。为了验证这个观点,Chang等[15]进行了深入研究,结果显示年轻人(n=18,18~35岁)和老年人(n=21,68~95岁)的cEPCs数量及功能(分化、迁移和增殖)无显著性差异。但是,众所周知,高龄是血管内皮损伤的确切危险因素,那么,随着年龄增加内皮修复功能是如何减弱的呢?近来,一些学者发现年龄相关性内皮修复功能减弱是由于损伤组织无法释放引起EPCs动员的信号分子,如基质细胞衍生因子-1α(stroma-cell derived factor-1α,SDF-1α)[15-16]或VEGF[8,17],而不是直接影响EPCs的数量或功能。此外,Hattiangady等[18]证实,高龄不会使神经干/祖细胞(neural stem/progenitor cell,NSC)的数量减少,但可以改变NSC所处的环境,使处于静止期的NSC数量增加,进而抑制神经发生。这一结果提示,年龄增长可能也会使更多的EPCs停留于静止期而无法参与血管内皮修复和新生血管形成。这些研究提示,老年人血管内皮修复功能减弱是因为有功能的cEPCs数量减少,而不是cEPCs的总数量减少。该结论间接支持了本实验的观察结果。
至于性别对cEPCs数量的影响,目前还没有专门的研究。本研究发现,不论是不同年龄组还是所有志愿者中,男性与女性之间的cEPCs数量没有差异,结果表明性别也不影响cEPCs的数量。Hoetzer等[19]发现中年女性[(58±1)岁,n=25]的EPCs功能(克隆形成能力:16±3 vs 7±1;迁移能力:729±74 vs 530±67)高于中年男性[(59±1)岁,n=25]。这些结果提示,性别影响EPCs的功能,而不影响EPCs的数量。
目前,EPCs作为干细胞研究的热点,已经从心血管疾病扩展到组织工程、炎症性血管内皮损伤和修复等广泛的研究与应用领域。本研究组通过年龄和性别对cEPCs数量的影响入手,阐明了EPCs的众多研究所涉及但未系统观察和分析的一个基本问题,也为笔者在炎症领域开展关于EPCs研究奠定了基础。
综上所述,年龄或性别对健康成年人的cEPCs数量无影响。笔者的研究为进一步理解EPCs在生理或病理条件下的作用奠定了重要基础。
[1]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
[2]Shi Q,Rafii S,Wu MH,et al.Evidence for circulating bone marrowderived endothelial cells[J].Blood,1998,92(2):362-367.
[3]Schatteman GC,Dunnwald M,Jiao C.Biology of bone marrow-derived endothelial cell precursors[J].Am J Physiol Heart Circ Physiol, 2007,292(1):H1-18.
[4]Wang HY,Gao PJ,Ji KD,et al.Circulating endothelial progenitor cells, C-reactive protein and severity of coronary stenosis in Chinese patients with coronary artery disease[J].Hypertens Res,2007,30(2):133-141.
[5]Hill JM,Zalos G,Halcox JP,et al.Circulating endothelial progenitor cells,vascular function,and cardiovascular risk[J].N Engl J Med, 2003,348(7):593-600.
[6]Vasa M,Fichtlscherer S,Aicher A,et al.Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease[J].Circ Res,2001,89(1):E1-7.
[7]Kondo T,Hayashi M,Takeshita K,et al.Smoking cessation rapidly increases circulating progenitor cells in peripheral blood in chronic smokers[J].Arterioscler Thromb Vasc Biol,2004,24(8):1442-1447.
[8]Scheubel RJ,Zorn H,Silber RE,et al.Age-dependent depression in circulating endothelial progenitor cells in patients undergoing coronary artery bypass grafting[J].J Am Coll Cardiol,2003,42(12):2073-2080.
[9]Eizawa T,Ikeda U,Murakami Y,et al.Increase in circulating endothelial progenitor cells after aortic aneurysm repair[J].Heart Vessels,2004,19(3):107-110.
[10]Yamada M,Kubo H,Ishizawa K,et al.Increased circulating endothelial progenitor cells in patients with bacterial pneumonia:evidence that bone marrow derived cells contribute to lung repair[J].Thorax,2005,60 (5):410-413.
[11]Shaffer RG,Greene S,Arshi A,et al.Flow cytometric measurement of circulating endothelial cells:the effect of age and peripheral arterial disease on baseline levels of mature and progenitor populations[J]. Cytometry B Clin Cytom,2006,70(2):56-62.
[12]Rafat N,Hanusch C,Brinkkoetter PT,et al.Increased circulating endothelial progenitor cells in septic patients:correlation with survival[J]. Crit Care Med,2007,35(7):1677-1684.
[13]Schmidt-Lucke C,Rossig L,Fichtlscherer S,et al.Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events:proof of concept for the clinical importance of endogenous vascular repair[J].Circulation,2005,111(22):2981-2987.
[14]Morrison SJ,Wandycz AM,Akashi K,et al.The aging of hematopoietic stem cells[J].Nat Med,1996,2(9):1011-1016.
[15]Chang EI,Loh SA,Ceradini DJ,et al.Age decreases endothelial progenitor cell recruitment through decreases in hypoxia-inducible factor 1 alpha stabilization during ischemia[J].Circulation,2007,116(24):2818-2829.
[16]Hiasa K,Ishibashi M,Ohtani K,et al.Gene transfer of stromal cellderived factor-1 alpha enhances ischemic vasculogenesis and angiogenesis via vascular endothelial growth factor/endothelial nitric oxide synthase-related pathway:next-generation chemokine therapy for therapeutic neovascularization[J].Circulation,2004,109(20):2454-2461.
[17]Rivard A,Berthou-Soulie L,Principe N,et al.Age-dependent defect in vascular endothelial growth factor expression is associated with reduced hypoxia-inducible factor 1 activity[J].J Biol Chem,2000,275 (38):29643-29647.
[18]Hattiangady B,Shetty AK.Aging does not alter the number or phenotype of putative stem/progenitor cells in the neurogenic region of the hippocampus[J].Neurobiol Aging,2008,29(1):129-147.
[19]Hoetzer GL,MacEneaney OJ,Irmiger HM,et al.Gender differences in circulating endothelial progenitor cell colony-forming capacity and migratory activity in middle-aged adults[J].Am J Cardiol,2007,99(1): 46-48.
Effect of age or gender on circulating endothelial progenitor cells number
HUANG He1,LI Jianfang2,GU Xiuwen3,TANG Yaoqing3
(1.Department of Surgery,the First Hospital of Shanxi Medical University,Taiyuan030001,China;2.Institute of Digest Surgical Research of Shanghai City,Shanghai200025,China;3.Department of Surgery Intensive Care Unit,Ruijin Hospital Affiliated of Shanghai Jiaotong University,Shanghai200025,China)
Objective:To study the effect of age or gender on circulating endothelial progenitor cells(cEPCs)number.Methods: 220 standards-compliant healthy adult Chinese people were selected from the Health Examination Center of Ruijin Hospital Affiliated of Shanghai Jiaotong University.All subjects were divided into four different groups based on age(<30 years group of 54 cases;30-49 years group of 62 cases;50-69 years group of 59 cases;and>69 years group of 45 cases.Meanwhile,subjects were subdivided by gender in each age group.The numbers of cEPCs(identified by flow cytometry as CD133+,CD34+and VEGFR-2+cells)were detected and contrasted among different groups.Results:Data of cEPCs counts of 220 subjects were not in normal distribution,so data transformation was undertaken with calculating the corresponding natural logarithm.The natural logarithms of cEPC counts showed no notable difference among age group in male subjects(F=1.234,P=0.301),female subjects(F=0.274,P=0.844)and all subjects(F=1.078,P=0.359).Meanwhile,there was no significant difference of cEPCs counts′natural logarithms between two genders in each age group and in all sub jects(<30 years group:t=0.699,P=0.488;30-49 years group:t=0.772,P=0.443;50-69 years group:t=-0.516,P=0.608;>69 years group:t=-0.480,P=0.634;all subjects:t=0.216,P=0.829).Conclusion:Age or gender are not associated with the level of cEPCs.
Circulating endothelial progenitor cells;Age;Gender
R363
A
1673-7210(2010)12(c)-013-03
2010-11-22)
黄河(1975.4-),男,山西神池人,博士研究生学历,主治医师;研究方向:外科危重症。

