Gli1小分子干扰RNA对人胰腺癌细胞增殖和凋亡的影响Δ
泸州医学院附属医院消化内科(泸州646000)
王 火亘 王忠琼 杜光红 夏国栋 邓明明*
HH(Hedgehog)信号通路主要包括四个部分:HH信号肽、膜蛋白受体(Ptc)、核转录因子(Gli)、下游目的基因。越来越多的实验显示,其异常激活能导致多种肿瘤生成,如皮肤基底癌、髓母细胞瘤、胰腺癌等[1~3]。本研究依据 RNA干扰(RNA interference,RNAi)原理,设计并合成 Gli1基因特异性小干扰 RNA(smallinterfering RNA,siRNA)转染至胰腺癌PC-2细胞株,以探讨 Gli1基因靶向性 siRNA对胰腺癌细胞增殖和凋亡的影响。
材料和方法
1 材 料 人胰腺癌细胞株PC-2购自中国科学院上海细胞生物研究所;3S Trizol总 RNA抽提试剂盒购自晶美公司;RT-PCR试剂盒购于北京天为时代公司;转染试剂 LipofectamineTM2 000购自 Invitrogen公司;Gli1抗体购自上海超研生物科技有限公司;Gli1引物及内参 GADPH引物由上海生物工程有限公司合成,Gli1 siRNA转录模板由上海吉玛公司合成。
2 方 法
2.1 Gli1 siRNA序列的设计和制备:根据NCBI数据库中Gli1基因(GeneBank编号NM005269)cDNA碱基序列,利用 Ambion公司提供的“siRNA Target Finder and Design Tools”设计针对 Gli1的siRNA 2对,经Blast Search检索确认与Gli1以外的人类已知基因序列无同源性。序列如下:1#:sense: 5'-CTCCACAGG CATACAGGAT-3',antisense: 5'-ATCCTGTATGCCTGTGTGGAG-3';2#:sense:5'-AGC TCCAGTGAACACATAT-3',antisense: 5'-ATATGTGTTCACTGGAGCT-3'。荧光素特异性si RNA、单链oligonucleotides由上海吉玛公司合成,经聚丙烯酰胺凝胶电泳(PAGE)纯化。退火处理:两条oligonucleotides各稀释至1g/L,各取 2μl,加入退火缓冲液 46μl,90℃,5min,缓慢降至室温,反应 3h。
2.2 细胞培养:将人胰腺癌细胞株 PC-2细胞接种于含有 10%灭活胎牛血清、1%谷氨酰胺和1%抗生素混合液的Mc Coy's 5A(购于Gi Bco公司)培养液中,置于37℃、5%CO2培养箱中常规培养。
2.3 siRNA转染:在 6孔板上每孔加入4×105个PC-2细胞,在无抗生素含血清培养液中孵育过夜,在转染时细胞达到30%~50%的融合度,使用PBS洗涤2次后,2对Gli1 si RNA以每孔10μl与250μl无血清培养液配制成混和液,以及7.5μl LipofectamineTM2000与250μl无血清培养液配制成混和液,两种混和液分别于室温下孵育 5min后混合,再于室温下孵育 20min后加入无血清和抗生素的细胞培养液中,6h后更换为全培养液,于孵育72h后收集细胞进行检测。具体操作参照转染试剂盒说明。荧光素特异性 si RNA为阴性对照组,PBS液代替si RNA为空白组。
2.4 RT-PCR测定 Gli1 mRNA:转染72h后分别收集 6孔板中各组细胞,使用常规 RT-PCR法扩增各组细胞中Gli1mRNA,Gli1上游引物:5′-GGGATGATCCCACATCC TCAGTC-3′下游引物:5’-CTGGAGCAGCCCCCCCAGT-3’,扩增片段长度368bp。内参 GAPDH的引物序列:上游引物:5′-CGAAGTCAACGGATTTGGTCGTAT-3′下游引物:5′-AGCCTTCTCGGTGGTGAAGAC-3′,扩增片段长度 209bp。PCR反应循环条件为:94℃ 预变性 2min,94℃ 30s,51℃ 30s,72℃ 30s,30个循环后72℃延伸7min。③ PCR产物检测:反应结束后取10μl反应物,20g/L琼脂糖凝胶电泳,凝胶中加 0.5mg/L溴乙锭,缓冲液为0.5χTBE,5V/vm,45min,在反射紫外灯下观察电泳带,用数码相机摄影并进行光密度扫描分析,结果以产物与内参对照的比值表示。
2.5 Western Blot检测 Gli1蛋白表达:收集空白对照、阴性对照组和转染Gli1 siRNA 72h的PC-2细胞1×105,用 PBS洗 2遍,溶解于裂解缓冲液(1mol/L Tris,p H 8.0的HCl2.5ml,NaCl0.438g,Triton-X-100 0.5ml,加蒸馏水至50ml。使用时,0.87ml裂解液加入1.74/L PMSF50μl)提取总蛋白,每组分别取 20μg用以检测内参 GADPH蛋白质,取 60μg用以检测 Gli1蛋白质,上样经10%SDS-PAGE分离胶和5%SDS-PAGE浓缩胶,分别于90V恒压电泳约 2h,60V恒压电泳约90min,再于110V恒压电泳1.5h后电转移至硝酸纤维素(NC)膜上,随后以 5%脱脂奶(5g脱脂奶粉溶于100ml 1×TBST溶液中)封闭过夜。用兔抗人 Gli1蛋白多克隆抗体(1∶1000)加在装有NC膜的袋中室温下摇动 2h杂交,洗膜后加入辣根过氧化物酶偶联的羊抗兔 Ig G(1∶2000)抗体,室温下摇动1h。ECL显色,暗室曝光X线片,胶片进行拍照,记录结果。同时以β-actin作为内参。
2.6 MTT检测:取对数生长期的PC-2细胞以 1×104/孔接种于96孔板中常规培养24h后加上述处理因素,每组设 3个复孔,并设空白对照组、阴性对照组,继续培养 1~7d,每孔分别加入5g/L的MTT10μl,37℃下孵育4h后,每孔均加入10%SDS-Cl 100μl,轻微振荡使紫兰色沉淀溶解,用酶标仪测定 490nm波长下的吸光度(A490值)。
2.7 TUNEL+PI双染流式细胞检测细胞凋亡:于转染72h后,收集 1×106个细胞,于3.7%的福尔马林中固定,然后加 Cytonin孵育,细胞打孔,接着加入Labeling Buffer混合物以及FITC荧光物质,最后加入PI复染进行流式细胞仪检测。
结 果
1 Gli1si RNA序列的选择:Gli1siRNA转染 72h后,空白对照、阴性对照和1#、2#Gli1 si RNA转染组Gli1 mRNA水平分别为:0.723±0.028、0.718±0.025、0.705±0.023、0.235±0.018。1#Gli1 siRNA转染组显著低于2#Gli1siRNA转染组和空白对照及阴性对照组(均 P<0.01)(图1),且 1#Gli1siRNA抑制Gli1mRNA作用更强,故以其序列作为Gli1RNAi设计转录模板。
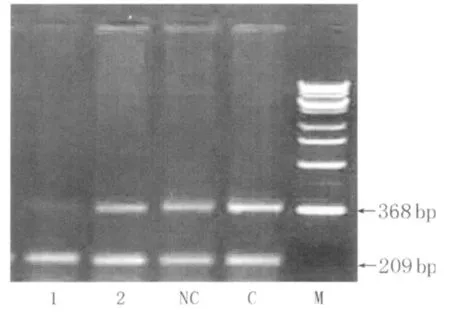
图1 Gli1 siRNA对 Gli1 m RNA表达的影响
2 Gli1siRNA对于PC-2细胞 Gli1蛋白表达的抑制作用:使用 1#Gli1siRNA转染 PC-2细胞 72h后,提取蛋白运用 Western Blot法检测 Gli1蛋白表达,结果发现Gli1蛋白表达显著低于空白对照和阴性对照组(图2),结果与RT-PCR一致。
3 干扰 Gli1表达后对 PC-2增殖的影响:MTT法检测各组细胞的A值,见附表。阴性对照 siRNA的胰腺癌细胞组与空白对照组相比,转染后 24、48、72h和1周时细胞的增殖均未受影响(均P>0.05)。转染1#Gli1 siRNA的胰腺癌细胞与空白对照组相比,在 24h时细胞增殖未受到明显影响,在转染 48h后细胞增殖开始受到抑制,72h和1周时细胞增殖被明显抑制(P<0.05)。
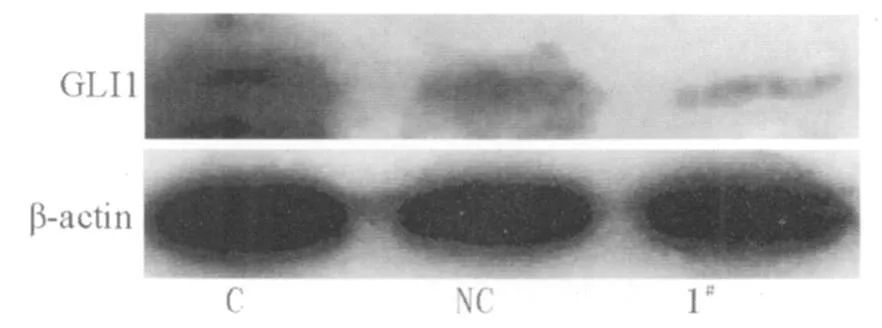
图2 Gli1 siRNA对 Gli1蛋白表达的影响
附表 MTT法检测转染后各组细胞 A值(±s)

附表 MTT法检测转染后各组细胞 A值(±s)
注:与空白对照组和阴性对照组比较,*P<0.05
72h 0.512±0.026 0.487±0.016 0.323±0.006*1周 0.667±0.012 0.623±0.008 0.233±0.019*
4 TUNEL+PI双染流式细胞检测细胞凋亡(图3):空白和阴性对照组的细胞均呈现 PI染色阳性,在488 nm波长的激发光下呈现明显的黄色荧光,没有见到明显的FITC黄绿荧光。而 Gli1 si RNA转染组细胞除了PI染色阳性的黄色荧光外,还表现出黄绿荧光,为FITC染色阳性,为凋亡细胞染色,表明转染 Gli1 siRNA后的胰腺癌 PC-2细胞发生特异性凋亡。

图3 TUNEL+PI双染流式细胞检测各组细胞凋亡
讨 论
许多研究显示,HH-Gli信号通路能直接调控肿瘤细胞增殖分化转移的分子基因转录水平,该通路的作用模式为HH信号肽与膜受体Ptc蛋白分子结合后,解除了Ptc分子对 Smo的抑制作用。Smo蛋白分子的激活可使 HH信号通路中核转录因子 Gli功能状态发生改变,从而激活 HH信号通路下游目的基因转录。近来,对 HH信号传导通路与人胰腺癌之间的关系作了深入研究,我们的前期研究[4]及国外研究[5]均显示 HH信号传导通路中Shh、Smo、PTCH及Gli等的表达明显高于临近的正常组织,表明 HH信号途径的激活和表达对人胰腺癌的发生和恶性生物学特性的维持极为重要。
Gli是一种锌指核转录因子,在脊椎动物中包括 3种核转录因子,即 Gli1、Gli2、Gli3,3种分子均含有相似的DNA结构域-5个锌指结构,能与HH信号通路下游基因特定序列(GAC CAC CCA)结合而发挥作用,但 3种转录因子所起的作用是不一样的,研究显示[6],Gli1、Gli2主要起激活 HH下游基因转录功能,而 Gli3则起抑制作用,这可能是由于其 C、N末端存在不同的蛋白激活或抑制区域。Gli1只存在激活功能,与HH信号通路中下游基因的特定序列结合,直接调控 HH信号通路目的基因的转录表达,在 HH信号通路调控中发挥关键作用,其分子功能的改变直接导致 HH信号通路下游目的基因转录水平的改变,如调控肿瘤细胞增殖分化转移的多种分子基因转录水平,如 CyclinD2、Bcl2、V EGF、Angiopoietin等基因[3,7]。体外细胞及小鼠肿瘤接种实验证实[8],利用 HH通路抑制剂如环杷明可抑制肿瘤细胞增殖,抑制瘤体增长,给人类治疗肿瘤提供了新的策略。但此类抑制剂只能对由 HH信号通路上游基因变化导致异常活化的肿瘤有作用。在Smo级联反应以下的一些参与HH信号通路调控的分子变化,如 SUFU基因突变将没有治疗意义[9]。而且,同种肿瘤与多种途径导致 HH信号通路的异常活化有关,因此,理论上讲,针对 Gli干预治疗有更广泛的应用价值,因为可以从根本上阻断 HH信号通路下游目的基因转录激活,从而抑制增殖、促进凋亡,为治疗肿瘤提供了新的途径。为进一步研究 Gli1基因在胰腺癌中的作用,本研究采用 RNAi技术,以明确 Gli基因与胰腺癌的关系。
本研究发现,设计的两对 Gli1si RNA中,1#Gli1 si RNA在转染胰腺癌 PC-2细胞 72h后可以显著抑制细胞 Gli1 m RNA和蛋白的表达,说明 1#Gli1 siRNA对于胰腺癌细胞中 Gli的抑制作用特异而且完全。同时,本研究将 1#Gli1 si RNA转染 PC-2细胞后,应用MTT法研究转染后对肿瘤细胞增殖情况的影响,发现在转染48h后肿瘤细胞增殖开始受抑制,72h后肿瘤细胞的增殖明显受抑,说明肿瘤细胞的增殖与Gli表达下调有关。同时,本研究采用TUNEL+PI双染流式细胞检测细胞凋亡的方法检测肿瘤细胞的凋亡,发现 1#Gli1 siRNA转染PC-2细胞后,肿瘤细胞的凋亡明显增加,提示 Gli1 siRNA能显著诱导胰腺癌肿瘤细胞的凋亡。我们的研究结果与Tsuda等[10]研究结果一致,表明 Gli1基因与胰腺癌密切相关。
综上,Gli1基因在胰腺癌发生发展中起至关重要的作用,采用 RNAi技术沉默 Gli1基因,能明显抑制胰腺癌细胞的增殖,促进肿瘤细胞凋亡。抑制Gli1的表达有可能成为临床治疗胰腺癌的新靶点。
[1] Lupi O.Correlations between the Sonic Hedgehog pathway and basal cell carcinoma[J].Int J Dermatol,2007,46(11):1113-1117.
[2] Yoon JW,Gilbertson R,Iannaccone S,etal.Defining a role for Sonic hedgehog pathway activation in desmoplastic medulloblastoma by identifying GLI1 target genes[J].Int J Cancer,2008,124(1):109-119.
[3] Morton JP,Mongeau ME,Klimstra DS,etal.Sonic hedgehog acts at multiple stages during pancreatic tumorigenesis[J].Proc Natl Acad Sci USA,2007,104(12):5103-5108.
[4] 王火亘,邓明明,陈果等.锌指转录因子 Gli1在胰腺癌组织中的表达及其意义[J].陕西医学杂志,2009,38(3):292-294.
[5] Thayer SP,di Magliano MP,Heiser PW,etal.Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis[J].Nature,2003,425(6960):851-856.
[6] Buttitta L,Mo R,Hui CC,etal.Interplays of Gli2 and Gli3 and their requirement in mediating Shh-dependent sclerotome induction[J].Development,2003,130(25):6233-6243.
[7] Pola R,Ling LE,Aprahamian TR,etal.Postnatal recapitulation of embryonic hedgehog pathway in response to skeletal muscle ischemia[J].Circulation,2003,108(4):479-485.
[8] Kumar SK,Roy I,Anchoori RK,etal.Targeted inhibition of hedgehog signaling by cyclopamine prodrugs for advanced prostatecancer[J].Bioorg M ed Chem,2008,16(6):2764-2768.
[9] Chen MH,Gao N,Kawakami T,Mice deficient in the fused homolog do not exhibit phenotypes indicative of perturbed hedgehog signaling during embryonic development[J].Mol Cell Biol,2005,25(16):7042-7053.
[10] Tsuda N,Ishiyama S,Li y,etal.Synthetic microRNA designed to target glioma-associated antigen 1 transcription factor inhibits division and induces late apoptosis in pancreatic tumor cells.Clin Cancer Res[J].2006,12(21):6557-6564.

