熊果酸诱导肝癌细胞HepG2凋亡的实验研究
张 静
(长江大学医学院,湖北 荆州 434023)
熊果酸诱导肝癌细胞HepG2凋亡的实验研究
张 静
(长江大学医学院,湖北 荆州 434023)
目的:探讨熊果酸对肝癌细胞HepG2的增殖抑制和诱导凋亡作用及其机制。方法:运用体外细胞毒性实验(MTT)检测细胞的增殖;流式细胞术分析细胞周期和凋亡率;Western blot检测HepG2细胞内细胞色素C(cytochrome c,cyt-c)、caspase-3的表达。结果:熊果酸对HepG2细胞具有抑制增殖和诱导凋亡作用,并呈浓度和时间依赖性;细胞主要阻滞在G0/G1期,S期细胞数减少;同时cyt-c释放和caspase-3酶原活化增加。结论:熊果酸能够在体外抑制肝癌细胞HepG2增殖并诱导其凋亡,而促进cyt-c释放增加,引起caspase-3的活化可能是其作用机制之一。
熊果酸;HepG2;细胞色素C;Caspase-3
熊果酸(Ursolic acid,UA),又名乌索酸、乌苏酸,是一种五环三萜酸类化合物,在自然界中分布广泛,如在熊果、枇杷叶、女贞子、山楂、车前子、夏枯草和白花蛇舌草等天然植物中。它具有抗炎、护肝、止痛、降血糖、调节中枢神经系统以及抗肿瘤等多种生物学效应[1],其中最为突出的是抗肿瘤作用。研究发现,UA既能诱导肿瘤细胞凋亡,又能抑制正常细胞的恶变,有望成为抗肿瘤新药。目前已证实它能通过多种机制诱导人乳腺癌细胞MGF-7、肺癌细胞A529、前列腺癌pc-3、胃癌细胞BGC-823和SGC、大肠癌细胞-HT29、子宫内膜癌SNG-Ⅱ等多种肿瘤细胞凋亡[2];也能通过胞浆内糖皮质激素受体的移位下调人纤维肉瘤HT1080细胞MMP9基因的表达,从而降低肿瘤的侵袭力[3]。本研究用UA处理人肝癌细胞HepG2,观察细胞内相关基因的改变,为熊果酸在抗肿瘤临床应用及其作用机制的深入研究提供实验依据。
1 材料与方法
1.1材料人肝癌细胞株HepG2购自上海细胞所;RPMI-1640购自Gibco BRL公司;熊果酸、MTT、Hoechst33258荧光染料和PI染料均购自美国Sigma公司;鼠抗人cyt-c,caspase-3单抗购自Chemicon公司。
1.2方法
1.2.1 细胞培养 用含10%小牛血清的新鲜RPMI1640培养基于37℃、5%CO2的饱和湿度培养箱中传代培养,取对数生长期细胞进行实验。
1.2.2细胞增殖抑制实验 将对数生长期细胞浓度调整为2×104个/ml,每孔200l接种于96孔培养板,孵育24h后,每孔加入不同药物浓度的UA使终浓度分别为20、40、60和80mol/L,每组设6个复孔;另设对照组(0mol/L)。分别于加药后24,48和72h检测细胞活动。细胞孵育终止前,每孔加入MTT使其终浓度为1mg/ml,4h后离心弃上清,每孔加入DMSO 100μl溶解结晶,混匀后置于酶标仪570nm波长处测光密度(D)。计算增殖抑制率IR(%)=[(1-实验组光密度值)/对照组光密度值]×100%。
1.2.3 流式细胞术检测细胞凋亡及细胞周期的改变 用终浓度40mol/L的UA作用HepG2细胞24,48,72h,同时设立对照组(0mol/L)。每组收集2×106个细胞,用冰预冷的70%乙醇固定12h;离心弃固定液,PBS重悬5min后300目筛网过滤;加入PI染液,4℃避光染色30min,流式细胞仪(Beckman)分析细胞周期及凋亡率。
1.2.4 Western blotting 分别用终浓度0,20,40,60和80mol/L UA作用于细胞48h,每组收集1×107个细胞;分别加入120μl蛋白裂解液在冰浴中裂解30min后,4℃离心并收集上清;取约25μl样品进行SDS-PAGE电泳。电泳结束后取凝胶,于4℃下电流60mA转印过夜至硝酸纤维素膜。5%脱脂奶粉封闭1h后,依次加第一抗体鼠抗人cyt-c(鼠抗人caspase-3)单抗和第二抗体HRP-羊抗鼠(羊抗兔)IgG,各孵育1h,DAB显色液显色并摄像、保存。

2 结 果
2.1UA对HepG2细胞增殖的抑制作用UA呈剂量和时间依赖性的抑制肝癌HepG2细胞增殖(见表1)。20mol/L UA对HepG2细胞的增殖抑制作用相对较弱,而 80mol/L UA作用72h后,HepG2细胞几乎停止增殖。
表1不同浓度UA抑制HepG2细胞增殖的动态作用

注:与对照组比较,*Plt;0.05,**Plt;0.01。
2.2UA对细胞凋亡及细胞周期的影响经40mol/L UA作用24,48,72h后,随着作用时间的延长,G0/G1期细胞的比例逐渐上升,S期细胞的比例逐渐下降,主要呈现G0/G1期阻滞,并存在时间依赖性。见表2。

表2 UA对HepG2细胞周期和凋亡率的影响 %
注:与对照组比较,*Plt;0.05。
2.3Westernblotting结果用20~80mol/L UA处理细胞48h后,随着药物浓度增加,细胞色素C(15kD)的蛋白条带逐渐加深(见图1)。还可以检测到约caspase-3(32kD)酶原活化,棕黄色蛋白条带逐渐变浅变细;而活化片段(17kD和19kD)的蛋白条带颜色则逐渐加深(见图2)。
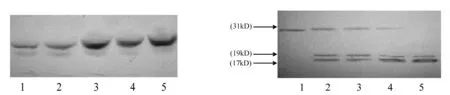
1~5:0,20,40,60和80mol/L UA 1~5:0,20,40,60和80mol/L UA 图1 Western blotting检测UA作用后cyt-c表达 图2 Western blotting检测UA作用后caspase-3表达
3 讨 论
肝癌是我国最常见的恶性肿瘤之一,其死亡率居我国恶性肿瘤死亡率的第二位。虽然目前外科手术仍是治疗肝癌的最有效手段,但适于手术切除的肝癌不足25%,而且术后5年生存率仅为40%[4]。因此,为肝癌患者寻找更多、更有效的治疗手段变得越来越迫切。大量报道表明熊果酸具有广泛的药理作用,它能通过抑制肿瘤形成、细胞毒作用、生长抑制、诱导肿瘤细胞凋亡、抑制肿瘤血管形成以及增强免疫功能等多种机制来抑制肿瘤生长和扩散;而且其安全性能高、不良反应少,具有广阔的开发应用前景,有望成为一种高效低毒的抗肿瘤新药。
本实验结果表明,UA对肝癌HepG2细胞具有明显的增殖抑制和诱导凋亡作用,并呈浓度和时间依赖性。应用80mol/L熊果酸处理HepG2细胞72h后,其增殖抑制率最高达到89.22%。细胞周期分析发现UA主要将肝癌HepG2细胞阻滞在G0/G1期,而S期细胞逐渐减少。随着作用时间的延长,UA阻滞细胞周期的作用逐渐增强, 呈显著的时间依赖性。这一结果提示:熊果酸可能直接损伤DNA,通过阻滞细胞G0/G1期,使细胞堆积在DNA合成前期,无法进入DNA合成期,从而抑制肿瘤细胞的恶性增殖。
近年来研究发现,caspases的蛋白酶级联反应控制着凋亡的发生与发展[5]。Caspases级联发应的激活主要通过两条途径:一条是外源性途径[6]即死亡受体途径,另一条是内源性途径[7]即线粒体依赖途径。本实验主要是从线粒体依赖途径方面研究。Western blotting的结果显示,随着熊果酸作用浓度的增加,细胞色素C的条带颜色逐渐加深,说明其释放量逐渐增多,同时我们还检测到caspase-3酶原被活化,裂解成两个活性片段(17kD和19kD)。我们认为,细胞色素C从线粒体释放是细胞凋亡的关键步骤,释放到细胞浆的细胞色素C在dATP存在的条件下能与凋亡相关因子1(Apaf-1)结合,形成细胞色素C/Apaf-1复合体,该复合体可使无活性的caspase-9酶原发生自身活化,继而形成细胞色素C/Apaf-1/caspase-9 复合体,此复合体继续作用于下游的效应caspases如caspase-3等。活化的caspase-3可以作用于胞质中的细胞骨架蛋白,或作用于细胞核中的DNA酶,引起DNA断裂,从而引发了HepG2细胞的凋亡[8]。
综上所述,促进cyt-c的释放,进一步激活caspase-3可能是熊果酸诱导细胞凋亡的作用机制之一,当然为了更加肯定这个结论,我们将在后续实验中检测caspase-9、Apaf-1等。但由于细胞凋亡是一个多系统、多阶段参与的复杂过程[9],熊果酸在体内对细胞凋亡的影响尚有待进一步研究。
[1]王婷,宋怀燕. 熊果酸药理作用研究进展[J]. 中华医学研究杂志,2005,5(9):877-879.
[2] 海龙,苏秀兰,毕力夫. 熊果酸抗肿瘤机制研究进展[J]. 2008,15(11):870-872.
[3] 张秋萍,谢珞琨,邓涛,等. 熊果酸促进K562细胞凋亡[J]. 基础医学与临床,2004,24(4):414-417.
[4] 王辉,方全华,李海军. 熊果酸诱导人肝癌BEL-7404细胞凋亡的作用及其机制[J]. 肿瘤基础与临床,2010,23(2):93-95.
[5] Wei MC,Tullia L,Vamsi K,etal.tBID,membrane-targeted death ligand, oligomerizes BAK to release cytochrome c[J]. Denes Dev,2000, 14:2060-2071.
[6] Shou GZ,Mary CL, Irene EK. caspase-8 mediates caspase-3 activation and cytochrome c release during singlet oxygen-induced apoptosis of hl-60 cells[J]. Experimental Cell Research,1999,250(1):203-212.
[7] Liu X,Kim CN,Yang J,etal. Induction of apoptotic program in cell free extract:Requirement for dATP and cytochrome C[J]. Cell,1996,86:147-157.
[8] 李振光,彭旭. 线粒体与细胞凋亡[J]. 基础医学与临床,2001,21(5):400-403.
[9] Oohyun S,Vladimir I,Qing X,etal.The effect of ursodeoxycholic acid on the survivin in thapsigargin-induced apoptosis[J]. Cancer Letters,2003,191:83-92.
[编辑] 一 凡
2010-11-20
张静(1981-),女,湖北沙市人,讲师,硕士,从事分子生物学教学与研究工作。
10.3969/j.issn.1673-1409(R).2010.04.002
R735.7
A
1673-1409(2010)04-R004-03

