葡萄糖转运蛋白1在乳腺癌组织中的表达及与其预后的关系
沈春燕 穆海玉 佟仲生
葡萄糖转运蛋白1(glucose transporter protein 1,GLUT-1)是哺乳动物细胞转运葡萄糖的最重要的载体,肿瘤细胞中GLUT-1表达异常升高,可能为癌细胞摄取葡萄糖增多的机制之一,是肿瘤缺氧的1个内源性标记[1]。关于乳腺癌组织中GLUT-1表达及其与乳腺癌患者预后的关系鲜有报道。本研究采用免疫组化法,检测乳腺癌组织中GLUT-1表达情况,分析与其临床病理因素及预后的关系,旨在讨论GLUT-1在乳腺癌发展过程中的作用。
1 材料与方法
1.1 研究对象
选择2003年7月~2008年6月我院收治的、经手术确诊且病历资料完整的81例原发性乳腺癌病例及20例乳腺纤维瘤病例,均为女性;乳腺癌病例未纳入局部晚期者,且术前均未行新辅助放化疗。中位年龄53岁(35~72岁);雌激素受体阳性47例,孕激素受体阳性34例;肿瘤直径>5 cm 5例,2~5 cm 45例,<2 cm 31例;淋巴结转移数目4个以上者38例;所有乳腺癌患者追踪随访肿瘤复发或转移情况,中位随访时间46个月,随访截至2011年1月,有复发和(或)转移者39例。
1.2 主要材料
兔抗人GLUT-1单克隆抗体购自加拿大LAB VISION公司,免疫组化试剂盒购自晶美生物有限公司。
1.3 实验方法
免疫组化步骤为组织标本经石蜡包埋,制成4 μm厚切片。常规脱蜡至水,3%新鲜双氧水灭活内源性过氧化物酶,微波修复抗原,山羊血清封闭后不洗,滴加GLUT-1一抗,4℃过夜,PBS洗涤后加生物素标记二抗,37℃孵育45 min后,PBS洗,滴加链霉亲和素过氧化物酶复合物,37℃孵育15 min后,DAB显色,苏木精复染,二甲苯透明,中性树胶封片。
1.4 结果判定
光镜下GLUT-1阳性细胞为细胞膜呈棕黄色颗粒。高倍镜下每张切片随机选择5个视野,每个视野计数200个细胞,共计1 000个细胞,阳性细胞数<10%为阴性,阳性细胞数≥10%为阳性。
1.5 统计学处理
计数资料采用χ2检验,Kaplan-Meier法描绘生存曲线,组间生存率比较采用Log-rank检验,检验水准α=0.05。采用SPSS 17.0统计软件完成。
2 结果
2.1 两组乳腺组织中GLUT-1蛋白表达情况
乳腺癌组织中GLUT-1蛋白阳性表达率为61.7%(50/81),阳性颗粒主要分布在细胞膜和部分胞质中;20例乳腺纤维瘤组织中GLUT-1均呈阴性染色(无阳性表达或仅散在少数轻微着色)。乳腺癌组织中GLUT-1阳性率明显高于乳腺纤维瘤组织,有显著统计学差异(P<0.001)。
2.2 GLUT-1表达与乳腺癌临床病理因素的关系
乳腺浸润性导管癌中GLUT-1表达与患者年龄、ER和PR激素受体及肿瘤大小无显著相关性(P>0.05);而与淋巴结转移数目及有无复发和(或)转移显著相关:其中淋巴结转移数目>4个者GLUT-1阳性率为73.7%(28/38),显著高于淋巴结转移数目≤4个者[51.2%(22/43)](P<0.05);有复发和(或)转移者GLUT-1阳性率[74.4%(29/39)],显著高于无复发和(或)转移者[50.0%(21/42)](P<0.05),见表1。
2.3 GLUT-1表达与乳腺癌预后的关系
对81例乳腺癌患者的无复发生存期进行Kaplan-Meier生存分析,经Log-rank检验显示:GLUT-1阳性组与阴性组无复发生存时间比较有显著统计学差异(P=0.041),其中GLUT-1阳性组中位无复发生存时间为(48.56±3.35)个月,GLUT-1阴性组中位无复发生存时间为(66.79±4.50)个月,结果表明GLUT-1表达与乳腺癌患者预后密切相关,见图1。
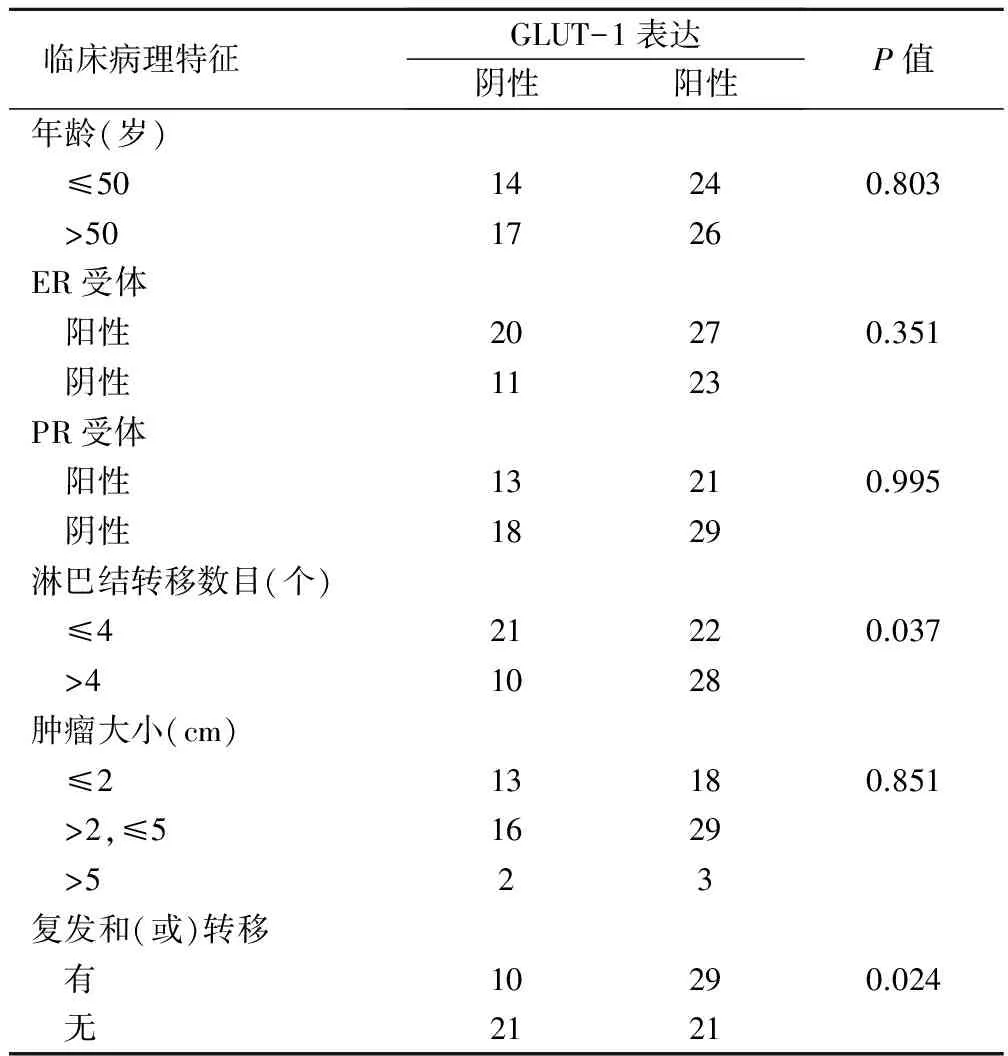
表1 GLUT-1蛋白表达与乳腺癌临床病理特征的关系(例)
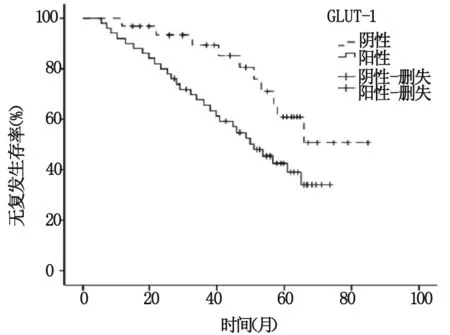
图1 GLUT-1阳性组和阴性组无复发生存曲线
3 讨论
GLUT-1基因位于1p34.2,其编码蛋白为55 kD,是1种膜性易化葡萄糖转运蛋白,能促进葡萄糖向细胞内扩散及促进细胞代谢,是哺乳动物葡萄糖跨膜转运最重要的载体,也是已知葡萄糖转运蛋白家族中分布最广泛的转运体,不但参与葡萄糖跨膜转运的正常生理过程,而且在肿瘤等许多病理情况下出现异常表达。GLUT-1在生理状态下主要分布于红细胞胞膜,胎盘及血-脑屏障等,在恶性肿瘤细胞中由于代谢增强、无氧酵解增加而出现过表达。近年来发现,GLUT-1的过表达与恶性肿瘤的发生、发展密切相关,是目前肿瘤研究的热点之一[2~4]。
众所周知,恶性肿瘤主要生长特征为肿瘤细胞的持续、快速增殖,肿瘤组织生长速度过快而血供相对不足,中央组织往往处于缺氧状态,而缺氧常使肿瘤具有更高的恶性程度。细胞缺氧与营养缺乏是GLUT-1表达增强的主要诱因:在肿瘤缺氧状态下,缺氧诱导因子1-α(hypoxia inducible factor-1α,HIF-1α)表达增强,可以调控与细胞代谢及血管生成相关的多种下游因子的基因转录[5],包括诱导及促进葡萄糖代谢和转运的相关蛋白如GLUT-1、血管内皮生长因子、促红细胞生成素等[6~8],并促进肿瘤新生血管形成。因此,在缺氧环境下GLUT-1在恶性肿瘤细胞表面往往异常高表达[9],从而增加肿瘤细胞对葡萄糖的摄取而满足其能量需求,由此进一步促进恶性肿瘤的生长和转移。
吕增华等[10]研究发现,GLUT-1表达与胃黏液腺癌早期淋巴结转移密切相关;Semaan等[11]报道,GLUT-1和卵巢癌组织微血管密度呈正相关,并且是重要的预后因素;Kunkel等[12]报道,在口腔鳞癌患者中GLUT-1阳性组总生存期,显著短于GLUT-1阴性组。GLUT-1参与了胃癌、卵巢癌及口腔癌等多种恶性肿瘤的发生、发展过程,说明GLUT-1与恶性肿瘤的高侵袭性及不良预后有关,但在乳腺癌的研究中,国内鲜有其与预后的相关报道。
本研究发现,GLUT-1在乳腺癌中的高表达率为61.7%(50/81),而乳腺纤维瘤组织中未见GLUT-1表达,两者具有显著统计学差异,这与国外Schmidt等[13]研究结果相近,提示GLUT-1与乳腺癌的发生及乳腺癌细胞的增殖活性密切相关。由此推测GLUT-1参与了恶性肿瘤的发生,并可能是肿瘤恶变的早期标志。GLUT-1表达与患者年龄、肿瘤大小无相关性,而且我们也未发现其过表达与雌孕激素受体状态显著相关,这与国内一些学者的研究结果一致[14]。GLUT-1表达与乳腺癌的淋巴结转移数目、有无转移和(或)复发显著相关。本组81例乳腺癌患者中GLUT-1阳性组和阴性组无复发生存时间分别为(48.56±3.50)个月和(66.79±4.50)个月,两组间存在显著统计学差异。GLUT-1表达与乳腺癌淋巴结转移及预后有关。综上,我们认为:随着全身肿瘤负荷的增大,癌组织能量需求也随之升高,在恶性肿瘤微环境缺氧的条件下,无氧酵解依然是肿瘤主要的供能方式,而GLUT-1作为细胞膜上主要的葡萄糖转运通路,为肿瘤细胞提供最基本的葡萄糖供应,其在表达增强的同时,多种癌基因和生长因子介导缺氧反应基因的调控而上调、激活GLUT-1[15],促使葡萄糖的摄取和转运,从而满足肿瘤细胞在缺血、缺氧环境下的不断倍增。因此,GLUT-1高表达的乳腺癌病例具有较强的侵袭性生物学特性,更易于复发和转移,并且是1个具有判断预后意义的指标。
总之,GLUT-1参与葡萄糖转运、增强糖酵解,以提供肿瘤组织无限增殖、侵袭的能量代谢需要,GLUT-1与乳腺癌的发生、发展密切相关,并可作为判断乳腺癌恶性生物学行为及预测预后的一项重要指标。因此,更加深入和广泛地探讨GLUT-1在乳腺癌发生、发展过程中的作用,将为乳腺癌的诊治提供新的靶点,对提高乳腺癌的诊治水平具有重大意义。
[1]Hoskin PJ,Sibtain A,Daley FM,et al.GLUT1 and CAIX as intrinsic markers of hypoxia in bladder cancer:relationship with vascularity and proliferation as predictors of outcome of ARCON〔J〕.Br J Cancer,2003,89(7):1290.
[2]Luo XM,Zhou SH,Fan J.Glucose transporter-1 as a new therapeutic target in laryngeal carcinoma〔J〕.J Int Med Res,2010,38(6):1885.
[3]Liu TQ,Fan J,Zhou L,et al.Effects of suppressing glucose transporter-1 by an antisense oligodeoxynucleotide on the growth of human hepatocellular carcinoma cells〔J〕.Hepatobiliary Pancreat Dis Int,2011,10(1):72.
[4]Rademakers SE,Lok J,van der Kogel AJ,et al.Metabolic markers in relation to hypoxia;staining patterns and colocalization of pimonidazole,HIF-1alpha,CAIX,LDH-5,GLUT-1,MCT1 and MCT4〔J〕.BMC Cancer,2011,11(1):167.
[5]Ousset M,Bouquet F,Fallone F,et al.Loss of ATM positively regulates the expression of hypoxia inducible factor 1 (HIF-1) through oxidative stress:Role in the physiopathology of the disease〔J〕.Cell Cycle,2010,9(14):2814.
[6]Irem Hicran Ozbudak,Seyda Karaveli,Tayyup Simsek,et al.Neoangiogenesis and expression of hypoxia-inducible factor 1alpha,vascular endothelial growth factor,and glucose transporter-1 in endometrioid type endometrium adenocarcinomas〔J〕.Gynecologic Oncology,2008,108(3):603.
[7]Li ZD,Liu LZ,Shi X,et al.Benzo[a]pyrene-3,6-dione inhibited VEGF expression through inducing HIF-1alpha degradation〔J〕.Biochem Biophys Res Commun,2007,357(2):517.
[8]Tekin D,Dursun AD,Xi L.Hypoxia inducible factor 1 (H-IF-1) and cardioprotection〔J〕.Acta Pharmacol Sin,2010,31(9):1085.
[9]Airley R,Evans A,Mobasheri A,et al.Glucose transporter Glut-1 is detectable in peri-necrotic regions in many human tumor types but not normal tissues:Study using tissue microarrays〔J〕.Ann Anat,2010,192(3):133.
[10]吕增华,张树华,朱玉红.GLUT1和VEGF-c蛋白表达及其与胃黏液腺癌浸润转移关系的研究〔J〕.实用癌症杂志,2008,23 (1):25.
[11]Semaan A,Munkarah AR,Arabi H,et al.Expression of G-LUT-1 in epithelial ovarian carcinoma:correlation with tumor cell proliferation,angiogenesis,survival and ability to predict optimal cytoreduction〔J〕.Gynecol Oncol,2011,121(1):181.
[12]Kunkel M,Moergel M,Stockinger M,et al.Overexpression of GLUT-1 is associated with resistance to radiotherapy and adverse prognosis in squamous cell carcinoma of the oral cavity〔J〕.Oral Oncology,2007,43(8):796.
[13]Schmidt M,Voelker HU,Kapp M,et al.Glycolytic phenotype in breast cancer:activation of Akt,up-regulation of GLUT1,TKTL1 and down-regulation of M2PK〔J〕.J Cancer Res Clin Oncol,2010,136(2):219.
[14]Kuo SJ,Wu YC,Chen CP,et al.Expression of glucose transporter-1 in Taiwanese patients with breast carcinoma--a preliminary report〔J〕.Kaohsiung J Med Sci,2006,22(7):339.
[15]Koo JS,Jung W.Alteration of REDD1-mediated mammalian target of rapamycin pathway and hypoxia-inducible factor-1α regulation in human breast cancer〔J〕.Pathobiology,2010,77(6):289.

