CD4+CD25+调节性T细胞对内皮细胞抗原提呈功能的影响及机制①
何少林 李大主 黎 明 马旭明 林 静 昌 薇 赵 卉
(华中科技大学同济医学院协和医院心内科,武汉 430022)
CD4+CD25+调节性T细胞对内皮细胞抗原提呈功能的影响及机制①
何少林 李大主 黎 明 马旭明 林 静 昌 薇 赵 卉
(华中科技大学同济医学院协和医院心内科,武汉 430022)
目的:探讨CD4+CD25+调节性T细胞(Treg)对内皮细胞抗原提呈功能的影响及机制。方法:磁性细胞分离器(MACS)分离CD4+CD25+T细胞及CD4+CD25-T细胞。在ox-LDL作用下,HUVECs与CD4+CD25+T细胞共培养,24小时后收集HUVECs。应用流式细胞术测定HUVECs抗原提呈分子(HLADR,CD86,CD80)的表达,Cell Counting Kit-8法(CCK-8)测定HUVECs刺激CD4+CD25-T细胞增殖的能力,Transwell小室实验初步探讨Treg作用于HUVECs的具体机制。结果:与对照组比较,Treg可显著抑制HUVECs抗原提呈分子的表达及刺激T细胞增殖的能力。用Transwell隔离后,与or-LDL刺激组比较,HUVECs抗原提呈分子表达及其刺激T细胞增殖的能力无明显变化。结论:Treg可显著抑制HUVECs抗原提呈能力,其作用机制可能为下调CD86的表达,且依赖细胞直接接触。
CD4+CD25+调节性T细胞;人脐静脉内皮细胞系;氧化型低密度脂蛋白;抗原提呈分子;细胞增殖;Transwell
动脉粥样硬化(AS)是一种炎症性疾病[1]。内皮损伤及由此介导的T细胞的活化,归巢与AS有关。血管内皮细胞具有抗原提呈作用,参与诸多炎性疾病的发生发展[2]。Treg可抑制AS,但具体机制不清[3]。我们既往研究表明Treg可抑制内皮细胞的炎症分泌功能,此作用可能部分与Treg抑制了内皮细胞表达CD86有关[4]。但其是否抑制内皮细胞抗原提呈功能及具体机制尚无报道。本文探讨Treg对内皮细胞抗原提呈功能的影响和可能机制。
1 材料与方法
1.1 材料 主要试剂DMEM/F-12培养基购于Gibco-BRL公司,按说明书配制,4℃保存;特级胎牛血清购于杭州四季青生物制品公司,使用前56℃水浴30分钟灭活补体后分装,-20℃保存;ox-LDL购于Sigma公司;DMSO购于上海华美生物工程公司;人淋巴细胞分离液购于中国医学科学院生物医学工程研究所 ;FITC-anti human CD4、PE-anti human CD25、CD4+CD25+Foxp3+Treg细胞免疫磁珠(MACS)分选试剂盒购于德国Miltenyi Biotec公司;human HLA DR-PE 、human CD80-PE 、human CD86-PE、human IgGPE、human anti-CD3 mAb OKT3购于美国 eBioscience公司;CCK-8试剂盒购于日本同仁化学公司;DNA探针由上海Invitrogen公司合成。
1.2 方法
1.2.1 细胞分离与培养
1.2.1.1 HUVECs的培养及鉴定 取新生儿脐带,PBS洗净脐静脉腔后灌注0.1%Ⅰ型胶原酶,血管钳夹闭静脉两端,置 37℃水浴箱 12~15分钟,收集消化液,1 200 r/min离心10分钟,弃上清,加入内皮细胞培养基,置37℃、5%CO2孵育箱中培养24小时,PBS洗去红细胞及未贴壁细胞,加入含10%特级胎牛血清及内皮细胞生长添加物(100mg/L)的培养基中继续培养,2~3天换一次液。至贴壁细胞70%~80%融合时,用 0.25%胰蛋白酶消化传代,取3~5代用于试验。倒置相差显微镜下观察细胞呈单层鹅卵石样排列,Ⅷ因子相关抗原免疫荧光染色阳性,确定为内皮细胞。
1.2.1.2 CD4+CD25+T细胞及CD4+CD25-T细胞的分离及激活 以无菌注射器采集外周50ml(来自健康志愿者),肝素抗凝,密度梯度离心法分离外周血单个核细胞(PBMC),收集的PBMC用CD4+CD25+Treg细胞免疫磁珠(MACS)分选试剂盒,阴性选择获得CD4+T细胞;加入PE标记抗小鼠CD25单克隆抗体,再加入磁珠标记抗PE,阳性选择获得CD4+CD25+T细胞,阴性选择获得CD4+CD25-T细胞,通过流式细胞仪(BD FACS Calibur)分析细胞纯度,经鉴定其纯度分别>92%和>98%。将分选后的CD4+CD25+T细胞和CD4+CD25-T细胞分别用无血清DMEM/F-12培养基重悬,调整细胞至终浓度109cells/L,种入预先包被好human anti-CD3mAb OKT3(10 mg/L)的96孔板,每孔终体积100μl,孵育48小时。
1.2.2 Treg与HUVECs的共培养及分组 CD4+CD25+T细胞(均为5×105细胞/孔)与抗人CD3 mAb(10mg/L)孵育48小时后,加入种有融合已达90%的内皮细胞(3×106~4×106细胞/孔)的培养板中,在终浓度均为50mg/L的ox-LDL中共培养24小时,分为3组:(1)HUVECs组(control组):HUVECs,不加任何刺激;(2)HUVECs+ox-LDL组(no T组):HUVECs+ox-LDL;(3)HUVECs+ox-LDL+Treg组(CD25+组):HUVECs+Treg+ox-LDL。细胞置于37℃、5%CO2、95%空气的培养箱中培养。24小时后,移去培养液,用 PBS轻洗2遍,去除未粘附细胞,用0.25%胰蛋白酶液消化收集HUVECs备用。
1.2.3 流式细胞术检测HUVECs HLA DR,CD80,CD86的表达 收集上述处理过的各组单个HUVECs,离心弃上清,80μl PBS液重悬,每管加入单克隆抗体human HLA DR-PE或CD86-PE或CD80-PE各20μl,4℃孵育30分钟,加入含2%BSA,0.1%NaN3的PBS液,1 200 r/min离心,10分钟,反复洗2次。去上清,加入1%多聚甲醛PBS液(pH7.2)500μl,流式细胞仪检测,其结果以阳性百分率表示。每份样本均设阴性对照(加相应IgG抗体),以消除本底荧光的影响。
1.2.4 单相淋巴细胞增殖抑制试验 CCK-8试剂可简便而准确的测定细胞增殖。CD4+CD25+T细胞与抗人CD3mAbs(10mg/L)孵育48小时,离心重悬。将已被抗人CD3mAbs激活的不同浓度CD4+CD25+T细胞(HUVECs:Treg 分别为 :0∶1、1∶0、1∶1、1∶0.5、1∶0.25、1∶0.125,分别加入已种有 HUVECs(5×105细胞/孔)及终浓度均为50mg/L的ox-LDL的培养板中,在37℃、5%CO2、95%空气的培养箱中共培养,24小时后胰蛋白酶液消化收集HUVECs,经6 000 rad辐照灭活,加入96孔U型板(Nunc)100μl/孔,设3个复孔,过夜培养使其贴壁,次日每孔吸出上清50μl,然后补加等体积的营养液,最后加100μl的CD4+CD25-T 细胞置于 37℃、5%CO2、95%空气的培养箱中进行单向混合淋巴细胞培养5天。每个孔内加入10μlCCK-8,在培养箱内培养4小时后,酶标仪450 nm波长处测定吸光度(A)值。
1.2.5 Transwell实验 Tanswell上下小室间的通透膜孔径为0.4μm,可允许细胞因子自由通过,而Treg不能自由通过。实验分为4组:①HUVECs组(control组):HUVECs,不加任何刺激;②ox-LDL诱导组(no T组):HUVECs+50mg/Lox-LDL;③CD4+CD25+T细胞组(CD25+组):HUVECs+CD4+CD25+T细胞+anti-CD3mAbs+50mg/L ox-LDL;④Transwell实验组(TW组):下室中种入HUVECs,上室中种入CD4+CD25+T细胞+anti-CD3mAbs。48小时后,移走上室,下室中加入50mg/L ox-LDL。各组细胞均置5%CO2、37℃孵箱,培养24小时后收获HUVECs测定CD86的表达或行单相淋巴细胞增殖抑制试验。
1.3 统计学处理 以上各组实验至少独立重复三次,结果均用SPSS13.0统计软件进行统计学处理。组间数据处理根据方差齐性分析的结果,进一步使用S-N-K检验进行组间差异的比较,P<0.05为差异有显著性。
2 结果
2.1 ox-LDL 对HUVECs 表面HLA DR、CD80、CD86表达的影响 流式细胞术表明:与control组比,no T组CD86及HLA DR均显著升高(P<0.001),而CD80表达无显著差异(P>0.05,图1)。
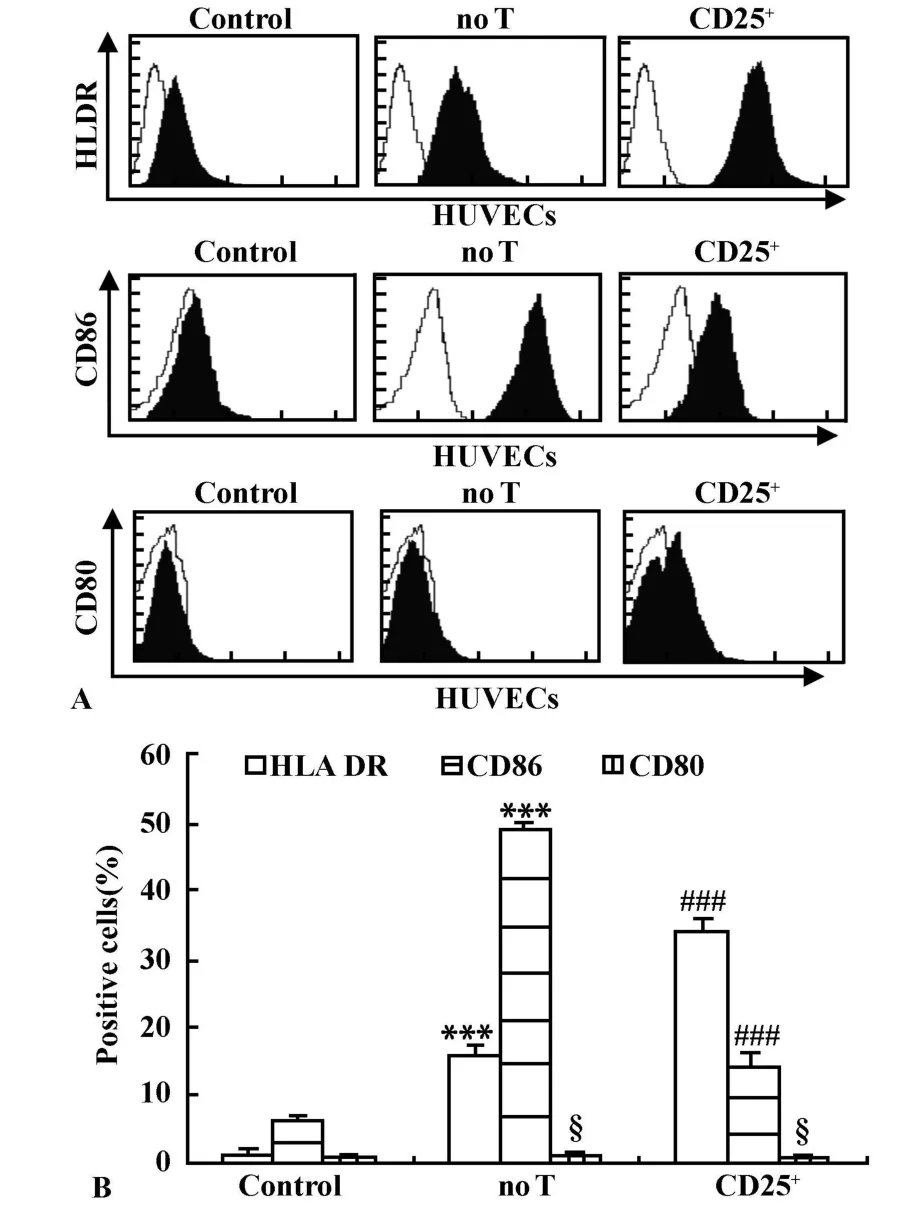
图1 调节性T细胞对HUVECs表面HLA DR,CD80,CD86表达的影响Fig.1 Tregmodu lateexp ression of CD80,CD86 and HLA DR in HUVECs impaired by ox-LDL
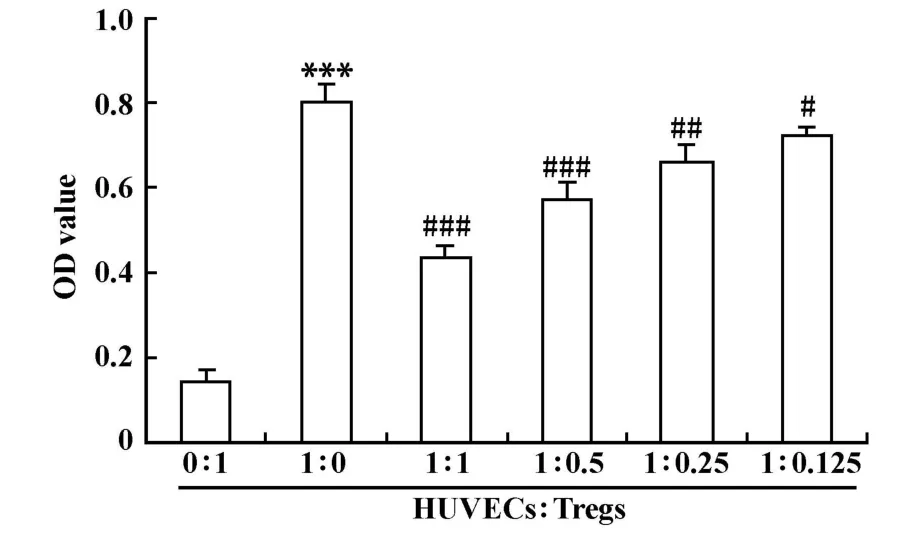
图2 单相淋巴细胞增殖抑制试验Fig.2 The effect of Treg treated HUVECs on the p roliferation of CD4+CD25-T cells
2.2 Treg对ox-LDL诱导HUVECs表面HLA DR、CD80、CD86表达的影响 流式细胞术表明:与no T组比,CD25+组CD86表达显著下降(P<0.01),而HLA DR显著升高(P<0.001),CD80表达无显著差异(P>0.05,图1)。
2.3 单相淋巴细胞增殖抑制试验 与HUVECs∶Treg为 0∶1 时比 ,HUVECs∶Treg 为 1∶0 时HUVECs刺激CD4+CD25-T细胞增殖的能力显著升高(P<0.001)。而与HUVECs∶Treg为 1∶0时比,当加入的Treg逐渐升高时,HUVECs刺激CD4+CD25-T细胞增殖的能力逐渐下降(所有P<0.05,图2)。
2.4 Treg对HUVECs的抑制作用依赖于细胞直接接触和细胞因子
2.4.1 与no T组相比,CD25+组HUVECs CD86表达下降(P<0.001),但TW组HUVECs CD86无明显变化(P>0.05),表明Treg对HUVECs CD86表达的抑制作用可被Transwell小室逆转(图3A和B)。
2.4.2 与no T组相比,CD25+组HUVECs刺激T细胞增殖能力下降(P<0.001),但TW组HUVECs刺激T细胞增殖能力无明显变化(P>0.05),表明Treg对HUVECs刺激T细胞增殖能力的抑制作用可被Transwell小室逆转(图3C)。
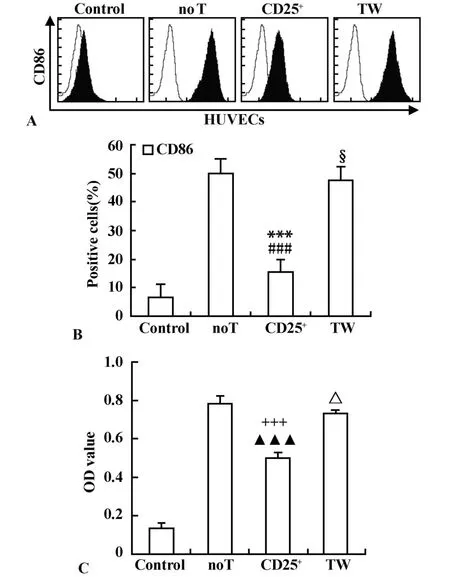
图3 Treg对HUVECs的抑制作用依赖于细胞直接接触和细胞因子Fig.3 Tregmediated supp ression of HUVECs antigen-presenting function requires cell
3 讨论
动脉粥样硬化(AS)是一种炎症性疾病,免疫反应促进了AS病变进展[1]。传统的AS危险因素如ox-LDL能刺激内皮细胞表达各种炎性因子,吸引炎性细胞并使其在局部粘附,进而进入内膜下,产生炎症反应[5]。在这一进程中,作为兼职抗原提呈细胞的内皮细胞被炎性介质激活,并表达MHC-Ⅱ和共刺激分子提呈抗原,从而介导细胞免疫反应,为关键步骤之一[6,7]。有报道认为抗原提呈细胞(APC)的抗原力与其表面分子MHC-Ⅱ、CD80和CD86表达量呈正相关。此外,CD86组成性地低表达于未受刺激的APC,APC活化后,CD86分子的表达先于CD80迅速上调;转染CD80的肿瘤细胞,其免疫原性明显低于转染CD86的肿瘤细胞,因而认为CD86是启动免疫应答更重要的分子[8,9]。但既往研究存在争议,有报道认为内皮细胞表面表达CD80和/或CD86[10],有报道认为不表达[11]。这种差异一般认为与细胞来源,细胞所处代数或不同的培养环境有关。本实验中,在ox-LDL刺激下,HUVECs可高表达HLA DR与CD86,而CD80在刺激前后均为低表达,提示在ox-LDL刺激下,HUVECs具有非常强的抗原提呈能力,且主要依赖于HLA DR与CD86。
他人及我们的诸多研究表明,Treg在AS炎症反应的调控中起重要作用:AS病人循环中Treg的数量和功能下调[12];过继输入Treg可以抑制小鼠动脉粥样硬化斑块的形成[13];Treg可抑制ox-LDL致损内皮细胞炎性因子如VCAM-1、MCP-1及IL-6的表达,且此过程中我们发现Treg可抑制内皮细胞CD86的表达[4]。但Treg是否可抑制内皮细胞的抗原提呈能力及可能机制,研究较少。本实验发现,HUVECs与Treg共培养24小时,HUVECs CD86表达显著被抑制,与我们既往研究相似[4]。HUVECs与不同浓度Treg共培养后,其刺激CD4+CD25-T细胞增殖的能力亦显著被抑制,说明Treg可下调内皮细胞的抗原提呈能力,抑制其介导的免疫反应,从而发挥抗AS的作用。
Treg发生免疫调节的确切机制尚存争议,有的报道认为其调节功能依赖于细胞直接接触;也有报道认为其调节功能由细胞因子介导[14]。产生这一差异的原因可能与Treg作用于不同的细胞,或与其发挥不同的效应时所依赖的机制不同有关。如本实验发现,Treg与HUVECs共培养后HUVECs CD86的表达及其刺激T细胞增殖能力明显下降;而用Transwell小室阻断Treg与HUVECs直接接触后,上述效应被完全逆转,说明Treg对HUVECs抗原提呈能力的抑制作用依赖于细胞直接接触。
综上所述,本实验表明Treg作为一种内源性免疫调节系统的调节者,可抑制ox-LDL诱导损伤的HUVECs抗原提呈分子的表达及刺激T细胞增殖的能力,从而抑制AS的发生发展。上述发现不仅有助于阐明Treg在AS发生发展中的调控作用,而且为AS的防治提供了一条新的途径。
1 Hansson G K.Inflammation,atherosclerosis,and coronary artery disease[J].N Engl JMed,2005;352(16):1685-1695.
2 Danese S,Dejana E,Fiocchi C.Immune regulation bym icrovascular endothelial cells:directing innateand adaptive immunity,coagulation,and inflammation[J].J Immunol,2007;178:6017-6022.
3 Ait-Oufella H,Salomon B L,Potteaux Setal.Natural regulatory T cells control the developmentof atherosclerosis inmice[J].NatMed,2006;12:178-180.
4 He S,Li M,Ma Xetal.CD4+CD25+Foxp3+regulatory T cells protect the proinflammatory activation of human umbilical vein endothelial cells[J].A rterioscler Thromb Vasc Biol,2010;30(12):2621-2630.
5 Alexander E,Fraley,Gregory Getal.Relationship of oxidized phospholipidsand biomarkersofoxidized low-density lipoproteinwith cardiovascular risk factors,inflammatory biomarkers,and effect of stating therapy in patientswith acute coronary syndromes[J].JAm Coll Cardiol,2009;53:218-296.
6 Epperson DE,Pober JS.Antigen-presenting functionofhumanendothelial cells.Direct activation of resting CD8 T cells[J].J Immunol,1994;153(12):5402-5412.
7 Biliana Lozanoska-Ochser,Klei N J,Guo CHetal.Expression of CD86 on human islet endothelial cells facilitates T cell adhesion and migration[J].JImmunol,2008;181:6109-6116.
8 Gotsman I,Sharpe A H,Lichtman AH.T-cell costimulation and coinhibition in atherosclerosis[J].Circ Res,2008;103(11):1220-1231.
9 Sansom D M,Manzotti C N,Zheng Y.What's the difference between CD80 and CD86?[J].Trends Immunol,2003;24(6):314-319.
10 Omari K I,Dorovini-Zis K.Expression and function of the costimulatory molecules B7-1(CD80)and B7-2(CD86)in an in vitromodel of the human blood-brain barrier[J].JNeuroimmunol,2001;113(1):129-141.
11 Denton M D,Geehan CS,Alexander S Ietal.Endothelial cellsmodify the costimulatory capacity of transmigrating leukocytes and promote CD28-mediated CD4+T cell alloactivation[J].J Exp Med,1999;190(4):555-566.
12 Hu Z P,Li D Z,Hu Y Fetal.Changs of CD4+CD25+T cells in patientswith acute coronary syndrome and the effectsof atorvastatin[J].J Huazhong Univ SciTechnologMed Sci,2007;5:524-527.
13 李大主,杨克平,胡英锋etal.抗原特异性调节性T细胞的诱导及其对动脉粥样硬化的影响[J].中华微生物学和免疫学杂志,2006;9(9):795-799.
14 SakaguchiS,Yamaguchi T,Nomura Tetal.Regulatory T cells and immune tolerance.[J].Cell,2008;133:775-787.
[收稿2010-11-27 修回2011-01-13]
(编辑 许四平)
CD4+CD25+regulatory T cellsmodulate antigen-p resenting function of human umbilical vein endothelial cells
HEShao-Lin,LIDa-Zhu,LIMing,MAXu-Ming,LINJing,CHANGWei,ZHAOHui.InstituteofCardiology,Union Hospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
Objective:To investigate whether and how Treg affect the antigen-presenting function of HUVECs,and themechanism of Treg in the developmentof atherosclerosis.Methods:Treg were isolated from human peripheral b loodmononuclear cells(PBMCs)which obtained from normal volunteers bymagnetic cell sorting-column and analyzed by Flow Cytometry.HUVECswere incubated alone(control)or with anti-CD3mAbs activated Treg(CD25+)and ox-LDL.After 24 h,HUVECswere collected and the expression of HLA DR,CD80 and CD86 weremeasured by flow cytometry.ox-LDL treated HUVECs which were pre-cultured with different concentrations of human anti-CD3 mAbs activated Treg were used to stimu late CD4+CD25-T cells,and then the effectof HUVECs on the proliferation of CD4+CD25-T cells weredetected by Cell Counting Kit-8(CCK-8).Transwell experimentwasused to identify how Treg affect the antigen-presenting function of HUVECs.Results:Treg can significantly inhibit the expression ofantigen presentingmolecular in HUVECs aswellas theeffectof HUVECs on the proliferation of CD4+CD25-T cellswhen compared with that in control system;Mechanistic studies reveal that the expression of antigen p resentingmolecular in HUVECs and theeffectof HUVCs on the proliferation of CD4+CD25-T cells in TW system haveno differencewhen compared with that in no Tsystem.Conclusion:Treg areable tomodulate the antigen-presenting function ofHUVECs,which is largely attributed to a down-regulated expression in CD86 in Treg-treated HUVECs and depended on cell contact.
CD4+CD25+Regulatory T cells;Human umbilical vein endothelial cells;oxidized Low-Density Lipoprotein;Antigen-presentingmolecules;Cell proliferation
R392.12
A
1000-484X(2011)05-0391-05
10.3969/j.issn.1000-484X.2011.05.002
①本文为国家自然基金资助项目(No.30670855)
何少林(1983年-),男,博士,主要从事冠心病发病机理及其诊断与治疗研究,E-mail:wskg1982@yahoo.com.cn;
及指导教师:李大主(1963年-),男,教授,博士生导师,主要从事冠心病发病机理及其诊断与治疗研究,E-mail:lidazhuhp@sohu.com。

