泡球蚴感染小鼠肝组织 T-bet、GATA-3、ROR-γt和 IL-17mRNA表达水平的研究①
庞楠楠 丁剑冰 赵 慧 王 晶 李 博 李玉娇 姜 涛 马秀敏
(新疆医科大学第一附属医院医学研究中心新疆包虫病基础医学重点实验室,乌鲁木齐 830011)
泡球蚴感染小鼠肝组织 T-bet、GATA-3、ROR-γt和 IL-17mRNA表达水平的研究①
庞楠楠 丁剑冰②赵 慧 王 晶③李 博③李玉娇 姜 涛 马秀敏②
(新疆医科大学第一附属医院医学研究中心新疆包虫病基础医学重点实验室,乌鲁木齐 830011)
目的:研究泡球蚴感染小鼠肝组织T-bet、GATA-3、ROR-γt和IL-17mRNA表达水平的变化特点,初步探讨Th17细胞与Th1/Th2在棘球蚴感染中的相互关系。方法:通过腹腔接种多房棘球绦虫的幼虫原头蚴混悬液制备泡球蚴感染小鼠模型,持续观察10个月,分别在感染2天、8天、1月、3月、6月和10月处死小鼠,收集肝脏组织。采用逆转录聚合酶链反应(RTPCR)方法检测各组小鼠肝脏组织T-bet、GATA-3、ROR-γt和IL-17mRNA的表达水平。结果:T-betmRNA的表达水平在感染早期开始增高,1月时达高峰后又开始缓缓下降至感染前水平;GATA-3mRNA的表达水平在感染1月时明显升高,随后一直保持较高的表达水平;ROR-γtmRNA的表达水平在感染早期开始增高,感染1月时达到高峰,随后缓慢下降。IL-17mRNA表达水平自感染早期开始持续性增高,到感染3月时达高峰,之后又逐渐降低至感染前水平。各组小鼠肝组织ROR-γtmRNA表达水平与T-betmRNA表达水平呈正相关(r=0.67),IL-17mRNA表达水平与ROR-γtmRNA表达水平有相关性(r=0.35),P值均<0.05。结论:泡球蚴感染宿主早期,主要以Th1型和Th17型细胞免疫为主,感染中后期出现Th1向Th2转化,机体呈现出以Th2细胞为主的优势应答。
泡球蚴;IL-17;T-bet;GATA-3;ROR-γt;mRNA
泡型包虫病(Alveolarechinococcosis,AE)是由多房棘球绦虫(Echinococcusmultilocularis,Em)的幼虫寄生于人体引起的一种罕见的,可潜在致死的感染性疾病。未治疗患者可引起慢性肝侵蚀并伴随长期的无症状期,在此期间Em幼虫泡球蚴在肝内像肿瘤一样呈多泡性出芽方式浸润生长,十年内致死率高达95%[1]。以往的研究认为包虫免疫与Th1/Th2细胞失衡有关,近年发现Th17细胞亚群是一类不同于Th1和Th2的细胞亚群,产生IL-17等细胞因子。Th17细胞在防御胞外细菌感染、介导慢性炎症和自身免疫性疾病等过程中发挥重要作用[2]。但是Th17细胞是否参与泡球蚴感染,在泡球蚴寄生宿主的发生发展中起何种作用均未见报道。
目前发现T-bet和GATA-3分别是Th1和Th2细胞的特异性转录因子,维甲酸相关核孤儿受体γt(Retinoid-related orphan receptor gammat,RORγt)是调控Th17细胞分化的关键转录因子,诱导初始T细胞向Th17分化。本研究在建立泡球蚴感染小鼠模型的基础上,通过检测泡球蚴感染小鼠肝组织T-bet、GATA-3、ROR-γt和IL-17mRNA的表达水平的动态变化特点和它们之间的相关性,以探讨Th17细胞在感染小鼠Th1/Th2细胞失衡中的作用,并阐明这一新T细胞亚群及IL-17在包虫病发生中所起的作用。
1 材料与方法
1.1 实验动物 体重18~22克雌性BALB/c小鼠35只,由新疆医科大学实验动物中心提供。应用数字表法将动物随机分为7个组,每组5只,分别为感染前、感染2天、8天、1月、3月、6月和10月组。
1.2 主要试剂 Trizol;RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas公司,型号:#K1622);Taq酶(TaKaRa公司,型号:DR001BM)。
1.3 泡球蚴感染动物模型的建立及标本采集 将感染泡球蚴的保种灰仓鼠处死,取病灶组织,生理盐水清洗后,病灶组织剪碎,过筛,生理盐水漂洗3次,制成1×104个/m l原头蚴混悬液。酒精消毒下腹部皮肤,感染组注入0.2ml多房棘球绦虫原头蚴混悬液/只。小鼠分别于感染前、感染后2天、8天、1月、3月、6月、10月处死。标本取自病灶旁肝组织,立即置于液氮中冻存备用。
1.4 逆转录-聚合酶链反应(RT-PCR)检测各组小鼠肝组织T-bet、GATA-3、ROR-γt和 IL-17mRNA 的表达水平 采用Trizol试剂法提取各组小鼠肝组织总RNA,逆转录为互补脱氧核糖核酸(cDNA),以此为模板行PCR扩增,用琼脂糖凝胶电泳,比较T-bet、GATA-3、ROR-γt、IL-17 与 β-actin 的相对吸光度值并进行半定量分析。
目的基因引物序列:T-bet(PCR产物为280 bp)上游 引物:5′-GCCCGAACTACAGTCACGAACC-3′,下游引物:5′-CCCGCAGTCACCTGAGTCTTCT-3′,退火温度为57℃。GATA-3(PCR产物为100 bp)上游引物:5′-AAGAAAGGCATGAAGGACGC-3′,下游引物 :5′-GTGTGCCCATTTGGACATCA-3′,退火温度为57℃。ROR-γt(PCR产物为196 bp)上游引物:5′-GCAGCAACAGGAACAAGTGG-3′,下游引物 :5′-GCTTTGCCTCGTTCT GGACT-3′,退火温度为58℃。IL-17(PCR产物为232 bp)上游引物:5′-ACCGCAATGAAGACCCTGAT-3′,下游引物 :5′-ACACCCACCAGCATCTTCTC-3′,退火温度为57℃。β-actin(PCR 产物为218 bp)上游引物:5′-TGCTGTCCCTGTATGCCTCT-3′,下 游 引 物:5′-TGTCACGCACGATTTCCC-3′,退火温度为58℃。
1.5 统计学分析 采用SPSS17.0软件进行统计学处理,数据以±s表示,采用单因素方差分析和多重比较对各组进行比较分析,以P<0.05为显著性差异;相关性检验采用Pearson直线相关分析。
2 结果
2.1 泡球蚴感染小鼠大体观察结果 泡球蚴感染2天和8天的小鼠肝脏未见异常变化;1月时,肝脏小叶上出现直径约0.1cm透亮小囊泡;3月后剖检小鼠,肝小叶出现多处直径不等的小囊泡,不易与肝小叶分离,成簇聚集;6月后腹腔及肝脏中泡球蚴囊泡数量急剧增多,体积明显增大,与肝组织周围组织粘连;10月时肝脏肿大,被泡球蚴侵蚀,颜色灰红;感染前(未感染组)小鼠肝脏鲜红色。
2.2 泡球蚴感染小鼠肝脏病理学改变 感染组小鼠在泡球蚴感染的不同时期肝脏形态发生不同程度的变化,主要表现为:泡球蚴感染2天和8天后肝细胞排列整齐,未见明显异常改变;1月后出现炎性细胞浸润;3月后炎性细胞浸润进一步加重,并且出现胆管增生,肝细胞灶状坏死、水肿、脂肪变性、肝枯否细胞增生(图1A);6月可见泡球蚴纤维囊壁形成,囊壁周围成纤维细胞增生和炎细胞块状浸润,肝脏原有结构破坏,分不清小叶结构;10月泡球蚴囊壁和与其比邻的纤维结缔组织和炎细胞带明显可见,有时还可见肉芽肿结节,肝脏汇管区周围发生弥漫性纤维增生、纤维化,纤维组织将若干个肝细胞包绕(图1B)。
2.3 各组小鼠肝组织T-bet、GATA-3、ROR-γt和IL-17 mRNA表达水平 T-betmRNA的表达水平在感染早期开始增高,1月时达高峰后又开始缓缓下降至感染前水平。其中感染8天、1月、3月时与感染前、感染6月、感染10月的肝组织T-betmRNA表达水平相比差异均有统计学意义(P<0.05,见图2、3、表1);GATA-3mRNA的表达水平在感染1月时明显升高,随后一直保持较高的表达水平。其中感染1、3、6月与感染前、感染2天、感染10月肝组织GATA-3mRNA的表达水平相比差异均分别有统计学意义(P<0.01,见图 2、3、表 1);ROR-γtmRNA 的表达水平在感染早期开始增高,在感染1月时达到高峰,随后缓慢下降,感染10月时恢复到感染前的水平。ROR-γtmRNA的表达水平在感染8天、1月、3月时明显高于感染前、感染2天、6月和10月(P<0.05,见图2、3、表1);IL-17mRNA表达水平自感染早期开始持续性增高,到感染3月时达高峰,与其余各组相比显著增高(P<0.01),后又逐渐降低,感染10月也降至感染前水平,感染1月时与感染2天和感染10月相比也有差异(P<0.01,见图2、3、表1)。

图1 HE染色结果(×400)Fig.1 HE staining result of mouse liver in different time course(×400)

图2 各组小鼠肝组织 β-actin、GATA-3、T-bet、ROR-γt、IL-17 mRNA的表达Fig.2 The expression ofβ-actin,GATA-3,T-bet,ROR-γt,IL-17 mRNA in allgroups

图3 各组小鼠肝组织各基因mRNA表达水平的动态变化图Fig.3 The expression ofmRNA in allgroups

图4 T-bet与 ROR-γt的相关性Fig.4 The correlation between T-betand ROR-γt
表1 各组小鼠肝组织 T-bet、GATA-3、ROR-γt和IL-17 m RNA表达水平的比较(±s)Tab.1 The exp ression of T-bet,GATA-3,ROR-γt and IL-17mRNA in all groups(±s)

表1 各组小鼠肝组织 T-bet、GATA-3、ROR-γt和IL-17 m RNA表达水平的比较(±s)Tab.1 The exp ression of T-bet,GATA-3,ROR-γt and IL-17mRNA in all groups(±s)
Note:8 days p.i.,1month p.i.,3monthsp.i.,6months p.i.group vsbefore infection group,a:P<0.05;A:P<0.01;8 days p.i.,1month p.i.,3months p.i.,6monthsp.i.group vs 2 days p.i.group,d:P<0.05;D:P<0.01;8 days p.i.,1month p.i.,3months p.i.,6months p.i.group vs6months p.i.group,b:P<0.05;B:P<0.01;8 days p.i.,1month p.i.,3months p.i.,6months p.i.group vs10months p.i.group,c:P<0.05;C:P<0.01.
Groups GATA-3 T-bet ROR-γt IL-17 Before infection 1.327±0.173 0.864±0.111 1.505±0.108 0.775±0.097 2 d p.i. 1.292±0.125 1.203±0.095 1.665±0.078 1.084±0.143 8 d p.i. 1.391±0.128 1.271±0.123AbC 2.095±0.309ABCD 1.268±0.184 1m p.i. 1.78±0.100AcD 1.431±0.355ABC 2.383±0.081ABCD 1.503±0.107Cd 3m p.i. 1.808±0.130ACD 1.259±0.089abC 1.849±0.160ab 2.011±0.282ABCD 6m p.i. 1.698±0.084AD 0.911±0.114 1.474±0.094 1.234±0.355 10m p.i. 1.467±0.135 0.845±0.045 1.626±0.129 0.838±0.126
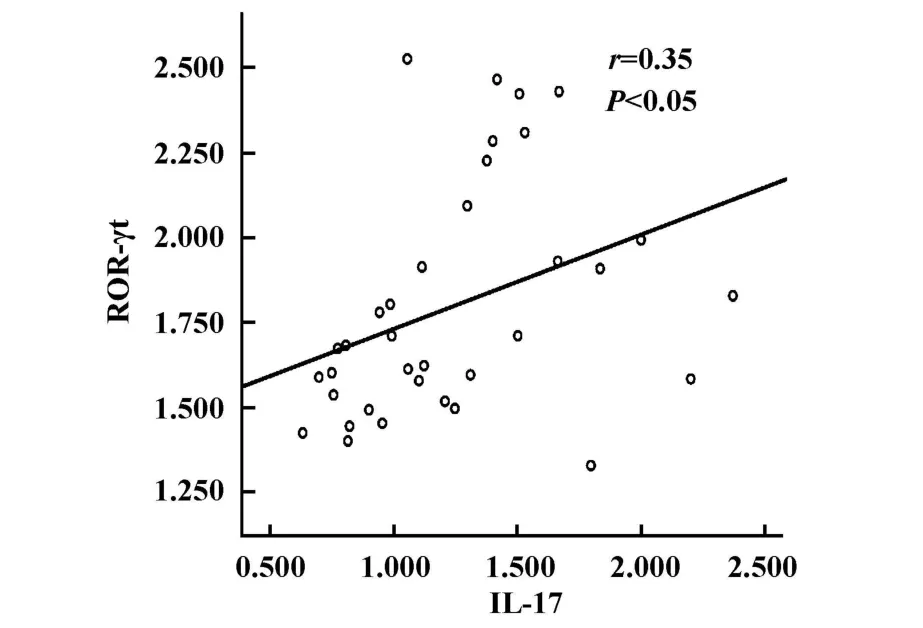
图5 IL-17与ROR-γt的相关性Fig.5 The correlation between IL-17 and ROR-γt
2.4 相关性分析 各组小鼠肝组织ROR-γtmRNA表达水平与T-betmRNA表达水平呈正相关(r=0.67,P<0.05),IL-17 mRNA表达水平与 ROR-γt mRNA表达水平有相关性(r=0.35,P<0.05,见图4和5)。
3 讨论
根据CD4+T细胞分化和功能特征,将其分为Th1、Th2和Th17等[3]。Th1型细胞通过分泌干扰素γ(IFN-γ)等细胞因子介导细胞免疫,在抗细胞内感染的细菌、病毒等方面发挥生物作用;Th2型细胞通过分泌IL-4等细胞因子,激活B细胞产生免疫球蛋白介导体液免疫,在抗寄生虫等感染中发挥调节作用[4,5]。初始T 细胞(naïve T cell,Tn)在IL-12刺激下表达转录因子T-bet,分化为Th1细胞;在IL-4刺激下则表达转录因子GATA-3,分化为Th2细胞。不同抗原诱导T-bet或GATA-3的表达强弱的差异,促进Tn分别向Th1或Th2型细胞分化,引起不同类型的免疫应答[6-8]。
Am ri[9]、Al-Qaoud[10]和 Bayraktar[11]等研究发现Th1细胞及其分泌的细胞因子在细粒棘球蚴感染免疫中对机体起到保护作用,Th2细胞分泌的细胞因子对Th1细胞有抑制作用,使保护性免疫应答受损,Th2细胞占主导地位有利于棘球蚴等寄生虫在体内存活。
本研究结果显示,T-betmRNA的表达水平在感染早期开始增高,1月达高峰后又开始缓缓下降。感染8天、1月、3月时与感染前、感染6月、感染10月时肝组织T-betmRNA的表达水平相比差异均有统计学意义(P<0.05)。而GATA-3 mRNA的表达水平在感染1月时明显升高,随后一直保持较高的表达水平,其中感染1、3、6月与感染前、感染 2天、感染10月GATA-3mRNA的表达水平相比差异均有统计学意义(P<0.01)。这表明感染早期,幼虫可能促进了转录因子T-bet表达,有利于Tn分化为Th1细胞,后者在宿主清除多房棘球绦虫原头蚴上起到了一定的作用。到感染中晚期GATA-3 mRNA的表达水平逐渐升高,Tn细胞逐渐向Th2细胞分化偏移,Th2细胞占优势地位,泡球蚴出现免疫逃避后在体内生长迅速,本研究从转录水平对小鼠泡球蚴感染后免疫细胞变化特点进行分析,这与魏晓丽等[12]从细胞因子水平研究的结果一致。
Th17细胞作为一个独立的新亚群,在自身分化、发育和维持等方面有独特的表现。如同T-bet控制Th1的分化和GATA-3控制Th2的分化一样,Th17的分化同样受到其转录因子RORγT的控制[13]。本研究显示ROR-γtmRNA的表达水平在感染早期开始增高,在感染1月时达到高峰,随后缓慢下降,到感染10月时恢复到感染前的水平。ROR-γtmRNA的表达水平在感染8天、1月、3月时明显升高,推测在泡球蚴感染宿主时,感染1月时即感染早期Th17细胞与Th1细胞共同参与抗寄生虫免疫,从各基因mRNA表达水平动态变化图上可以看出Th17细胞的转录因子RORγT的表达水平较T-bet高,可能提示Th17细胞在泡球蚴入侵宿主早期就快速作出反应,它可能也积极参与清除病原体。感染1月后,Th1细胞和Th17细胞的转录因子mRNA表达水平开始缓慢下降,GATA-3的表达水平却上升,出现了向Th2方向极化,泡球蚴逐渐出现免疫逃避,宿主的免疫下调,使感染转为慢性化进程。
IL-17是Th17细胞分泌的主要细胞因子,可以诱导炎症细胞因子IL-6、急性反应蛋白、粒-巨细胞刺激因子(G-CSF)和前列腺素E2等表达[14]。IL-17还可以同炎症因子TNF-α等有协同作用,放大加强其致炎效应[15,16]。本研究中IL-17mRNA表达水平自感染早期开始持续性增高,平均高于感染前(P<0.05),到感染3月时达高峰,与各组相比均显著增高(P<0.01),后又逐渐降低。表明感染早中期IL-17增高,可能通过招募中性粒细胞到达感染部位,在清除病原体中起到了一定作用。感染3月后IL-17仍维持较高水平,而此时宿主肝脏损害逐渐加重,出现炎性细胞大量浸润、肝细胞灶状坏死、水肿、脂肪变性和肝枯否细胞增生等一系列反应,IL-17可能参与了这一反应,其具体作用机制值得进一步研究。
McGeady[17]和Martin等[18]研究表明Th17细胞和Th1细胞在发育上密切相关。本研究显示,感染小鼠肝组织RORγTmRNA和T-betmRNA表达水平呈正相关关系(r=0.67),RORγTmRNA与GATA-3 mRNA的表达水平无相关性,IL-17 mRNA表达水平与ROR-γtmRNA表达水平呈正相关(r=0.35),推测小鼠感染泡球蚴早期,虫体抗原激活Th17和Th1细胞的转录因子,促使更多的初始T细胞向这两个细胞方向分化,活化后的Th17细胞又可以分泌更多IL-17,产生一系列生物效应,发挥抗感染免疫和免疫病理损伤的双重作用。
泡球蚴感染所致的包虫病是一种慢性的、多种细胞及细胞因子参与并相互调节、以肝脏损伤为主的免疫性疾病。本研究从转录因子水平对泡球蚴感染小鼠肝脏中Th1、Th2和Th17细胞的动态变化特点进行研究,结果提示泡球蚴感染宿主早期Th1和Th17细胞可能同时占主导地位,Th1和Th17细胞分泌大量IFN-γ和IL-17等细胞因子可能起到抗感染免疫的作用;随着虫体负荷的增加,泡球蚴逐渐出现免疫逃避,感染的中后期出现Th1向Th2转化,机体呈现出以Th2细胞为主的优势应答。同时伴有Th17细胞分泌的细胞因子优势分泌,可能加重免疫病理损伤,有利于泡球蚴在体内的生长,加速感染的慢性化进程。本研究将进一步开展棘球蚴感染的中晚期Th17细胞的表型和功能改变,探讨Th17在宿主抵抗棘球蚴感染免疫机制,为临床包虫病的治疗提供新线索和途径。
1 温 浩,徐明谦.实用包虫病学[M].北京:科学出版社,2007:15-19.
2 Gaffen S L.An overview of IL-17 function and signaling[J].Cytokine,2008;43(3):402-407.
3 Castellino F,Germain R N.Cooperation between CD4+and CD8+T cells:when,where,and how[J].Annu Rev Immunol,2006;24(1):519-554.
4 Park H,Li Z,Yang XOetal.A distinct lineage of CD4+T cells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005;6(11):1133-1141.
5 Harrington LE,Hatton R D,Mangan P Retal.Interleukin 17-producing CD4+effector T cellsdevelop via a lineagedistinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005;6(11):1123-1132.
6 Yu Q,Sharma A,Oh SYetal.T cell factor 1 initiates the T helper type 2 fate by inducing the transcription factorGATA-3 and repressing interferon-gamma[J].Nat Immunol,2009;10(9):992-999.
7 Bae H,Park N,Kim Yetal.Themodulative effectofCyperi Rhizomaon Th1/Th2 lineage development[J].Cell,2010;51(3):259-265.
8 Hewitt S L,High F A,Reiner S Letal.Nuc lear repositioningmarks the selective exclusion of lineage-inappropriate transcription factor loci during T helper cell differentiation[J].Eur J Immunol,2004;34(12):3604-3613.
9 AmriM,Mezioug D,Touil-Boukoffa C.Involvement of IL-10 and IL-4 in evasion strategies of Echinococcus granulosus to host immune response[J].Eur CytokineNetw,2009;20(2):63-68.
10 Al-Qaoud KM,Abdel-Hafez SK.The induction of T helper type 1 responseby cytokine gene transfection protectsm ice against secondary hydatidosis[J].Parasitol Res,2008;102(6):1151-1155.
11 Bayraktar M R,Mehmet N,Durmaz R.Th1 and Th2 inducing cytokines in Cystic echinococcosis[J].Turkiye Parazitol Derg,2005;29(3):167-170.
12 魏晓丽,丁剑冰,许 晏etal.小鼠感染泡球蚴后细胞因子水平的变化[J].中国寄生虫学与寄生虫病杂志,2004;22(6):361-364.
13 Ivanov I I,McKenzie B S,Zhou Letal.The orphan nuclear receptor ROR gamma t directs the differentiation program of proinflammatory IL-17+T helper cells[J].Cell,2006;126(6):1121-1133.
14 Harrington LE,Mangan PR,Weaver C T.Expanding the effector CD4 T-cell repertoire:the Th17 lineage[J].Curr Opin Immunol,2006;18(3):349-356.
15 McAllister FA,Henry J L,Kreindler PJetal.Role of IL-17A,IL-17F,and the IL-17 receptor in regulating growth-related oncogene-alpha and granulocyte colony-stimulating factor in bronchial epithelium:implications for airway inflammation in cystic fibrosis[J].JImmunol,2005;175(1):404-412.
16 Komiyama Y S,Nakae T,Matsuki Aetal.IL-17 playsan important role in the development of experimental autoimmune encephalomyelitis[J].J Immunol,2006;177(1):566-573.
17 M c Geady M J,CuaD J.Th17 celldifferentination:the long andwinding road[J].Immunity,2008;28(4):445-453.
18 Martin-Orozco N,ChungY,Chang SHetal.Th17 cells promotepancreatic inflammation but only induce diabetes efficiently in lymphopenic hostsafter conversion into Th1 cells[J].Eur J Immunol,2009;39(1):216-224.
[收稿2010-11-21 修回2010-12-13]
(编辑 张晓舟)
The dynam ic observation of liver T-bet,GATA-3,ROR-γtand IL-17mRNA expression in BALB/cmice infected with Echinococcusmultilocularis
PANGNan-Nan,DINGJian-Bing,ZHAOHui,WANGJing,LIBo,LIYu-Jiao,JIANGTao,MAXiu-Min.MedicalResearchCenterandXinjiangKeyLabofEchinococcosis,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China
Objective:To study the changesof T-bet,GATA-3,STAT-3,ROR-γtand IL-17m RNA levels in BALB/cmice infectedwithEchinococcusmultilocularisin order to explore the relationship between Th17 and Th1/Th2 cell.Methods:BALB/c micewere infected by intraperitoneal injection of ametacestode suspension.After 2 days,8 days,1month,3months,6months and 10months,themouse liver samples were collected.The course of the infectionwas followed for 10months in all.The level of T-bet,GATA-3,ROR-γtand IL-17 mRNA were detectedwith RT-PCR.Results:The levelof T-betmRNA expression increased atearly stageof infection,it reached a peak after 1month past-infection(p.i.)and decreased slow ly.High level ofGATA-3mRNA expressionwas detected after1month,whichwasmaintained athigh expression level.The levelof ROR-γtmRNA expression also increased at the early stageof infection.The levelof IL-17mRNA expression continuously increased atearly time,then reached a peak after3months p.i.and then deceased slow ly.The expression of ROR-γtmRNA had positive correlation with T-betmRNA(r=0.67),and theexpression of IL-17mRNA had positive correlationwith ROR-γtmRNA(r=0.35,P<0.05).Conclusion:At theearly stageof infection,Th1 and Th17 cell-mediated inflammatory responses are importantmechanism of the host in defending against themetacestodes,and Th2 antibody-mediated immunity is important in the late stage of infection.
Echinococcusmultilocularis;IL-17;T-bet;GATA-3;ROR-γt;mRNA
R392.11
A
1000-484X(2011)05-0395-05
10.3969/j.issn.1000-484X.2011.05.003
①本文为国家自然科学基金(30960358、30860263、81060135、30901374、30560146)和研究生创新基金(MC2010-2)共同资助
②新疆医科大学基础医学院,乌鲁木齐830011
③新疆医科大学附属中医医院,乌鲁木齐830000
庞楠楠(1984年-),女,在读硕士,主要从事感染免疫学方面的研究;
及指导教师:马秀敏(1968年-),女,博士,教授,硕士生导师,主要从事分子病毒及免疫学方面的研究,E-mail:maxiumin1210@163.com。

