Sphk-1在人脑胶质瘤中表达的研究
李 强,许海洋,佟 倩,张显峰*,于洪泉,姜云鹏,张永海
(1.吉林大学第一医院 神经外科,吉林 长春 130021;2.吉林大学第一医院心血管内科,吉林 长春 130021;3.吉林大学病理解剖学教研室,吉林 长春 130021)
恶性胶质瘤是一种高侵袭性,低生存率的颅内肿瘤,但对于其诊断治疗手段仍然未取得有效进展。由于肿瘤细胞增殖、转移、血管生成及侵袭性都是脂质介导的信号事件。所以近年来,脂肪生成/脂质代谢在恶性肿瘤研究中已经引起越来越多的学者的关注。磷酸鞘氨醇激酶-1(SphK-1)作为一种脂质酶,而S1P作为其催化底物,与人类多种癌症存在着必然的联系。国外研究表明:SphK-1具有强有力的致瘤性和促血管生成作用,在多种癌细胞中SphK-1 mRNA的表达皆被上调。本文采取免疫组化法检测SphK-1在正常脑组织和人脑胶质瘤细胞中的阳性表达率,探讨其与胶质瘤恶性程度的关系及作为治疗靶点的可行性。
1 材料与方法
1.1 材料 兔抗人Sphk1抗体(浓缩型),由上海晶天生物有限公司提供;免疫组化试剂盒,由福州迈新有限公司提供;本实验所使用的10例脑出血患者正常脑组织及人脑胶质瘤石蜡组织标本62例收集于吉林大学第一医院神经外科2008年9月-2010年4月外科手术中。其中原发55例,复发 7例;男性 35例,女性27例;年龄10-72岁,平均40.50岁。参照2000年WHO神经系统肿瘤分类、分级标准,低级别胶质瘤(Low grade glioma,LGG,Ⅰ、Ⅱ级)28例,其中包括:星形细胞瘤12例,混合少突星形细胞瘤13例,室管膜瘤3例;高级别胶质瘤(High grade glioma,HGG,Ⅲ、Ⅳ级)34例,其中包括:间变性星形细胞瘤11例,间变性少突星形细胞瘤9例,间变性室管膜瘤2例;星形细胞里Ⅳ级4例,少突星形细胞瘤Ⅳ级3例,胶质母细胞瘤5例。术前均未接受放疗或化疗。
1.2 方法
1.2.1 应用免疫组织化学方法对此10例正常脑组织及62例人脑胶质瘤进行一系列的石蜡包埋及染色,然后应用SphK-1抗体进行染色,在高倍显微镜下观察。
1.2.2 结果分析 免疫组化结果判断标准如下[1]:SphK-1蛋白染色阳性表现为细胞浆内出现棕褐色颗粒。在400倍视野下,随机选择10个视野,计数100个细胞,分别计算阳性细胞数及其表达率。根据阳性细胞率及染色强度按下述标准分级:①阴性(-),随机视野中阳性细胞数小于10%;②弱阳性(+),胞浆内均匀分布浅棕褐色反应,阳性细胞数10%-25%;③中等阳性(++),深棕褐色反应,阳性细胞数25%-50%;④强阳性(+++),棕黑色反应,胞浆内呈粗大颗粒或块状着色,阳性细胞数>50%。
1.2.3 统计分析 根据数据采集的不同方法及统计学处理的不同要求,选用χ2检验及spearman相关系数检验,使用统计软件SPSS 10.0对所有数据进行统计学处理。
2 结果
2.1 Sphk-1的染色结果 正常脑组织及21例胶质瘤细胞中未检测到Sphk-1的表达,41例肿瘤组织中可见细胞质染色阳性,为棕褐色颗粒。见图1、图2。

图1 胶质瘤Ⅰ-Ⅱ级的病理结果(40×10)
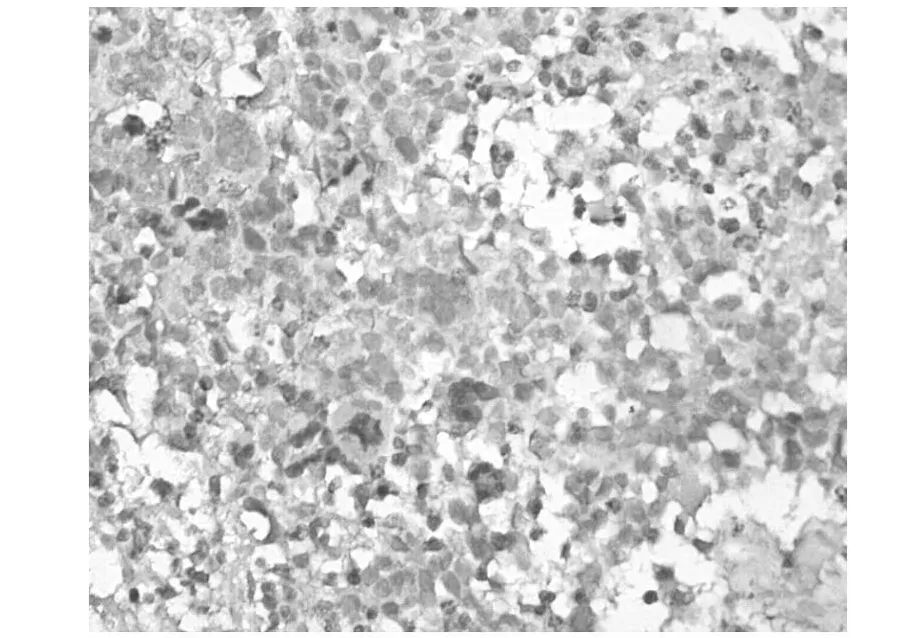
图2 胶质母细胞瘤的病理结果(40×10)
2.2 免疫组化染色结果 本组Sphk-1在胶质瘤中的总阳性表达率为66.1%。胶质瘤与正常脑组织之间,各组间两两比较,应用 χ2检验,差异均有显著性(P<0.01),通过spearman相关系数检验,r=0.748,P<0.01,表明SphK-1与人脑胶质瘤的分级存在相关性。Sphk-1蛋白的表达水平与胶质瘤病理级别具有相关性。随着胶质瘤级别的升高,Sphk-1蛋白表达明显增高。见表1。

表1 SphK-1在人脑正常脑组织及胶质瘤中的表达
3 讨论
胶质细胞瘤为神经上皮性肿瘤,约占颅内肿瘤的45%,根据肿瘤细胞的分化情况可分为:髓母细胞瘤、星形细胞瘤、少枝胶质细胞瘤、多形性胶质母细胞瘤和室管膜瘤,髓母细胞瘤[2]。恶性胶质细胞瘤进展快,导致其患者的愈后效果较差,相关报道认为:对胶质瘤的治疗多年来仍然没有重大进展,其一年生存率仅为30%,并且其总的生存时间不超过53周。即使应用外科手术、放化疗等多种治疗手段效果仍不明显。如此低的生存率很大程度上与胶质瘤的高侵蚀性有密切关系[3]。
众所周知,肿瘤的发生、发展、侵袭与细胞周期失调控、细胞异常增殖相关。最近的研究表明,脂肪生成/脂质代谢在癌症研究中已经引学者的广泛关注。首先,脂质是细胞膜的重要组成部分。其次,癌细胞的增长迅速,需要消耗大量的能量。再次,参与恶性肿瘤进展的重要的生物过程(如:细胞增殖、转移、血管生成等)都是脂质介导的信号事件[4]。而磷酸鞘氨醇激酶-1(SphK)作为一种脂质酶,与其催化底物S1P,与人类多种癌症有着着必然的联系。研究还发现,在人体多种恶性肿瘤中SphK-1mRNA的表达皆被上调[5]。
鞘氨醇激酶-1(sphingosine kinase 1,SphK-1)是一种与细胞生命活动密切相关的鞘氨醇代谢酶[6],在体内发挥着广泛的生物学功能。作为体内重要的脂质之一,鞘氨醇(sphingosine)可由SphK-1催化成为促生长因子1-磷酸鞘氨醇(S1P),也可由神经酰胺合成酶催化生成促凋亡因子-神经酰胺(ceramide),S1P/ceramide的平衡是决定细胞生存或凋亡的重要因素,而SphK-1是调节这一平衡的关键酶。SphK-1表达增加不仅导致S1P水平升高,改变S1P/ceramide的平衡,从而对抗细胞凋亡,还能增加细胞周期由G1期向S期转化的速率,进而促进细胞生长。同时S1P还发挥着第二信使的作用[7]。国外动物实验研究表明[8]:SphK-1的缺失将使细胞周期停滞,增加促凋亡蛋白Bax在线粒体膜上的积聚,激活细胞凋亡的胞内途径,从而促使细胞凋亡。
国内外大量研究表明[9]:SphK-1在乳腺癌、结肠癌及胃癌等体内多种恶性肿瘤中表达显著增加。而对于其在颅内肿瘤中表达的研究却较少,Nicholas Young[10]等在研究中发现SphK-1在胶质母细胞瘤中显著表达,进而刺激其肿瘤细胞的转移及侵袭。DongHoon Lee等[11]、中山大学的Li Jun等[12]在对大鼠的研究中发现SphK-1在星形细胞瘤中表达显著,并且随恶性程度的增加而表达增强。但就SphK-1在各型胶质瘤中的表达的研究却没有。在本次试验中我们就SphK-1在多种胶质细胞瘤中的表达进行研究。我们发现SphK-1蛋白的表达主要位于细胞浆内,其在胶质瘤中的阳性表达率明显高于正常脑组织,应用spearman相关系数检验,P<0.01,提示SphK-1表达增强与胶质瘤的发生发展有关。SphK-1在低级别胶质瘤与高级别胶质瘤的表达有显著差异性(P<0.05),同时在本次实验中,我们根据病理分级把肿瘤标本分为三组,比较各级别胶质瘤中SphK-1的表达后发现差异存在显著性(P<0.05)。可见SphK-1的表达随肿瘤恶性程度的升高而增强,推测SphK-1可能参与了胶质瘤的恶性进展。因此,抑制SphK-1的生成可能减缓肿瘤的侵袭及转移。
根据本实验结果及结合相关文献报道,我们认为在胶质瘤中SphK-1可促进肿瘤的生长及侵袭,增加肿瘤的恶性程度,进而降低肿瘤的愈后效果,至于其具体机制尚有待进一步研究。同时我们考虑针对SphK-1应用基因技术或抗体免疫反应在不久的将来可能为胶质瘤的治疗提供新的策略。
[1]Korshunov A,Golanov A,Tim irgaz V,et al.Immuno-histochemicalmarkers for intracranialependymoma recurrence.An analysis of 88 cases[J].J Neurol Sci,2000,177(1):72.
[2]王忠诚,神经外科学[M].第1版.武汉:湖北科学技术出版社,2005:541-554.
[3]Jun Li,Hong-Yu Guan,et al.ClinicalSignificance of Sphingosine Kinase-1Expression in Human Astrocytomas Progression and Overall PatientSurvival[J].Clin Cancer Res,2008,14(21):6996.
[4]Menendez JA,Lupu R,et al.Fatty acid synthase and the lipogenic phenotype in cancerpathogenesis[J].Nat Rev Cancer,2007,7(10):763.
[5]Van Brocklyn JR,Jackson CA,Pearl DK,et al.Sphingosine kinase-1 expression correlateswith poor survival of patientswith glioblastomamultiforme:rolesof sphingosinekinase isoforms in growth of glioblastoma cell lines[J].JNeuropatholExp Neurol,2005;64(8):695.
[6]Rosen H,Goetzl EJ.Sphingosine1-phosphate and its receptors:an autocrine and paracrine network[J].Nat Rev Immunol,2005,5(7):560.
[7]Olivera A,Kohama T,EdsallL,et al.Sphingosine kinase expression increases intracellular sphingosine-1-phosphateand promotes cellgrowth and survival[J].JCell Biol,1999,147(3):545.
[8]Taha TA,Kitatani K,El-A lwaniM,et al.Loss of sphingosine kiNase-1 activates the intrinsic pathway of programmed cell death:modulation of sphingolipid levels and the induction of apoptosis[J].FASEBJ,2006,20(3):482.
[10]Lauren Bryan,Barbara S,Paugh,et al.Sphingosine-1-phosphate and interleukin 1 independently regulate PAI-1 and uPAR expression in glioblastoma cells;implications for invasiveness[J].Mol Cancer Res,2008,6(9):1469.
[11]Dong Hoon Lee,Byeong Tak Jeon,Eun Ae Jeong,et al.A ltered expression of sphingosine kinase 1 and sphingosine-1-phosphate receptor 1 in mousehippocampusafterkainic acid treatment[J].Biochem ical and Biophysical Research Communications,2010,393(3):476.
[12]Jun Li,Hong-Yu Guan.Li-Yun Gong,et al.ClinicalSignificance ofSphingosine Kinase-1 Expression in Human Astrocytomas Progression and Overall PatientSurvival[J].Clin Cancer Res,2008,14(21):6996.

