晚期氧化蛋白产物模拟表位的初步研究
侯晓睿,刘北一*,田建伟,陈益国,富 宁
(1.南方医科大学 免疫学教研室,广东 广州 510515;2.南方医科大学南方医院肾内科,广东 广州 510515)
晚期氧化蛋白产物(advanced oxidation protein products,AOPP)是体内氧化应激(oxidative stress)过程中次氯酸(HOCl)修饰的蛋白产物,在血浆中以HOCl氧化修饰白蛋白为主,目前认为AOPP是一类含双酪氨酸的蛋白质交联物[1]。循环AOPP水平增高见于慢性肾脏病及伴透析过程[1]、糖尿病[2]、动脉粥样硬化[3]、溃疡性结肠炎[4]等免疫相关炎症性疾病和恶性肿瘤(结肠、直肠癌、乳腺癌等)[5]等,因此被认为是反映体内氧化应激的敏感指标[1]。目前AOPP在体内作用机制尚不十分清楚,且其抗原结构及表位性质不明。我们在前期制备针对AOPP抗体过程中发现,AOPP免疫原性弱、易于诱导IgM类抗体生成,提示AOPP在结构上存在特殊性。此外,所获得抗体还可识别由HOCl修饰、来自于不同种属动物的白蛋白及人低密度脂蛋白(low density-lipoprotein,LDL),但与上述蛋白的非氧化及天然形式无任何交叉反应,提示在体内HOCl氧化修饰蛋白具有共同表位。本文利用抗AOPP多抗筛选噬菌体肽库,获得并初步探讨所得表位的结构特点,并试图了解AOPP模拟表位是否存在于正常人与哺乳动物的蛋白分子上,是否与AOPP在体内的生物学活性有关联。
1 材料与方法
1.1 材料 人血清白蛋白(HSA)购自Sigma公司,抗AOPP多克隆抗体[6]由本实验室制备。噬菌体随机12肽库(Ph.D.-12TMPhage Display Peptide Library Kit)购自New England Biolabs公司。肽库滴度为2×1013pfu/ml,受体菌为大肠杆菌E.coli ER2738。辣根过氧化物酶标记的抗M 13抗体购自GE Healthcare公司。
1.2 方法
1.2.1 AOPP-HSA的制备 依据Witko-Sarsat等[1]建立的方法制备AOPP-HSA。将HSA与次氯酸以1∶140摩尔比混合,室温反应30min后立即置于PBS中4℃透析24 h,以去除游离的次氯酸。AOPP含量以氯胺-T法标定[1],AOPP-HSA中AOPP含量为75.33 nmol/mg蛋白,未经修饰HSA中AOPP含量仅为0.16 nmol/mg蛋白。
1.2.2 抗AOPP多克隆抗体对噬菌体12肽库的筛选 经亲和层析纯化的多克隆抗体[6]以100μg/ml包被酶标板,5%BSA封闭2 h,0.1%TBS-Tween(TBST)洗板5次,加入 45μl 0.1%TBST和5μl噬菌体12肽库,室温孵育1 h;洗板10次后0.2M G ly-HCl洗脱结合的噬菌体,室温8min,1M Tris-HCl进行中和。以此噬菌体侵染宿主菌ER2738,测定滴度、扩增纯化后,用于下一轮筛选。第2、3轮筛选除将洗液改为0.5%TBST以外,其余实验条件均与第1轮相同。在完成3轮筛选后,测定噬菌体滴度并随机挑取蓝色噬斑制备噬菌体原种用于鉴定。
1.2.3 夹心ELISA鉴定噬菌体克隆与抗AOPP多抗的结合 抗AOPP多抗(以正常兔IgG为对照)5 μg/m l,50μl/孔,4℃包被过夜,0.25%酪蛋白封闭液37℃2 h;依次加入 50μl/孔噬菌体和M13KE载体、HRP-抗M 13单抗(应用时 1∶5 000稀释),37℃30 min,TMB显色,2M硫酸终止。以OD 450 nm值高于阴性对照3倍以上的为阳性结果。
1.2.4 DNA序列分析 扩增阳性噬菌体克隆,按常规方法纯化并提取噬菌体单链DNA。样品送交北京华大有限公司测序。
1.2.5 竞争ELISA鉴定阳性噬菌体克隆的特异性2.5μg/ml抗AOPP 多抗50μl/孔,4℃包被过夜,封闭后同时加入阳性噬菌体克隆上清与不同浓度AOPPHSA或HSA,37℃1 h;洗板后加入HRP-抗M13单抗37℃30min,常规TMB显色,并计算抑制率。
1.2.6 ELISA鉴定阳性噬菌体与抗AOPP单抗mAb 3F2、mAb 4C5的结合 抗 AOPP的单克隆抗体3F2[7]和4C5、多克隆抗体及兔 IgG各5μg/ml,50 μl/孔包被,封闭后加入阳性噬菌体克隆No.6、No.1各 50μl/孔,37℃30min,随后加入 HRP-抗M 13单抗,常规TMB显色。
1.2.7 保守序列同源性搜索 采用NCBI数据库(http://www.ncbi.nlm.nih.gov/blast)的 BLASTp程序在蛋白质水平上对六条筛选序列分别进行同源性搜索,并用哈佛大学在线抗原性预测软件(http://bio.dfci.harvard.edu/Tools/antigenic.html)与DNAstar对阳性序列进行了抗原表位预测。
2 结果
2.1 噬菌体十二肽库筛选的亲和富集 以抗AOPP多克隆抗体(PcAbs)为靶分子,对噬菌体十二肽库进行3轮筛选,表1显示回收率逐轮增加。

表1 PcAb筛选噬菌体随机12肽库
2.2 噬菌体克隆与PcAbs的结合 随机挑选29个噬菌体克隆进行鉴定,结果显示其中18个克隆能与PcAbs特异性结合,阳性率为62.07%(见图 1);上述克隆均不与正常兔IgG及仅缓冲液包被孔反应,排除了非特异结合与吸板序列存在的可能性。
2.3 阳性噬菌体克隆DNA序列及推导的氨基酸序列 选择18个阳性克隆中的6个进行DNA测序并推导其氨基酸序列,得到3种序列,其保守序列为LXDMLXD(见表2)。

表2 阳性噬菌体克隆的氨基酸序列
2.4 AOPP-HSA抑制阳性噬菌体克隆与多抗结合
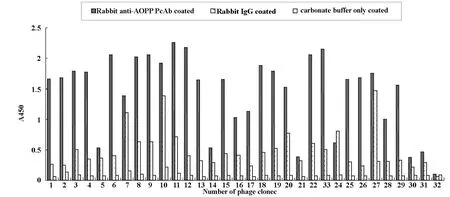
No.1-No.29:phage clones;No.30:unrelated phage;No.31:12mer phage library;No.32:blank control图1 噬菌体与抗AOPP多克隆抗体的结合
为进一步鉴定噬菌体展示肽序列可模拟AOPP,以AOPP抑制阳性噬菌体克隆No.6与抗体的结合。结果显示极低浓度AOPP即可有效抑制No.6(滴度为0.7×1013pfu/m l)与多抗结合,其IC50为0.2μg/m l(图2);而阴性对照HSA则无抑制作用。提示该克隆所展示短肽的抗原性与AOPP表位极为相似,即为良好的抗原模拟位短肽。

图2 AOPP竞争抑制阳性噬菌体克隆与多抗的结合
2.5 阳性噬菌体克隆可与两株抗AOPP单抗3F2和4C5结合 采用夹心ELISA方法检测阳性克隆(No.1、6)展示序列特异性。结果显示具不同序列的阳性克隆与抗AOPP单抗3F2和4C5结合,其中含保守序列的克隆No.6与单抗结合较No.1克隆明显,但均不及与多抗的结合强(见图3)。该结果提示两株单抗与筛选用多抗识别AOPP聚合分子表面不同的表位。
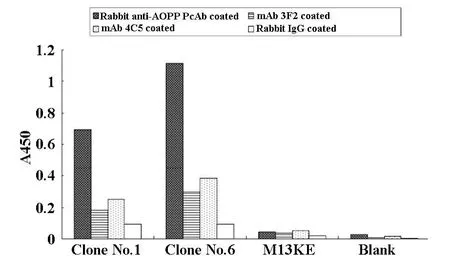
图3 阳性噬菌体与AOPP单抗3F2、4C5的结合
2.6 AOPP模拟肽保守序列同源性搜索 经从NCBI数据库进行同源搜索,发现所获得的三种序列仅存在于某些真菌属、藻类的蛋白分子上,而并不存在于正常的人类与哺乳动物蛋白分子中,从而避免了与AOPP表位相似而导致的后续事件,也由此支持AOPP并非人体与动物的正常蛋白。
3 讨论
近年来,AOPP作为氧化应激过程的重要生物标志物日益受到重视。我们前期工作证明抗AOPP抗体可识别HOCl氧化修饰的不同种属白蛋白,而不与其天然形式反应,提示AOPP结构中抗原表位为非种属特异性,因此探讨AOPP表位结构特性尤为必要。而揭示AOPP表位结构特点及其可能的分布无疑有利于深入研究该分子在体内的病理生理学作用。我们所采用的模拟肽策略则是想探索类似AOPP表位是否存在于正常蛋白分子,如果存在是否发挥相应的作用。噬菌体表面展示技术是一种将外源蛋白与噬菌体衣壳蛋白融合展示在噬菌体表面的生物技术。该技术广泛应用于抗原表位分析、蛋白质相互作用等[8]。我们以抗AOPP多克隆抗体来筛选噬菌体随机12肽库获得了18株可与多抗结合的阳性克隆。人工制备AOPP-HSA可显著抑制No.6阳性噬菌体克隆与多抗结合(IC50=0.2 ug/ml),提示所筛选的克隆高度模拟AOPP表位的抗原性。氨基酸序列分析得到了相对保守的序列LXDMLXD,X为任意氨基酸(表2)。由此推断,如果人或动物体内正常蛋白表达此序列,就很可能产生一定程度类似于AOPP的生物学效应。所幸通过对数据库的同源性搜索,发现该序列仅存在于一些真菌藻类的蛋白分子中,而不存在于正常人与哺乳动物的天然蛋白分子,即不会引起类似于AOPP所诱发的反应。由此也从另一个角度证明AOPP并非人体或哺乳动物的正常蛋白成份。
以往文献多通过动力学、质谱等方法研究HOCl氧化修饰对蛋白质残基影响,已明确HOCl在氧化过程中最先改变氨基酸侧链,不同氨基酸与HOCl反应速度不同,其氧化修饰后产物也不同,如蛋氨酸的氧化产物为蛋氨酸亚砜。其次HOCl与蛋白质酰胺基团骨架反应是一种慢反应,可导致蛋白肽键断裂;此外HOCl氧化后促使蛋白聚集、交联同时伴随二酪氨酸形成[9]。Fu X等通过构建合成肽库证明WG基序是氯化主要靶点[10]。Kawakami A.等利用质谱证实在HOCl氧化修饰HSA中主要形成二硫键(Cys34)[11]。而我们的工作着重探讨AOPP表位免疫原性的结构特殊性。在本研究中所获得(保守序列LXDMLXD)AOPP模拟表位与上述文献无相关性;利用哈佛大学在线抗原性预测软件与DNAstar对阳性序列进行了抗原表位预测,提示包含保守残基的氨基酸序列LFDH/LQDLA可能是高抗原性区域。综上本研究中所获得的阳性序列可能为AOPP抗原表位,对于这种表位的生物学特性还需经合成短肽后进一步鉴定。
[1]W itko-SarsatV,FriedlanderM,Capeillere-Blandin C,et al.Advanced oxidation protein productsasanovelmarker of oxidative stress in uremia[J].Kidney Int,1996,49(5):1304.
[2]Piwowar A,Knapik-KordeckaM,WarwasM.Markers of oxidative protein damage in plasma and urine of type 2 diabetic patients.[J]Br JBiomed Sci.2009;66(4):194.
[3]Cakatay U,KayaliR,Uzun H.Relation of plasma protein oxidation parametersand paraoxonase activity in the ageing population.Clin Exp Med,2008,8(1):51.
[4]BaskolM,BaskolG,Kocer D et al.Advanced oxidation protein products:a novelmarker of oxidative stress in ulcerative colitis.[J].JClin Gastroenterol,2008;42(6):687.
[5]Chandramathi S,Suresh K,Anita ZB et al.Comarative assessment of urinary oxidative indices in breast and colorectal cancer patients[J].JCancer Res Clin Oncol,2009,135(2):319.
[6]卢 晓,田建伟,刘北一,等.针对晚期氧化蛋白产物的抗体制备与应用[J].中国免疫学杂志,2010,26(2):164.
[7]Liu BY,Hou XR,Zhou QG et al.Detection of advanced oxidation protein products in patientswith chronic kidney diseaseby anovelmonoclonalantibody.Free Radic Res,2011.
[8]Scott JK,Sm ith GP.Searching for peptide ligandswith an epitope library[J].Science,1990,249:386.
[9]Hawkins CL,Pattison DI,DaviesMJ.Hypochlorite-induced oxidation of am ino acids,peptidesand proteins[J].Amino Acids,2003,25:259.
[10]Fu X,Wang Y,Kao J.et al.Specific sequencemotifsdirect theoxygenation and chlorination of tryptophan by myeloperoxidase.[J].Biochemistry,2006,45(12):3961.
[11]Kawakam iA.,Kubota K.,YamadaN.etal.Identification and characterization ofoxidized human serum albumin.A slight structural change impairs its ligand-binding and antioxidant functions.[J].FEBS J.2006,273:3346.

