舒尼替尼治疗早产儿视网膜病变动物模型的研究△
吴 宁 黄敏丽
早产儿视网膜病变(retinopathy of prematurity,ROP)以往称为晶状体后纤维增生症,是早产低出生体质量儿视网膜毛细血管发育异常的疾病,表现为视网膜缺血、新生血管形成和增生性视网膜病变,轻则引起近视、弱视、斜视,重则引起视网膜脱离导致永久性失明[1]。近年来,随着医学技术的提高,存活的早产儿人数显著增加,ROP的发生率也逐年上升,已成为世界范围内儿童致盲的主要原因。临床上对此疾病缺乏有效的治疗方法,虽少部分病例可通过激光治疗,但激光治疗具有破坏性,可造成视野损害。对于新生血管的增殖,部分病例可通过手术解除,但视功能损害已不可逆转[2]。因此,怎样控制视网膜新生血管的增殖,寻找更加方便、有效的治疗方法,仍是目前亟待解决的问题。本研究建立高氧诱导的ROP动物模型,玻璃体内注射不同剂量的舒尼替尼(Sunitinib),从形态学、细胞学和基因学3个层面来观察Sunitinib对视网膜新生血管的抑制作用,为ROP的治疗提供新线索和新思路。
1 材料与方法
1.1 实验材料 市售大小为50 cm×40 cm×40 cm半透明无毒硬塑料整理箱;数字测氧仪(梅城电化分析仪器厂,CY-12C);微量进样器(上海安亭微量进样器厂);Sunitinib(辉瑞公司);ADP酶(美国Amresco公司);Trizol Reagent(Invitrogen公司);cDNA逆转录试剂盒、PCR试剂盒、DNA Marker(TIANGEN公司);VEGFR2引物、内参β-actin引物(上海生工生物工程技术服务有限公司);医用氧气(广西医科大学第一附属医院)。
1.2 方法
1.2.1 实验动物及其分组 鼠龄7 d的健康Wistar鼠仔108只(广西医科大学动物实验中心提供),系清洁级动物,性别不限,与哺乳母鼠共同饲养,称体质量并统一编号后随机分为6组,每组18只:A组为空气对照组,B组为高氧对照组,C组为高氧PBS组,D组为高氧+5 μg舒尼替尼组,E组为高氧+25 μg舒尼替尼组,F组为高氧+125 μg舒尼替尼组。后4组于高氧环境饲养5 d后分别右眼玻璃体内注射等体积(5 μL)0.1 mol·L-1PBS溶液、含舒尼替尼5 μg的PBS溶液、含舒尼替尼25 μg的PBS溶液、含舒尼替尼125 μg的PBS溶液,左眼为自身对照。给药后在正常环境中继续饲养5 d。高氧对照组只做高氧处理。
1.2.2 ROP模型的建立 将鼠龄7 d的Wistar鼠仔及其母鼠置于密闭的氧气箱内,接体积分数100%湿润医用氧气,调节氧气流量(0.50~0.75)L· min-1,每天3次(9 am、3 pm、7 pm)用测氧仪监测出气管中的氧浓度,使其保持在体积分数(80±2)%;温度保持在22~25℃,湿度(50~70)%。每天将母鼠放回正常氧环境中休息12 h,防止大鼠肺损伤死亡;2 d更换一次箱内垫料、饲料,开箱时间约15 min。在此环境中饲养5 d后,从氧箱中取出,在常氧环境中饲养5 d,到指定时间处死取标本。空气对照组一直处于正常氧环境中饲养,其余条件不变。
1.2.3 视网膜铺片方法 A、B组分别于鼠龄12 d、14 d、17 d各取2只以及C、D、E、F组分别于鼠龄17 d各取6只做视网膜铺片。在各个指定时间,体积分数10%水合氯醛腹腔麻醉鼠,伸展四肢仰卧位固定于自制手术台上,用4℃生理盐水和4℃ 40 g·L-1多聚甲醛溶液(pH 7.2)心腔灌注处死,摘出眼球置于40 g·L-1多聚甲醛溶液固定,4℃过夜。去除眼前节,由视盘向四周放射状将眼杯平分成4份,分离出视网膜置于40 g·L-1多聚甲醛溶液中固定,4℃过夜。ADP酶染色:用0.05 mol·L-1tris-马来酸缓冲液(pH 7.2)漂洗视网膜15 min×5次,加入ADP酶染色反应液(pH 7.2的0.2 mol·L-1tris-马来酸缓冲液、硝酸铅3 mmol·L-1、氯化镁6 mmol·L-1、ADP 1 g·L-1)37℃水浴中孵育15 min,再用0.05 mol·L-1tris-马来酸缓冲液(pH 7.2)漂洗15 min× 5次,用100 g·L-1硫化铵反应1 min显色,最后用0.05 mol·L-1tris-马来酸缓冲液(pH 7.2)漂洗15 min×5次后视网膜铺片,中性树胶封片。显微镜下观察结果、拍照。
1.2.4 视网膜病理切片 6组鼠仔于鼠龄17 d各6只颈椎脱臼处死,摘除眼球并编号。将眼球置于40 g· L-1多聚甲醛固定液中,4℃固定48 h后常规脱水,石蜡包埋,分别于平行角膜至视盘矢状位的3个平面连续切片,贴片,厚度4~6 μm,每个平面间隔75 μm,每只眼球选取18张切片(去掉有视神经的切面)用于检查。每组各随机抽取20张苏木精-伊红(HE)染色切片,在显微镜下计数突破视网膜内界膜的血管内皮细胞核数目,并计算出每组的平均数及标准差,计数时仅计数与内界膜有联系的血管内皮细胞核。
1.2.5 RT-PCR
1.2.5.1 取材 A、B组分别于鼠龄12 d、14 d、17 d各取2只以及C、D、E、F组分别于鼠龄17 d各取6只行RT-PCR检测VEGFR2 mRNA的表达。在各个指定时间,颈椎脱臼处死并摘除眼球,在冰上解剖显微镜下剥离视网膜。
1.2.5.2 总RNA的提取及鉴定 将相同实验条件下的2只视网膜置于1.5 mL EP管中,为一个标本。采用Trizol一步法提取组织总RNA。200 g·L-1琼脂糖凝胶电泳鉴定 RNA质量,紫外分光光度仪(DU640型,Beckman)测定RNA含量。所得RNA置-80℃保存备用。
1.2.5.3 RT-PCR 目的基因引物根据Gene bank中种属的VEGFR2基因序列设计:VEGFR2(sense): 5’-TGTGAACGCTTGCCTTATGAT-3’,VEGFR2(antisense):5’-GCTCTGACTGCTGGTGATGCT-3’;β-actin (sense):5’-GGAGATTACTGCCCTGGCTCCTA-3’,βactin(anti-sense):5’-GACTCATCGTACTCCTGCTTGCTG-3’。cDNA的合成及PCR扩增均按试剂盒说明书操作。PCR扩增产物于200 g·L-1琼脂糖凝胶电泳,图像分析仪照相和分析结果,以VEGFR2与βactin的PCR产物灰度值比值作为VEGFR2 mRNA的相对含量。上述实验重复6次。
2 结果
2.1 视网膜铺片血管形态观察 A组鼠龄12 d视网膜血管由中央视盘发出,向四周放射状均匀分布,管径粗直,周边血管结构清晰,见少量无灌注区(图1A),14 d无灌注区消失,血管形态基本正常(图1B),17 d血管形态全部正常(图1C)。B组鼠龄12 d视网膜血管收缩变细,走行僵直,视网膜中央部可见大片无灌注区(图1D),14 d大血管开始扩张迂曲,仍见大片无灌注区(图1E),17 d大量新生血管网形成(图1F),深浅两层血管结构模糊不清。C组与B组17 d结果基本相似(图1G)。D组大血管仍可见迂曲,新生血管稍减少,深浅两层血管结构仍模糊(图1H)。E组大血管迂曲现象明显好转,新生血管减少,深浅两层血管结构较清楚(图1I)。F组新生血管明显减少,深浅两层血管结构基本正常(图1J)。
2.2 视网膜病理切片结果
2.2.1 视网膜病理切片HE染色结果 A组:内界膜结构均一,血管内皮细胞排列整齐,偶见血管内皮细胞突破内界膜(图2A)。B组:可见大量血管内皮细胞团突破内界膜,形成新生血管腔(图2B)。C组与B组结果基本相似(图2C)。D组:可见突破内界膜血管内皮细胞稍减少,仍有新生血管腔形成(图2D)。E组:可见突破内界膜的血管内皮细胞明显减少,形成或未形成新生血管腔(图2E)。F组:内界膜结构基本均一,少量血管内皮细胞突破内界膜,形成或未形成新生血管腔(图2F)。
2.2.2 突破视网膜内界膜血管内皮细胞核计数结果 A组突破视网膜内界膜血管内皮细胞核计数为:2.650±0.875,B组为31.450±0.686,C组为31.600±0.681,D组为 26.450±1.099,E组为21.250±1.070,F组为12.550±0.999,A组与B组之间差异有统计学意义(P<0.05),B与C 2组间差异无统计学意义(P>0.05),C、D、E、F各组间比较差异均有统计学意义(均为P<0.05)。
2.3 RT-PCR检测视网膜组织中VEGFR2 mRNA的表达结果
2.3.1 视网膜组织总RNA鉴定 总RNA样品经琼脂糖凝胶电泳之后,28 S、18 S、5 S 3条带在紫外灯下清晰可见,且28 S条带的亮度是18 S的2倍。紫外分光光度计比色测定显示,所有 RNA样品OD260/OD280均>1.8。

Figure 1 A-F stood for the retina stretched preparation ADPase staining of the air control group and high oxygen control group at 12 days,14 days,17 days,respectively;G-J stood for the retina stretched preparation ADPase staining of the high oxygen+PBS group,high oxygen+5 μg Sunitinib group,high oxygen+25 μg Sunitinib group and high oxygen+125 μg Sunitinib group at 17 days,respectively A-F分别代表空气对照组和高氧对照组于鼠龄12 d、14 d、17 d视网膜铺片ADP酶染色结果;G-J分别代表高氧+PBS组、高氧+5 μg舒尼替尼组、高氧+25 μg舒尼替尼组、高氧+125 μg舒尼替尼组于鼠龄17 d视网膜铺片ADP酶染色结果
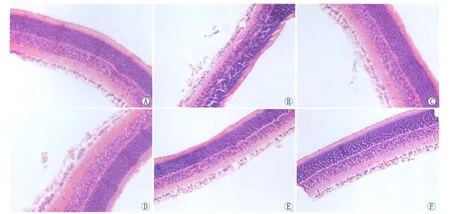
Figure 2 A-F stood for the retina stained with HE of group A to F at 17 days,respectively A-F分别代表A-F组鼠龄17d视网膜HE染色结果
2.3.2 VEGFR2 mRNA表达相对含量的结果分析A组鼠龄12 d、14 d、17d时VEGFR2 mRNA表达量一直处于较低的水平;B组鼠龄12 d时VEGFR2 mRNA表达量较A组12 d明显降低,而14 d、17 d时其表达量比A组同时间点明显增加。A-F组鼠龄17 d时VEGFR2 mRNA表达的具体结果见表1,由表1可以看出:A、B组17 d时VEGFR2 mRNA表达差异有统计学意义(P<0.05)。C、B组17 d时VEGFR2 mRNA表达差异无统计学意义(P>0.05);D、E、F组17 d时较C组VEGFR2-mRNA表达量降低,且随着Sunitinib剂量的增加降低的效果逐渐明显,17时C、D、E、F各组间差异均有统计学意义(均为P<0.05)。

表1 各组VEGFR2 mRNA表达含量Table 1 Expression of VEGFR2 mRNA in each group (x¯±s)
3 讨论
ROP的发病基础是视网膜血管发育不完全,ROP的基本特征为新生血管形成和增生性视网膜病变。但ROP的发病机制至今仍未明确,目前很多研究表明ROP的产生与“相对缺氧”有关,持续高浓度氧抑制VEGF的表达,致使早产儿未发育成熟的视网膜血管收缩、闭塞,当脱离高氧环境,视网膜组织继发处于相对低氧状态,又刺激VEGF表达增加,导致视网膜大量新生血管形成[2]。国内外大量研究表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前已知作用最强的促血管生成因子之一,是刺激新生血管形成的最重要的因素,是血管生成的先决条件和基础[3]。但VEGF是通过与血管内皮生长因子受体(vascualr endothelial grwoth factor receptors,VEGFR)结合才发挥生物学效应作用的[4]。当前已发现的VEGFR包括fms样酪氨酸激酶(fms-like tyrosine kinase,flt-1)即VEGFR-1、VEGFR-2、VEGFR-3(flt-4)。此外还有一些相关受体,如神经纤维蛋白(neuropilin-1,2,NRP-1、2)等[5]。其中VEGFR-2为酪氨酸激酶受体,属于膜受体类,仅存在于血管内皮细胞膜上,是介导VEGF发挥促有丝分裂、趋化性和血管侵润作用的主要激酶受体[6-8]。近年来一系列下调或阻断VEGF或其受体的药物和抑制二者结合发挥生物学效应的药物已成为治疗ROP等视网膜新生血管性疾病研究的热点之一。
根据ROP的国际分类法(ICROP)[9]和临床多中心研究(cRYo-ROP)[10],目前ROP的治疗以手术治疗为主,药物治疗为辅,常用的冷凝、激光光凝、巩膜环扎术及玻璃体切割术等虽能有效的控制ROP病变的发展,保留患者残存的视力,但手术治疗的并发症较多,甚至会改变眼部的正常结构。2009年召开的“第2届国际早产儿视网膜病变(ROP)会议”提出目前应用最广、疗效突出的是抗VEGF药物贝伐单抗(Avastin),但对活动性增生性伴附加病变的16眼注射0.6 mg Avastin发现黄斑裂孔、血管变细和肝功能异常等并发症,且研究表明对于3期ROP尤其合并其他系统并发症时,单用玻璃体内注射Avastin虽比激光治疗复发更慢、更晚,但不能完全阻止疾病复发,仍需联合激光治疗[11]。因此,寻找一种疗效更好、安全性更高的新药具有重要意义。苹果酸舒尼替尼(Sunitinib malate,SU11248,Sutent)是一种多靶点小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可靶向抑制VEGF-R1、VEGF-R2、VEGFR3和PDGF受体等酪氨酸激酶的活性,通过特异性阻断这些信号转导途径达到抗血管生成和抗肿瘤增生的活性[12]。VEGFR在正常组织中表达甚微,在病理条件下表达显著增加[4],故而以VEGFR为靶点的Sunitinib具有特异性高、不易产生耐受性、毒性小的等优点。目前国内外关于Sunitinib的研究大多局限于抗肿瘤领域,Sunitinib已经成为抗肿瘤的一线药物,但在眼科抗视网膜新生血管方面的研究甚少。侯培等[13]研究已经证实了Sunitinib能够抑制体外培养的视网膜微血管内皮细胞增殖和迁移,这可能是其抑制血管生成的途径之一,但Sunitinib在体内是否亦对视网膜新生血管有抑制作用,且抑制作用是否呈剂量依赖性仍是值得探讨的问题。
鉴于此,本实验选择不同剂量的Sunitinib作用于ROP动物模型,采用ADP酶视网膜铺片观察视网膜血管形态、视网膜组织病理切片计数突破视网膜内界膜血管内皮细胞核数及RT-PCR检测视网膜组织VEGF-R2 mRNA表达的方法,从形态学、细胞学和基因学3个层面来研究Sunitinib对视网膜新生血管的影响。本研究ADP酶视网膜铺片结果显示,持续高氧视网膜血管收缩闭塞,相对缺氧视网膜血管迂曲扩张且生成大量新生血管,玻璃体腔内注射不同剂量的Sunitinib后视网膜新生血管不同程度减少,且减少的程度随剂量增加而明显。视网膜组织病理切片计数突破视网膜内界膜血管内皮细胞核的结果显示,Sunitinib能够明显减少突破视网膜内界膜血管内皮细胞核的数目,而且这种抑制作用具有明显的剂量依赖性。RT-PCR检测视网膜组织VEGF-R2 mRNA表达的结果显示,持续高氧抑制VEGF-R2 mRNA的表达,相对缺氧又刺激VEGF-R2 mRNA的表达,且Sunitinib能够明显降低VEGF-R2 mRNA的表达,其抑制作用同样具有明显的剂量依赖性。本研究3种实验方法技术成熟,在国内外广泛应用,3种方法所得结论一致,均证实Sunitinib能够抑制视网膜新生血管的生成,且其抑制作用具有明显的剂量依赖性。与目前研究的同类药物相比,从有效性和安全性总体评价,Sunitinib具有明显优势。Sunitinib很可能会成为治疗ROP等视网膜新生血管性疾病的一种潜在药物,但其最佳治疗剂量以及临床应用价值需要更多更广泛的实验来确立。
1 张惠蓉.眼微循环及其相关疾病[M].北京医科大学、中国协和医科大学联合出版社,1993:140-144.
2 Caldwell RB,Bartoli M,Behzadian MA,El-Remessy AE,Al-Shabrawey M,Platt DH,et al.Vascular endothelial growth factor and diabetic retinopathy:role of oxidative stress[J].Curr Drug Targets,2005,6(4):511-524.
3 Ferrara N,Davis-Smyth T.The biology of vascular endothelial growth factor[J].Endocr Rev,1997,18(1):4-25.
4 Neufeld G,Cohen T,Gengnnovitch S,Poltorak Z.Vascular endothelial growth factor(VEGF)and its receptors[J].FASEB J,1999,13(1):9-22.
5 Katoh O,Tauchi H,Kawaishi K,Kimura A,Satow Y.Expression of the vascular endothelial growth factor(VEGF)receptor gene,KDR,in hematopoietic cell and inhibitory effect of VEGF on apoptotic cell death caused by ionizing radiation[J].Cancer Res,1995,55(23):5687-5692.
6 Kanno S,Oda N,Abe M,Terai Y,Ito M,Shitara K,et al.Roles of two VEGF receptors,Flt-l and KDR,in the signal transduction of VEGF effects in human vascular endothelial cells[J].Oncogene,2000,19(17):2138-2146.
7 Rahimi N,Dayanir V,Lashkari K.Receptor chimeras indicate that the vascular endothelial growth factor receptor-1(VEGFR-1)modulates mitogenic activity of VEGFR-2 in endothelial cells[J].J Biol Chem,2000,275(22):16986-16992.
8 Gille H,Kowalski J,Li B,LeCouter J,Moffat B,Zioncheck TF,et al.Analysis of biological effects and signaling properties of Flt-1 (VEGFR-1)and KDR(VEGFR-2).A reassessment using novel receptor-specific vascular endothelial growth factor mutants[J].J Biol Chem,2001,276(13):3222-3230.
9 An international classification of retinopathy of prematurity.Prepared by an international committee[J].Br J Ophthalmol,1984,68(10):690-697.
10 Cryotherapy for Retinopathy of Prematurity Cooperative Group.Multicenter trial of cryotherapy for retinopathy of prematurity.Preliminary results[J].Arch Ophthalmol,1988,106(4):471-479.
11王雨生,李 蓉.早产儿视网膜病变研究现状与趋势——第2届国际早产儿视网膜病变会议[J].国际眼科纵览,2010,34(1):1-5.
12 Mendle DB,Laird AD,Xin X,Louie SG,Christensen JG,Li CG,et al.In vivo antitumor activity of SU11248,a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors:determination of a pharmacokinetic/pharmacodynamic relationship[J].Clin Cancer Res,2003,9(1):327-337.
13侯 培,黄敏丽.Sunitinib对视网膜微血管内皮细胞增殖和迁移的影响[J].眼科新进展,2010,30(6):508-511.

