人类β防御素在角膜组织中的表达△
辜臻晟 盛耀华 祝肇荣 周建珍 陆上麟
抗微生物肽(antimicrobial peptides,AMP)是存在于植物、无脊椎动物和脊椎动物中的小片段阳离子多肽,表现出抗细菌、真菌、分枝杆菌、酵母菌和包被病毒等微生物的活性,是一类存在于哺乳动物的中性粒细胞及各种上皮细胞中的先天性免疫效应分子。通过参与细胞信号转导以及对未成熟的树突状细胞和T细胞的趋化作用起到先天性免疫和适应性免疫的作用。眼表作为眼球暴露于外周的部位,易受各种病原体的侵袭,造成感染,严重影响视功能。研究发现,防御素可能对眼表组织起着重要的保护作用[1]。
防御素是一种天然产生的相对分子质量为2 000~6 000的阳离子多肽,是AMP的重要组成部分,具有广谱抗微生物活性。防御素分为α、β、θ 3种亚型,而人类β防御素(human β defensins,HBD)共有6种亚型,主要定位于多种组织的表皮或上皮。HBD-1、HBD-2和HBD-3是HBD的3种主要亚型,分别由36、41和45个氨基酸构成。目前,这些防御素在眼表组织的表达及对疾病的作用机制尚不十分清楚。本研究旨在寻找角膜组织中存在 HBD-1、HBD-2、HBD-3的证据,检测产生这些防御素的细胞,探究HBD在眼表疾病中的作用。
1 材料与方法
1.1 角膜组织样本的制备 角膜组织取材于角膜移植术和眼球摘除术等的病变组织及供体眼的正常组织,共30眼。炎症性样本包含病毒性角膜炎6眼、真菌性角膜炎4眼和细菌性角膜炎5眼;正常人角膜样本15眼。分别从炎症性样本和正常组织随机选取14眼角膜样本,采用免疫组织化学法检测HBD-1和HBD-2的蛋白表达。其中炎症性角膜样本7眼,分别是病毒性角膜炎3眼、真菌性角膜炎2眼及角膜穿孔伤后角膜细菌感染眼球摘除者2眼。由复旦大学附属眼耳鼻喉科医院眼库提供正常人角膜样本7眼。角膜组织取下后均用体积分数1%中性福尔马林缓冲液固定。
选取其余16眼角膜样本,采用逆转录聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)检测HBD-1、HBD-2、HBD-3的mRNA表达,其中炎性角膜8眼,分别是病毒性角膜炎3眼、真菌性角膜炎2眼和细菌性角膜炎3眼。正常角膜样本8眼同样来源于复旦大学附属眼耳鼻喉科医院眼库提供的正常人眼球。角膜组织取下后存放于灭菌冻存管,在-196℃液氮中深低温保存。
1.2 实验方法与步骤
1.2.1 免疫组织化学检测 取出中性福尔马林固定的组织样本,水漂洗后擦巾纸包裹放于自动脱水机中脱水浸蜡。浸蜡后的组织块石蜡包埋,4℃冷藏,用切片机将样本切成3~4 μm薄片。进行HE染色后,选择带有上皮细胞的切片样品进行试验。60℃烤片1 h。石蜡切片脱蜡入水,体积分数0.3% H2O2室温孵育5~10 min,消除内源性过氧化物酶活性,蒸馏水漂洗。切片入EDTA-Tris修复液(pH 8.0),微波高温(80~100℃)修复15 min,用水浸泡冷却。切片入蒸馏水、Tris-Hcl(0.05 mol·L-1,pH 7.4)漂洗。滴入一抗10~20 μL浸没组织切片。分别为0.2 g·L-1兔抗HBD-1单克隆抗体(美国Phoenix Pharmaceuticals公司),按1∶100稀释后使用;山羊抗HBD-2单克隆抗体(100 μg)粉剂(美国R&D公司),用抗体稀释液0.5 mL稀释成0.2 g·L-1,原液使用。放于4℃冰箱孵育48 h。Tris-Hcl(0.05 mol· L-1,pH 7.4)洗去一抗,滴入二抗。分别为0.3 g·L-1辣根过氧化物酶标记山羊抗兔IgG抗体(美国Proteintech Group公司)和0.3 g·L-1辣根过氧化物酶标记驴抗山羊IgG抗体(美国Proteintech Group公司),按1∶50稀释后滴入 10~20 μL,室温下(25℃)反应2 h。Tris-Hcl(0.05 mol·L-1,pH 7.4)洗去二抗。3,3’-二甲基联苯胺(上海长岛试剂公司)显色10~20 min,蒸馏水洗去显色剂,苏木素复染,脱水,二甲苯Ⅰ、Ⅱ透明,封片,光镜检查并摄片。每个样本均按上述方法重复检测3次。
1.2.2 RT-PCR检测
1.2.2.1 抽提mRNA 取液氮冻存的组织放于匀浆器中,加入1 mL Trizol(美国Invitrogen公司)使细胞碎解,冰上研磨,室温静置5 min。加0.2 mL三氯甲烷(氯仿),混匀,静置分层。分为上层RNA,中间DNA和蛋白质,下层为氯仿。离心取上清液加0.5 mL异丙醇(使RNA沉淀析出),Vortex振荡,室温静置,离心弃上清液。加入1 mL体积分数7.5%乙醇(DEPC处理),Vortex振荡,经离心后小心弃去上清液。在空气中干燥5~10 min,每管加入10 μL DEPC水,手指弹匀,室温离心15 s,溶解RNA呈透明,放入冰中。
1.2.2.2 逆转录反应 以抽提的mRNA为模板,逆转录获取cDNA,反应体系为25 μL。RNA 10 μL(约2 μg)和Oligo 182 μL(0.5 g·L-1;日本Takara公司),68℃水浴5 min,0℃反应5 min后,加入5×MMLV buffer缓冲液(mRNA逆转录缓冲液;日本Toyobo公司)5 μL、2.5 mmol·L-1dNTP 6 μL、RNA酶抑制剂(日本Takara公司)1 μL和M-MLVRT(RNA逆转录酶;200 U·L-1;日本Toyobo公司)1 μL,加去离子水补足至25 μL。37℃水浴1 h,95℃水浴3 min结束反应,-20℃冷冻保存反应产物。
1.2.2.3 PCR扩增相关序列 每一反应样品分3组,以转录的cDNA为模板,分别加入HBD-1、HBD-2和HBD-3的相关上、下游引物进行扩增反应,各组以不加cDNA模板作为阴性对照。另外一组以加入βactin上、下游引物扩增β-actin序列作为内部参照(阳性对照)。
1.2.2.4 DNA扩增序列鉴定 将序列扩增后的各组样品加入含溴化乙锭(1∶1 500)的1.5 g·L-1琼脂糖凝胶中电泳跑胶,以DL-2000作为分子标记,进行分子大小鉴定。紫外光下观察跑胶条带,Tanon 2500紫外凝胶图像分析系统拍照成像。
1.2.2.5 引物设计 上海生工生物工程公司合成HBD-1(NM_005218):上游5’-AGATGGCCTCAGGTGGTAACTTT-3’,下游5’-CACTTGGCCTTCCCTCTGTAAC-3’,长度:148 bp。HBD-2(Z71389):上游5’-TACCTGCCTTAAGAGTGGAG-3’,下游5’-CTTTTTGCAGCATTTTGTTC-3’,长度:103 bp。HBD-3(AJ23 7673):上游5’-TTTGCTTTGCTCTTCCTGTTTTTG-3’,下游5’-GCCACGCGTCGAGCACTTG-3’,长度:156 bp。β-actin:上游5’-AACGAGCGGTTCCGATGCCCTGAG-3’,下游5’-TGTCGCCTTCACCGTTCCAGTT-3’,长度:590 bp。每个样本均按上述方法重复检测3次。
1.3 统计学分析 采用SAS 6.12统计学软件对数据进行统计学处理,应用四格表卡方检验计算P值,分别比较2组间各型HBD的表达差异。P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学法检测 14眼角膜组织样本的石蜡切片先与初级抗体抗HBD-1和HBD-2的单克隆抗体反应,然后再与标记有辣根过氧化物酶的次级抗体反应,所形成的抗原-抗体复合物可在相应的细胞胞浆内沉着,阳性者光镜下可见浸润细胞内出现棕黄色颗粒。6眼炎性角膜可见HBD-1和HBD-2阳性颗粒;这些颗粒主要集中于角膜上皮的基底细胞,基质则是零星表达。炎性角膜样本的上皮组织中散在分布染色成棕黄色颗粒(箭头)的细胞,是标记有辣根过氧化物酶的次级抗原抗体反应形成的复合物在相应细胞胞浆内沉着所致。染色阳性细胞在上皮基底层中居多(图1-图2)。然而,1眼霉菌性角膜炎样本中,角膜上皮大量破坏缺失,只有部分上皮表达HBD-1,而未见HBD-2阳性颗粒表达。来源于供体眼的7眼正常角膜样本中,均有HBD-1阳性棕色颗粒在上皮层表达,同样以基底层为主;正常角膜除1眼上皮内有HBD-2阳性颗粒表达外,其他样本均无HBD-2的表达。
正常角膜样本的上皮组织出现标记有辣根过氧化物酶的次级抗原抗体复合物,沉着于相应的细胞胞浆内,染色阳性细胞(箭头)光镜下可见棕黄色颗粒。阳性颗粒主要集中在基底细胞层,呈散在分布(图3)。
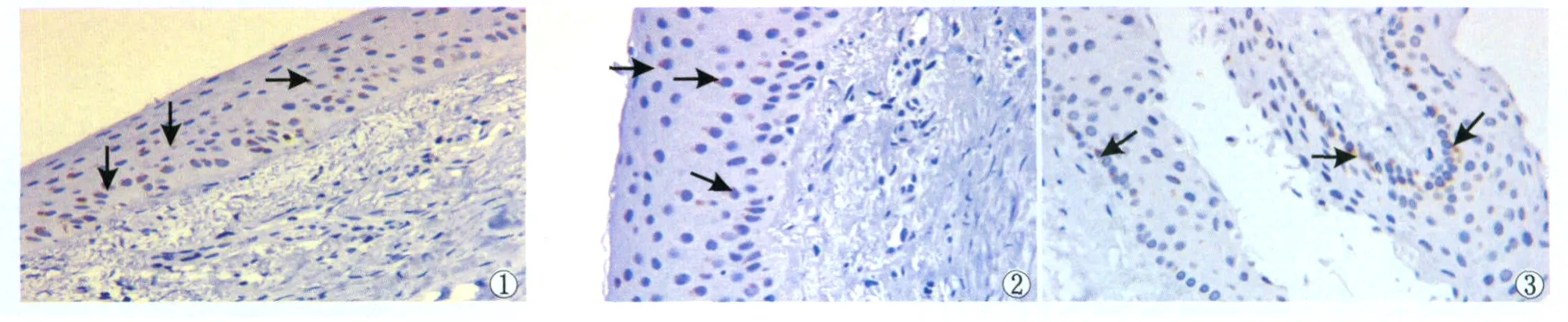
Figure 1 Cornea obtained from herpes simplex keratitis patient(basal and superficial epithelium):HBD-1 tested by immunohistochemical method (×200).Figure 2 Cornea obtained from herpes simplex keratitis patient(basal and superficial epithelium):HBD-2 tested by immunohistochemical method(×200).Figure 3 Normal cornea(basal and superficial epithelium):HBD-1 tested by immunohistochemical method(×200) 图1 单纯疱疹病毒性角膜炎角膜(基底细胞层与表层上皮):HBD-1免疫组织化学检测(×200)。图2 单纯疱疹病毒性角膜炎角膜(基底细胞层与表层上皮):HBD-2免疫组织化学检测(×200)。图3 正常角膜(基底细胞层与表层上皮):HBD-1免疫组织化学检测(×200)
炎性角膜组与正常角膜组HBD-2表达差异有显著统计学意义(χ2=7.413,P=0.029),而2组间HBD-1表达差异无统计学意义(P>0.05)。
2.2 RT-PCR检测 16眼角膜组织样本抽提mRNA,逆转录获得cDNA,加入相应的上、下游引物,扩增相关序列。反应产物以含溴化乙锭的1.5 g·L-1琼脂糖凝胶电泳进行鉴定,以Marker DL-2000作为分子标记,在紫外光下观察结果。HBD-1的扩增序列为148 bp,其电泳条带位于Marker DL-2000的100 bp和250 bp条带中间,16眼样本均显示有该条带的表达(图4)。HBD-2的扩增序列为103 bp,其电泳条带接近于Marker DL-2000的100 bp条带。16眼样本中,炎性角膜组除1眼霉菌性角膜炎样本表达阴性外,其余样本均有该条带表达;正常角膜组各角膜样本均表达阴性(图5)。HBD-3的扩增序列为156 bp,其电泳条带同样位于Marker DL-2000的100 bp和250 bp条带中间,16眼样本也均显示该条带的表达(图6)。作为内部参照的β-actin的扩增序列为590 bp,其电泳条带位于Marker DL-2000的500 bp和750 bp条带之间,16眼样本均显示有该条带的表达(图7),表明通过这一方法有足够的cDNA产生,上述实验结果真实可靠。
炎性角膜组与正常角膜组HBD-2阳性条带表达率比较,差异有统计学意义(χ2=12.444,P= 0.001 4)。然而,2组间HBD-1和HBD-3阳性条带表达率比较,差异均无统计学意义(均为P>0.05)。

Figure 4 Expression of HBD-1(148 bp)in normal and inflammatory cornea by RT-PCR.DL-2000:Marker;N:Normal control;1:Bacterial cornea;2:Viral cornea;3:Normal cornea RT-PCR检测正常和炎性角膜组织中HBD-1(148 bp)的表达。DL-2000:分子标记;N:阴性对照(无模板);1:脓性角膜(细菌性);2:炎性角膜(病毒性);3:正常角膜
3 讨论
RT-PCR检测发现,HBD-1和HBD-3在所有被检角膜组织中均为阳性表达。但是,HBD-2只在某些被检组织中表达阳性,而且炎性角膜组织和正常角膜组织之间存在明显的表达差异。免疫组织化学分析显示了类似的结果。免疫组织化学法检测表明,炎性角膜组织和正常角膜组织同样存在明显的HBD-2表达差异。以往的研究报道,HBD主要产生于各类组织的上皮细胞[2],因此,在免疫组织化学分析时,剔除了HE染色显示上皮组织缺失的样本,以免出现假阴性结果。免疫组织化学分析提示了产生β防御素的确切细胞来源,虽然HBD抗体反应产物在眼表组织的基质和上皮均有分布,但主要局限于上皮细胞层,且阳性表达集中于上皮细胞的基底细胞层。这一结果预示HBD主要由角膜组织上皮细胞产生。基底细胞位于上皮层的最底层,胞浆内含有丰富的细胞器,蛋白合成和有丝分裂活跃,是上皮细胞的分裂中心。这也符合我们以上述实验结果定位β防御素来源的判断。

Figure 5 Expression of HBD-2(103 bp)in normal and inflammatory corneal tissues by RT-PCR.DL-2000:Marker;N:Normal control;1:Bacterial cornea;2:Viral cornea;3:Normal cornea RT-PCR检测正常和炎性角膜组织中HBD-2(103 bp)的表达。DL-2000:分子标记;N:阴性对照(无模板);1:脓性角膜(细菌性);2:炎性角膜(病毒性);3:正常角膜
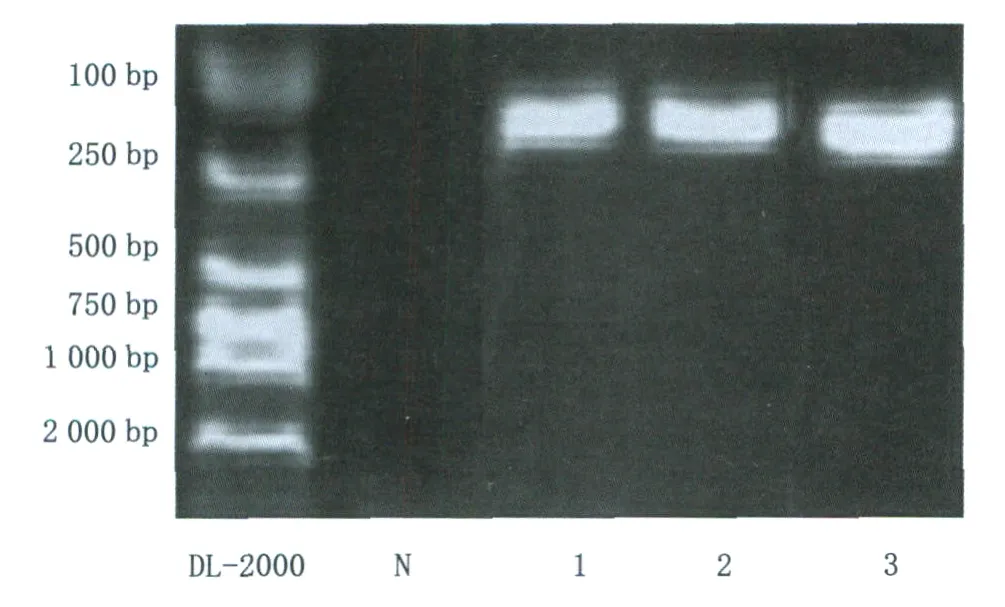
Figure 6 Expression of HBD-3(156 bp)in normal and inflammatory corneal tissues by RT-PCR.DL-2000:Marker;N:Normal control;1:Bacterial cornea;2:Viral cornea;3:Normal cornea RT-PCR检测正常和炎性角膜组织中HBD-3(156 bp)的表达。DL-2000:分子标记;N:阴性对照(无模板);1:脓性角膜(细菌性);2:炎性角膜(病毒性);3:正常角膜

Figure 7 Expression of β-actin in normal and inflammatory corneal tissues by RT-PCR.DL-2000:Marker;N:Normal control;1:Bacterial cornea;2:Viral cornea;3:Normal cornea RT-PCR检测正常和炎性角膜组织中β-actin的表达。DL-2000:分子标记;N:阴性对照(无模板);1:脓性角膜(细菌性);2:炎性角膜(病毒性);3:正常角膜
Haynes等[3]在尸体眼和捐献眼进行了眼表组织防御素检测,结果发现HBD-1可在正常结膜、角膜和泪腺中表达,HBD-2表达也在正常角膜、结膜组织中有所显示,泪腺中则未发现。Paulsen等[4]检测了人的鼻泪管组织,他们发现HBD-1在某些健康的上皮组织和炎性组织中表达,HBD-2则仅发现于炎性样本中。Lehmann等[5]半定量 RT-PCR检测显示HBD-1可表达于结膜、角膜、晶状体囊膜以及虹膜等眼部组织,而HBD-2仅表达于结膜和角膜等眼表组织。而且,HBD-1的表达水平往往高于 HBD-2。Haynes等[6]也发现HBD-1表达于睫状体,并存在于房水和玻璃体内;而HBD-2则只是在细胞因子刺激下才诱导表达于睫状体上皮和视网膜色素上皮。我们的实验结果与这些报道基本一致。
据报道,角膜上皮细胞表达HBD-2可被白介素-1β和肿瘤坏死因子-α等炎症因子及再上皮化过程刺激上调[7-8]。由此认为,本研究中HBD-2在某些组织的阳性表达,表明了一种由炎症过程或创伤愈合过程继发的HBD-2表达升高。免疫组织化学和RT-PCR检测炎性角膜组织中各有1眼样本HBD-2表达阴性。这一现象可能是包括上皮细胞在内的细胞成分,由于炎症严重缺血造成坏死或组织缺失所致。在HBD-2阴性患者中,上皮细胞可能只有低级的病理活性,与正常的角膜上皮相似。正常角膜上皮细胞HBD-2表达主要为阴性。炎性角膜疾病患者的样本与正常人角膜样本间HBD-2的表达存在明显差异。虽然实验结果发现HBD-3在正常和炎性角膜组织均有表达,但也有报道认为HBD-3可被肿瘤坏死因子-α、白介素-1β、免疫反应性纤维结合素-γ和细菌诱导产生[9-10]。
本研究揭示,HBD-1和HBD-3组成式表达于正常角膜组织。HBD-2则呈诱导式表达于炎性角膜组织,其表达是可变的。HBD-2表达差异取决于细胞的病理学活性或病变的阶段。本研究中,限于纳入的样本数较少,我们未对炎性角膜组各样本进行病原和病期分组表达研究,但这正是我们进一步深入探究的方向。
本研究的数据显示,人眼可天然产生一簇抗生素样防御素多肽,预示着防御素在人类眼表先天防护中的积极作用。有证据显示结膜与角膜上皮构成的眼表是黏膜免疫系统完整的一部分,除了与其他黏膜一样具有多种细胞介导的防御调节外,还有一系列独特的保护机制[11-13]。眼前部的泪膜包含分泌型IgA、IgG、补体成分、乳铁蛋白、溶菌酶、β溶素以及α-酸性糖蛋白等,它们不仅阻止细菌黏附,还可杀死病原体[14]。然而,我们所知的泪液抗微生物活性超出了目前已知的这些成分的作用。由此,可以推测眼部防御的重要辅助成分可能来源于先天产生的被称为防御素的AMP,本实验结果为这一推论提供一定的证据。HBD-1和HBD-3可能提供基础防护,HBD-3是唯一抗菌活性不受盐浓度影响的HBD[15],对眼表抗菌尤为有利。而HBD-2则提供附加的防御,在眼表遭受损害的干眼人群更为重要。
AMP在眼表和人体其他部位具有多重功能,伤口愈合和预防感染是人类防御素和抗菌肽IL-37等某些AMP的重要功能,在眼部表现尤为明显[16-18]。
对于眼表防御素产生与调节确切机制的了解,有助于进一步理解各种微生物角膜溃疡的发生机理,这种溃疡往往遗留损害视力的后遗症。角膜上皮完整性的破坏是角膜感染最重要的危险因素。它不仅是一种机械性损害,随着局部防御素屏障的破坏,还将增加病原体的易感性。
1 Friedland BR,Anderson DR,Forster RK.Non-lysozyme antibacterial factor in human tears[J].Am J Ophthalmol,1972,74(1): 52-59.
2 Schröder JM.Epithelial peptide antibiotics[J].Biochem Pharmacol,1999,57(2):121-134.
3 Haynes RJ,Tighe PJ,Dua HS.Antimicrobial defensin peptides of the human ocular surface[J].Br J Ophthalmol,1999,83(6): 737-741.
4 Paulsen FP,Pufe T,Schaudig U,Held-Feindt J,Lehmann J,Schröder JM,et al.Detection of natural peptide antibiotics in human nasolacrimal ducts[J].Invest Ophthalmol Vis Sci,2001,42(10):2157-2163.
5 Lehmann OJ,Hussain IR,Watt PJ.Investigation of beta defensin gene expression in the ocular anterior segment by semiquantitative RT-PCR[J].Br J Ophthalmol,2000,84(5):523-526.
6 Haynes RJ,McElveen JE,Dua HS,Tighe PJ,Liversidge J.Expression of human beta-defensins in intraocular tissues[J].Invest Ophthalmol Vis Sci,2000,41(10):3026-3031.
7 McDermott AM,Redfern RL,Zhang B,Pei Y,Huang L,Proske RJ.Defensin expression by the cornea:Multiple signaling pathways mediate IL-1 stimulation of hBD-2 expression by human corneal epithelial cells[J].Invest Ophthalmol Vis Sci,2003,44 (5):1859-1865.
8 McDermott AM,Redfern RL,Zhang B.Human-defensin 2 is upregulated during re-epithelialization of the cornea[J].Curr Eye Res,2001,22(1):64-67.
9 Harder J,Bartels J,Christophers E,Schroder JM.Isolation and characterization of human beta-defensin-3,a novel human inducible peptide antibiotic[J].J Biol Chem,2001,276(8):5707-5713.
10 Jia HP,Schutte BC,Schudy A,Linzmeier R,Guthmiller JM,Johnson GK,et al.Discovery of new human beta-defensin using a genomics-based approach[J].Gene,2001,263(1-2):211-218.
11 Dua HS,Gomes JA,Donoso LA,Laibson PR.The ocular surface as part of the mucosal immune system:Conjunctival mucosaspecific lymphocytes in ocular surface pathology[J].Eye,1995,9(3):261-267.
12 Dua HS,Donoso LA,Laibson PR.Conjunctival instillation of retinal antigens induces tolerance.Does it invoke mucosal tolerance via conjunctiva associated lymphoid tissue(CALT)[J]. Ocul Immunol Inflamm,1994,2(1):29-36.
13 Dua HS,Gomes JAP,Jindal VK,Appa SN,Schwarting R,Eagle RC Jr,et al.Mucosa specific lymphocytes in the conjunctiva,corneoscleral limbus and lacrimal gland[J].Curr Eye Res,1994,13(1):87-93.
14 Dua HS.Bacterial keratitis in the critically ill and comatose patient[J].Lancet,1998,351(9100):381-388.
15 Yamaguchi Y,Nagase T,Makita R,Fukuhara S,Tomita T,Tominaga T,et al.Identification of multiple novel epididymis-specific-defensin isoforms in humans and mice[J].J Immunol,2002,169(5):2516-2523.
16 Huang LC,Petkova TD,Reins RY,Proske RJ,McDermott AM. Multifunctional roles of human cathelicidin(LL-37)at the ocular surface[J].Invest Ophthalmol Vis Sci,2006,47(6):2369-2380.
17 McDermott AM.The role of antimicrobial peptides at the ocular surface[J].Ophthalmic Res,2009,41(2):60-75.
18 Doss M,White MR,Tecle T,Hartshorn KL.Human defensins and LL-37 in mucosal immunity[J].J Leukoc Biol,2010,87(1):79-92.

