低聚半乳糖对延边黄牛犊牛粪样菌群、血液指标及生长性能的影响
王智航 姜成哲 崔明勋 安尚泽 汪 岩 姜 贺 刘 欢 李洪龙
(延边大学农学院,延吉 133000)
肠道菌群的稳定是保障犊牛健康的第一道防线,为尽早建立完善的肠道菌群环境和犊牛免疫系统,进行营养手段的干预和调控是必要的。犊牛出生时消化道为无菌环境,开放式接受母源营养和抗体,而后随着稳定菌群环境(菌种、数目及比例相对稳定)的逐渐建立,功能完善的肠黏膜免疫屏障最终形成。由于这需要一定的时间和环境,为病原菌的定植与侵袭提供了机会,是犊牛腹泻等一些疾病的主因。因此以这一时期的犊牛为研究对象,是把握犊牛健康和保证生产效益的关键。低聚半乳糖(galactooligosaccharides,GOS)是益生素的一种,其分子结构一般是在半乳糖或葡萄糖分子上连接1~7个半乳糖基。GOS的原型出现在动物的乳汁中,量很少。作用特点是作为选择性的微生物前体,在肠道中被某些细菌的β-半乳糖苷酶水解为葡萄糖和半乳糖,作为细菌复制与增殖的碳源,从而影响肠道菌群平衡。其益生原理有2种,一是某些病原菌不能利用GOS;二是有益菌利用GOS作为自身增殖的碳源,竞争性的阻止了病原菌的定植[1]。邰秀林等[2]采用低聚果糖用于1月龄以后对犊牛,王喜明等[3]采用低聚木糖用于7日龄以后的犊牛,均有一定效果。而笔者认为,犊牛出生至1月龄是肠道菌群定植和稳定环境形成的阶段,是肠道调控的关键。本试验通过调查GOS对初生犊牛粪样菌群、血液指标及生长性能的影响,探讨利用GOS作为犊牛用益生素的效果,并对犊牛出生后的肠道菌群变化及GOS的机制做一探讨。
1 材料与方法
1.1 试验材料
GOS:纯度57%,微黄色液体,密度1.462 4 g/mL,购自广东云浮新金山生物科技有限公司。
1.2 试验动物与试验设计
选取12头初生重相近,体况良好的新生犊牛,公母各占1/2,按体重和性别随机分为3组,每组4头,于2~29日龄分别日灌服 GOS 0(对照组)、10(L 组)、15 g/d(H 组)。
犊牛出生后1~2 h保证吃到足够的初乳。试验进行前统一驱虫。犊牛和母牛在同舍饲养,每天06:00饲喂和灌服GOS。犊牛采用随母哺乳方式,根据需要自由哺乳。自由饮水,常规光照,每次饲喂后,清扫牛舍,保持牛体表的清洁。
1.3 试验方法
1.3.1 粪样采集与菌落培养
于8、15、22和29日龄晨饲前,刮取犊牛直肠末端粪样约1 g,装入灭菌后的离心管,迅速送回实验室。准确称取0.1 g粪样,用生理盐水等比稀释到不同滴度 10-5、10-7、10-9、10-11(根据培养后的菌落密度调整)。每个滴度取200μL,在准备好的平板培养基上涂菌[双歧杆菌采用BBL培养基、大肠杆菌采用伊红美蓝(EMB)培养基[4]]。所有操作均在厌氧操作台上进行的,BBL培养基上涂菌后厌氧培养箱中37℃培养48 h;EMB培养基涂菌后移至常规培养箱,有氧环境37℃培养48 h。用全自动菌落计数仪(V1型,杭州迅数科技有限公司)结合肉眼观察记录菌落数,以lg(CFU/g)表示。
1.3.2 血样采集与分析
于15和29日龄,于犊牛颈静脉分别用十二烷基四乙酸二钠(EDTA)真空管采集血液2 m L、肝素真空管采集2 m L,样本采集后送到吉林省珲春市医院,采用全自动五分类血细胞分析仪(雅培CELL-DYN 3700)测定红细胞数(RBC)、平均细胞容积(MCV)、红细胞分布宽度(RDW)、血细胞比容(HCT)、血红蛋白(HGB)、红细胞平均血红蛋白含量(MCH)和红细胞平均血红蛋白浓度(MCHC);采用全自动生化分析仪(雅培C8000)测定谷草转氨酶(AST)和丙氨酸转氨酶(ALT)活性及血清尿素氮(BUN)含量。
1.3.3 生产性能的测定
于1和29日龄清晨空腹测定犊牛初生重和试验结束时末重,并计算平均日增重。
1.4 数据统计与分析
数据采用SPSS 16.0进行统计分析和单因素方差分析,差异显著者用Duncan氏法进行多重比较。
2 结果
2.1 GOS对粪样菌群的影响
由表1可知,对照组犊牛粪样大肠杆菌数较为稳定,8~29日龄内无显著变化(P>0.05),为9.58~10.46 lg(CFU/g);各试验组随日龄增加,大肠杆菌数先增加后减少,22日龄为最高;L组随日龄的变化显著(P<0.05),H组变化相对缓慢;22日龄各试验组大肠杆菌数显著高于对照组(P<0.05),其他各日龄对照组与试验组均差异不显著(P>0.05);29日龄对照组和L组大肠杆菌数最低,2组间差异不显著(P>0.05)。
对照组双歧杆菌数随日龄增加而增多,变化范围7.28 ~10.15 lg(CFU/g),22 日龄以后差异显著(P<0.05);各试验组犊牛在各日龄双歧杆菌数均显著高于对照组(P<0.05),且均为22日龄达到最高;L组双歧杆菌数高于其他2组。
2.2 GOS对血液生理指标的影响
由表2可知,犊牛出生后随日龄增加RBC、HGB、MCHC降低,MCV、RDW、MCH 增加;L组15和29日龄、H组29日龄RBC显著低于对照组(P <0.05);MCV 不受处理的影响(P >0.05),随日龄增加,L组和对照组MCV显著增加(P<0.05);RDW 不受处理的影响(P>0.05),H 组和对照组RDW 随日龄显著增加(P<0.05);HGB的变化趋势类似于RBC,15日龄L组显著低于对照组和H组(P<0.05),29日龄显著低于对照组(P<0.05);MCHC 15日龄 H组、29日龄 L组和H组显著低于对照组(P<0.05)。
2.3 GOS对血清生化指标的影响
由表3可知,试验期内AST活性和BUN含量均不受处理和日龄变化的影响(P>0.05);ALT活性随日龄增加对照组和L组均显著增强(P<0.05),29日龄L组显著高于 H 组(P<0.05)。
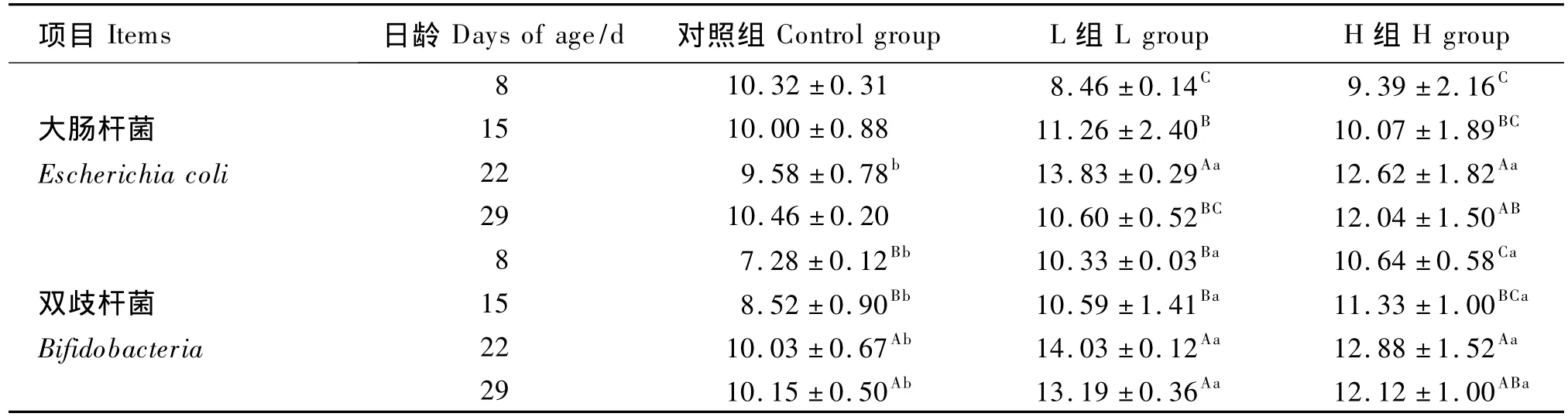
表1 GOS对犊牛粪样大肠杆菌和双歧杆菌数的影响Table 1 Effects of GOS on the numbers of Escherichia coli and Bifidobacteria in fecal in calves lg(CFU/g)
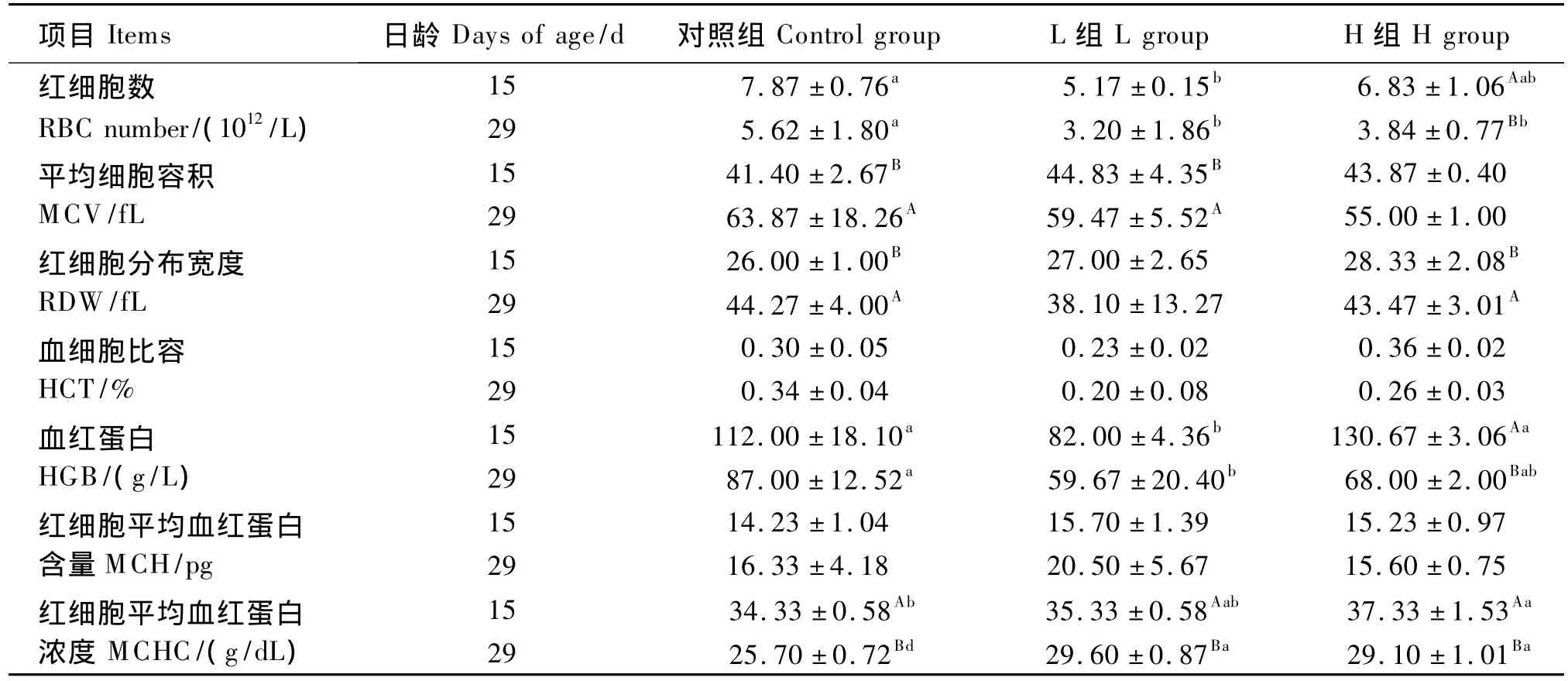
表2 GOS对犊牛血液生理指标的影响Table 2 Effects of GOS on blood physiological indices of calves

表3 GOS对犊牛血清生化指标的影响Table 3 Effects of GOS on serum biochem ical indices of calves
2.4 GOS对犊牛生产性能的影响
由表4可知,犊牛初生重差异不显著(P>0.05);末重、平均日增重均为L组最高,显著高于对照组(P <0.05)。

表4 GOS对犊牛生长性能的影响Table 4 Effects of GOS on grow th performance of calves
3 讨论
3.1 GOS对犊牛粪样菌群的影响
犊牛消化道出生时为无菌环境,在出生的过程中细菌即开始定植,接种物多数来自于母畜产道和粪便,部分来自于外源环境。首先被转移接种到犊牛的是兼性菌,如大肠杆菌、链球菌属,这些非营养性的细菌通过生长耗氧制造出肠道内严格的厌氧环境,从而提供了营养性厌氧菌的生存条件[5]。通过本试验对照组数据可知,8日龄犊牛肠道中大肠杆菌数即达到了10.32 lg(CFU/g),并在29日龄内变化不大;而双歧杆菌数8日龄远低于大肠杆菌数,并逐渐增多,22日龄后保持较稳定的数值,与前人研究一致。
肠道微生物区系的早期发育很大程度上依赖于摄取的食物。GOS的原型出现在动物的乳汁中,量很少,由乳腺合成,商品GOS则是聚合度不同的混合物。
GOS水解机制是细菌依靠自身的β-半乳糖苷酶将GOS水解,β-半乳糖苷酶与半乳糖基以共价键结合,并将半乳糖基转移给水,1分子的半乳糖被水解下来,GOS聚合度降低(乳糖降解产物为半乳糖和葡萄糖)[6-7],最终形成的单糖进入小肠上皮,再进入血液参与机体代谢。
细菌增殖及GOS利用的选择性决定于2方面:一是该菌种是否有水解GOS的β-半乳糖苷酶,多数研究认为GOS不能使大肠杆菌增殖,大肠杆菌在乳糖上生长数千个酶的分子[7],鉴于水解的相同机制,GOS可能也诱导了β-半乳糖苷酶分子的增加;二是聚合度,与聚合度为2的GOS或乳糖相比,聚合度为3或4的GOS更容易被双歧杆菌利用,所有的双歧杆菌属和乳酸杆菌属能够利用聚合度为2的GOS[8]。商品GOS成分较为不均一,是聚合度不同的混合物,在这样的混合物中,对微生物前体的增加归因于某一种糖的结构仍存在困难[9]。但这是局限于生产技术的,控制产品的聚合度、改进工艺及降低成本是实际生产中仍需改进的。
人食用GOS后盲肠中乳酸菌和双歧杆菌数量显著增加,大肠杆菌数量显著降低[10]。而拟杆菌属(包括双歧杆菌和乳酸菌等)和大肠杆菌是最具免疫原性的共生菌[11]。因此,GOS是否能够使大肠杆菌增殖存在争议。
犊牛的肠道处于发育过程,应将微生物共生、竞争以及环境变化作为整体来研究。本试验中大肠杆菌数在8日龄试验组均低于对照组,而在15、22和29日龄均高于对照组,可能的原因有2方面:一是GOS可以被大肠杆菌所利用,所以出现22日龄前数量的增加;二是犊牛时期肠道非严格厌氧环境制约了双歧杆菌的生长,而GOS被大肠杆菌等所利用,22日龄到达厌氧环境后,双歧杆菌的生长优势才显现出来。29日龄试验组双歧杆菌数均显著高于对照组,而使大肠杆菌数保持在和对照组无显著差异。表明GOS改善了肠道菌群平衡,使双歧杆菌在数量有显著提高,并在比例上成为优势菌群。
3.2 GOS对犊牛血液指标及生长性能的影响
血液组分的变化是考察犊牛的健康和福利水平的标准。关于犊牛出生后的红细胞及其组分的变化前人得出了较为一致结果:1周龄开始犊牛RBC和 HGB降低[12],且 HGB随 MCHC降低而降低[13]。观察对照组结果得出的规律如下:单位体积内,随日龄增加红细胞数量减少(RBC降低)、体积(MCV)增大、大小逐渐不一致(RDW 升高);由于细胞浓度的降低,单位体积内的血红蛋白含量(HGB)及其在红细胞中的浓度(MCHC)也随之降低,而单个红细胞中血红蛋白含量(MCH)增加。
红细胞数目减少和组分变化会导致动物贫血。血液通过肺时红细胞通过血红蛋白携带氧,随氧释放到全身的组织和器官。幼年动物易发贫血,对照组中RBC和HGB减少均表明犊牛即将面临或正在面临这样的危机,据Bomba等[14]报道犊牛贫血临界期为3~5周龄,原因是较高的生长速度和造血底物的不足间的不平衡。
生长期的犊牛血液指标受饲粮和饲养管理的影响很大[15]。犊牛灌服GOS的作用结果是:RBC和HGB降低(其中 L组显著低于对照组,P<0.05),MCHC 显著提高了(P <0.05)。RBC 和HGB的变化可能同样是由于较高的生长速度引起的,可以从生长性能的试验组优于对照组得到佐证;而MCHC的升高推测是GOS引发的效果,机制尚不清楚,但可以说明单个红细胞携氧能力显著提高。MCHC 值为25.70~37.33 g/dL,与Bam i等[16]报道荷斯坦犊牛的值接近。本试验中灌服GOS的犊牛,更易面临RBC少和HGB低型的贫血,但单个红细胞的携氧能力有所提高,可缓解该型贫血。
ALP是用于诊断骨和肝功能紊乱的膜结合酶,成骨细胞活性,生长动物的ALP活性显著高,因此在幼龄动物中,ALP活性高低可以反映出动物的生长快慢,本试验中L组为最高,与生长性能L组最好相一致。
BUN可以反映动物蛋白质代谢,GOS饲喂犊牛BUN含量增加,但差异不显著,可能是由于GOS在肠道内使有益菌增值,菌体蛋白含量增加,而等于增加了动物吸收的蛋白质源。
犊牛饲喂GOS后提高了末重和平均日增重。从各项数据剖析这一结果,应该是GOS优化了肠道菌群,使双歧杆菌成为优势菌,而双歧杆菌发挥其作为益生菌的作用,引发犊牛机体的生理及免疫功能的变化,最终提高了犊牛的生长性能。L组生长性能最好,可能是由于高剂量GOS不能完全被利用,β-半乳糖苷酶的底物将其合成了更高聚合度的GOS,导致利用率的降低,同L组菌群作用效果最佳相印证,与生理生化指标变化相一致。
综合以上,GOS可以改善犊牛肠道菌群环境,使双歧杆菌成为优势菌群,提高动物生长速度,但也因高生长速度引发造血原料的不足而使动物更易贫血。
本试验采用完全随母哺乳的饲喂方式,以考察GOS单因素的作用效果,而在实际生产中如采用营养更为全面的代乳粉,通过外源补充方式可以避免本试验中的造血原料的不足。
4 结论
①初生犊牛饲喂GOS可影响肠道菌群平衡,使双歧杆菌成为肠道优势菌。
②初生犊牛饲喂GOS可提高生长速度,而相对的造血原料的不足加重,但可以缓解低MCHC型贫血的发生。
③在本试验条件下,添加10 g/d效果较好。
[1] TANAKA R,TAKAYAMA H.Effects of adm inistration of TOS transgalactosylated oligosaccharide and Bifidobacterium breve 4006 on the human fecal flora[J].Bifidobacteria and M icroflora,1983,2(1):17-24.
[2] 邰秀林,龙翔,向钊,等.低聚果糖对早期断奶犊牛生长性能和血液理化指标及肠黏膜形态的影响[J].中国畜牧杂志,2009(11):34 -38.
[3] 王喜明,许丽,孙文,等.低聚木糖对犊牛生长性能及粪便菌群的影响[J].中国畜牧杂志,2009(7):40-42.
[4] 陈金春.微生物学实验指导[M].北京:清华大学出版社,2005.
[5] MOUNTZOURIS K C,MCCARTNEY A L,GIBSON G R.Intestinalm icroflora of human infants and current trends for its nutritional modulation[J].British Journal of Nutrition,2002,87:405-420.
[6] ZECHEL D L,W ITHERS S G.Glycosidase mechanisms:anatomy of a finely tuned catalyst[J].Accounts of Chem ical Research,2000,33(1):11-18.
[7] 王镜岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社,2002.
[8] AMARETTI A,BERNARDI T,TAMBURINI E,et al.Kinetics and metabolism of Bifidobacterium adolescentis MB 239 grow ing on glucose,galactose,lactose,and galactooligosaccharides[J].Applied and Environmental M icrobiology,2007,73(11):3637-3644.
[9] ADAMCZAK M,CHARUBIN D,BEDNARSKIW.Influence of reaction mediu composition on enzymatic synthesis of galactooligosaccharides and lactulose from lactose concentrates prepared from whey permeate[J].Chem ical Papers,2009,63(2):111 -116.
[10] GIBSON G R,ROBERFROID M B.Dietary modulation of the human colonic m icrobiota:introducing the concept of prebiotics[J].Journal of Nutrition,1995,125:1401-1412.
[11] MOREAU M C,GABORIAU-ROUTHIAU V.Immunomodulation by the gutm icroflora and probiotics[J].Probiotics,2000,3:69 -114.
[12] SWENSON M J,REECE W O.Duckes physiology of domestic animal[M].11th ed.New York:Cornell University Press,1993.
[13] BRUN-HANSEN H C,KAMPEN A H,LUND A,et al.Hematologic values in calves during the first 6 months of life[J].Veterinary Clinical Pathology,2006,35(2):182-187.
[14] BOMBA A,SEVCIK A,POLDAUFM.Changes in erythrocytes,serum iron and serum copper in calves and after weaning,w ith reference to anaem ia[J].Veterinarstvi,1986,36:227 -229.
[15] REECEW O,HOTCHKISSD K.Blood studies and performance among calves reared by differentmethods[J].Journal of Dairy Science,1987,70(8):1601-1611.
[16] BAM IM H,MOHRIM,SEIFIH A,et al.Effects of parenteral supply of iron and copper on hematology,weight gain,and health in neonatal dairy calves[J].Veterinary Research Communications,2008,32(7):553-561.

