海藻酸钠-壳聚糖微球制备及质量评价研究
,, ,,
(1.吉林大学第四临床医院,吉林 长春 130011;2.长春中医药大学,吉林 长春 130117;3.吉林工业职业技术学院,吉林 吉林 132013)
微球是缓控释新型给药系统,根据不同的需要可以作为口服剂、注射剂等使用,具有潜在的应用价值,成为国内外医药研究和应用的趋势。制备的微球主要有白蛋白微球[1]、明胶微球[2]、聚乳酸微球[3]等,根据材料性质的不同,可以采用溶剂挥发法[4]、喷雾干燥法[5]等进行微球制备。但是有些材料和制备方法存在一定的弊端,如聚氰基丙烯酸酯等,在体内不容易降解和代谢,在制备过程中多用有机溶剂,如固化剂甲醛、戊二醛等,残留在制剂中不容易除去,且有些方法在制备过程中需要在高温条件下进行,对药物稳定性具有一定影响。本研究采用可生物降解的海藻酸钠和壳聚糖为材料,制备过程不加有机试剂,并且反应条件温和。
葫芦素(cucurbitacin,CU)系从葫芦科植物甜瓜蒂(PedicellusMelo)提取分离而得,是治疗肝炎和肝癌的有效成分,其中主要成分为葫芦素B(CUB)[6]。为提高药物的生物利用度、降低毒性作用,将其制备成微球制剂,达到缓释的作用,本文以其主要药用成分CU为指标对其载药量、包封率及体外释药进行研究。
1 实验材料
1.1 仪器 TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司) ;Al204型电子天平 (梅特勒-托利多仪器有限公司);KQ3200DB型速控超声波清洗器 (昆山市超声仪器有限公司);SHA-CA水浴恒温振荡器 (江苏金坛市精达仪器制造厂);SZ-1涡旋混匀机(江苏金坛江南仪器厂);HJ-5多功能搅拌器(常州日华电器有限公司)。
1.2 试药与试剂 葫芦素B对照品(CUB)(纯度质量分数为98.85%,购自天津药物研究院),甜瓜蒂提取物(本实验室自制),壳聚糖(中脱乙酰度75.0~89.0%,批号090303,购自沈阳鑫盛生物科技有限公司),海藻酸钠(黏度8mpa.s,批号090312,购自青岛晶岩生物科技开发有限公司),十二烷基硫酸钠、氯化钙、香草醛、乙酸、三氯甲烷、磷酸二氢钠、氢氧化钠、冰醋酸、高氯酸、硫酸均为分析纯。
2 实验内容
2.1 微球的制备 本研究采用滴制法制备海藻酸钠-壳聚糖微球。将一定量药物溶解于海藻酸钠水溶液中,混合均匀,滴入含有一定量氯化钙的壳聚糖溶液中,并搅拌一定时间取出,蒸馏水洗涤数次,室温干燥,即得。
2.2 载药微球的评价
2.2.1 微球形态学特征 干燥前的微球为白色的实体球,表面光滑,具有一定的硬度,正圆形,见图1。干燥后的微球略显黄色,显微镜下观察表面有众多皱纹,微球缩水皱缩所致,见图2。
2.2.2 微球粒径及分布 按照微球制备方法制备三批微球,采用显微镜测定微球的粒径大小。随机取制备的微球适量,测定每个球体三个角度的直径,防止球体不圆整测量不准,计算微球的平均粒径和粒径分布状况。结果制备3批微球的平均粒径为342.8 μm,337.6 μm,322.5 μm,平均粒径为(334.3±10.54)μm,表明微球粒径大小较均一,粒径分布较窄,分散性好。

图1 微球图片

图2 微球显微图片(×4)
2.2.3 微球的圆整度 在3批微球样品中,每批微球取出100粒,采用“2.2.2微球粒径及分布”项下方法测定每1微球3个不同角度的粒径,计算RSD值。根据微球粒径的RSD值为微球打分,具体打分标准如下:RSD值=0~2%,圆整度很好,10分;RSD值=2%~4%,圆整度良好,8分;RSD值=4%~6%,圆整度较好,6分;RSD值=6%~8%,圆整度一般,4分;RSD值=8%~10%,圆整度稍差,2分;RSD值>10%,圆整度不好,0分。经测定,微球粒径的RSD值为3.15%,微球的圆整度良好。
2.2.4 CU含量测定方法学研究
2.2.4.1 CU对照品、供试品溶液的制备 对照品溶液的制备:精密称取CUB对照品10 mg,置10 mL容量瓶中,加甲醇定容至刻度,制备成1.0 mg/mL的CUB对照品溶液。
供试品溶液的制备:分别精密称取载药微球制剂及空白微球各25 mg,加1 mL蒸馏水浸泡30 min,研磨至均匀胶浆,加入2 mL三氯甲烷,漩涡10 min后,3 800 r/min离心10 min,取三氯甲烷层。再次加入三氯甲烷,同上处理,反复3次,合并三氯甲烷层,备用。
2.2.4.2 CU检测波长的确定 称取CU成分,采用香草醛-冰醋酸法显色,紫外分光光度计400~700 nm波长范围扫描。CU在532 nm处有最大吸收峰,故确定检测波长为532 nm。
2.2.4.3 CU线性关系的确定 精密吸取CUB对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL置于容量瓶中,配成0.1、0.2、0.3、0.4、0.5、0.6 mg/mL溶液,采用香草醛冰醋酸反应显色在532 nm处检测。以吸光度值(Y)对浓度(X)进行线性回归,得到回归方程:Y=0.783 4X+0.031 8(R=0.999 2),结果表明,CU的检测浓度在0.1~0.6 mg/mL呈良好的线性关系。
2.2.4.4 精密度实验 精密吸取CUB对照品溶液0.3 mg/mL,香草醛-冰醋酸反应显色后,在532 nm处连续测定5次,计算精密度。结果其RSD为0.58%,表明仪器精密度良好。
2.2.4.5 稳定性实验 精密吸取CU供试品溶液,香草醛-冰醋酸反应显色后,532 nm处测定,测定时间分别为10、20、30、45 min,1、2、3、4 h。结果显示,CU在4 h内测试稳定,RSD值为1.47%。
2.2.4.6 重现性实验 制备CU供试品溶液5分,精密吸取1 mL,香草醛-冰醋酸反应显色后,在532 nm处测定,计算RSD值。结果表明供试品溶液重现性RSD=2.07%,样品重现性良好。
2.2.4.7 回收率实验 精密称取15 mg的微球制剂,分别加入1∶0.8、1∶1、1∶1.2 3种浓度的标准品溶液,按照供试品处理方法制备,在532 nm处测定,代入标准曲线求其含量。根据各样品的加入量,计算其回收率。结果表明,高、中、低3种浓度的回收率分别为96.05%,95.83%,95.94%,RSD值为0.46%,0.52%,0.60%,表明供试品测试的制备方法可行。
2.2.4.8 微球中药物的含量测定 精密吸取3批样品的供试品溶液,60 ℃水浴挥干,加入0.2 mL 5%香草醛-冰醋酸溶液,再加入0.8 mL高氯酸,水浴60 ℃反应15 min,冷却至室温,加入冰醋酸5 mL,532 nm处测定吸光度值,根据标准曲线法计算含量。空白为空白微球在供试品相同条件下的反应溶液。微球中CU的含量为20.48 mg/g。
2.2.5 载药量及包封率测定 测定微球中皂苷的含量,按照公式:载药量%=(微球中药物的重量/微球重量)×100%,包封率%=(微球中药物的重量/投入的总药量)×100%计算载药量及包封率。结果微球的包封率为78.72%,载药量为17.50%。
2.3 微球体外释药研究 分别精密称取微球制剂及空白微球各0.5 g置透析袋中,以50 mL pH 7.2的磷酸盐缓冲液(含5%的十二烷基硫酸钠)为释放介质,置于水浴恒温振荡器中,控制温度在(37±0.5) ℃,搅拌速度为50 r/min,于不同时间30 min,1、2、4、6、8、10、22、26、30、34、46、52、60 h)取样5 mL,同时补充同体积同温度的释放介质5 mL。透析样品按照供试品溶液的制备方法处理,采用香草醛冰醋酸反应检测透析液中的CU的含量。以取样时间(t)为横坐标,累积释放百分率(%)为纵坐标绘制释放曲线。对释放曲线进行零级,一级,Higuchi方程拟合,由拟合方程得知,CU的释放曲线符合Higuchi方程,制备的微球均具有缓释作用。结果见表1。

表1 微球体外释放拟合方程及相关系数
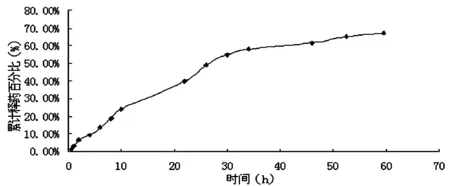
图3 微球体外释药曲线图
3 结果与讨论
3.1 微球的制备方法有很多,一般较为复杂,且多有有机溶剂参与,有的需要在高温条件下进行制备,对药物微球的稳定性及使用的安全性具有一定的影响。本实验制备微球的辅料海藻酸钠和壳聚糖均为可生物降解的无毒性材料,其生物相容性好,制备工艺简单,无有机试剂参与,安全可靠。
3.2 本研究制备的微球粒径为(334.3±10.54)μm,大小均一,分布较窄,圆整度良好,干燥后的微球表面不光滑,具有一定的纹理,主要是微球缩水形成的,微球吸水后膨胀,纹理会渐渐舒展开, 形成表面光滑的球体。
3.3 制备的微球体外释药考察结果表明,30 min时,微球中药物释放量均小于20%,避免了药物的突释现象。通过零级(R=0.919 5)、一级(R=0.964 8)、Higuchi(R=0.981 3)方程拟合可见,皂苷的释放符合Higuchi方程,微球具有缓释作用。分析原因,海藻酸钠与壳聚糖在水中形成黏稠状物质,包裹在微球的表面,阻碍药物溶出,同时水性凝胶本身也会阻碍药物的溶出,达到长效给药的目的。药物在释放过程中,首先是微球吸收释放介质膨胀,释放介质渗入微球内部,将内部的药物溶解到介质里,主要依靠药物的扩散作用。另外,溶液的穿透力导致微球的外壳逐步降解或崩解,使内部药物溶出。所以,释放过程由扩散过程与降解过程共同控制。
本实验研究的微球制备方法简便可行,微球属于缓释制剂,因此海藻酸钠-壳聚糖微球作为药物的缓释载体,具有一定的应用前景。
[1]邹东娜,张典瑞,张学顺,等.苦参碱白蛋白微球的制备及性质[J].中国医药工业杂志,2006(12):824-827.
[2]刘琳娜,李欣,梅其炳,等.尼莫地平明胶微球的制备及其性质研究[J].华西药学杂志,2006(3):243-245.
[3]汪自然,徐启勇,叶燕青.复乳法制备聚乳酸及其共聚物微球参数的研究进展[J].国际生物医学工程杂志,2006(4):238-242.
[4]李岩,孙殿甲,毕殿洲.聚乳酸、聚乳酸乙醇酸共聚物微球的制备及体外释放影响因素研究进展[J].中国现代应用药学,2002(4):281-284.
[5]盛江峰,马淳安,张诚,等.喷雾干燥法制备偏钨酸铵微球时的形貌与粒度[J].高校化学工程学报,2008(1):122-127.
[6]金岩,杨君.葫芦素脂质体的制备及包封率测定[J].山西医药杂志,2008(8):721-722.

