姜黄素改善丝裂霉素C导致的肾功能损伤
周钱梅,苏式兵
(上海中医药大学中医复杂系统研究中心,上海 201203)
姜黄素(curcumin)是以传统中药材姜黄为原料,提取精制而得的食用天然黄色素。它被报道具有肿瘤细胞增殖抑制[1]等抗肿瘤作用,并对顺铂的化疗毒性作用有一定的防护效果[2]。研究发现,姜黄素能够通过抑制糖调节蛋白P58介导的丝裂霉素C(mitomycin C,MMC)与DNA的交联,减少MMC抗肿瘤的毒性作用[3],MMC是一种细胞周期非特异性广谱抗瘤药物,可使细胞的DNA解聚,同时阻碍DNA的复制,从而抑制癌细胞分裂[4]。由于MMC抗癌治疗易引起耐药性,且伴随着诸如肾功能损害、骨髓抑制等毒副作用[5],只能作为乳腺癌治疗的三线化疗药物。化学预防治疗是指应用相对无毒的天然或合成的药物干预癌症发生、发展的各个阶段,能降低癌症的危险性,且已呈现出良好的发展前景[6]。姜黄素是一种相对低毒的植物衍生的多酚类化合物,具有潜在化学预防作用。已有研究报道,姜黄素与顺铂联合应用后使一些肿瘤相关的酶趋于正常化,其可作为顺铂化疗药物很好的辅助治疗药物[7]。但对其如何减少MMC抗肿瘤肾毒性的机制缺乏研究。本研究将姜黄素和不同浓度MMC联合用药与单独使用MMC比较,观察肿瘤生长被抑制状态下,移植瘤鼠肾功能损伤状况,并检测MMC在肾的分布,探讨姜黄素改善MMC所致肾功能损伤及其作用机制。
1 材料与方法
1.1 试剂及仪器
姜黄素购自中国药品生物制品检定所。MMC购自美国ICN公司。RPMI 1640培养基购自美国Gibco公司。胎牛血清(fetal bovine serum,FBS)购自美国PAA公司。牛胰岛素购自美国Sigma公司。二甲亚砜(dimethyl sulfoxide,DMSO),血肌酐(creatinine,Cre)和血尿素氮(blood urea nitrogen,BUN)检测试剂盒购自南京建成生物工程研究所。Survyor型液相色谱仪及LCQ DECA XPplus质谱仪购自美国Finnigan公司。SEVAP系列氮吹仪购自美国Organomation公司。Synergy2酶联免疫检测仪购自美国BioTek公司。
1.2 细胞培养及乳腺癌异种移植瘤裸鼠模型的制备
MCF-7细胞由中国科学院健康所荆清课题组惠赠。MCF-7细胞种植在RPMI 1640培养基(含10%FBS,胰岛素 0.01 g·L-1,青链霉素 100 kU·L-1混合液,HEPES 20 mmol·L-1)中,细胞在 37℃ 5%CO2环境中单层生长。
将人乳腺癌MCF-7细胞1×1010L-1接种于雌性裸鼠的乳房颊脂垫。在接种细胞前24 h,裸鼠ip给予苯甲酸雌二醇5 g·kg-1,每隔5 d补加1次,共14 d。
1.3 动物分组与给药
以DMSO溶解姜黄素粉末,配制成40 mmol·L-1溶液(储存液),置 4℃ 冰箱保存,临用时稀释成所需浓度(DMSO终浓度<0.1%)。MMC以生理盐水溶解,配制成1 mmol·L-1溶液(储存液),置4℃避光保存。
BALB/c裸鼠72只,购自上海斯莱克实验动物有限责任公司,许可证号SCXK(沪)2007-0005,7周龄,雌性,体质量19~23 g,上海中医药大学动物实验中心SPF实验室饲养。在造模2周后,除正常对照组外,移植瘤裸鼠被随机分为模型组;姜黄素100 mg·kg-1组,ip 给予 0.2 ml,隔天给药 1 次;MMC 1,1.5 和2 mg·kg-1组,每隔 5 d 给药 1 次;姜黄素 +MMC组,同时给予两药,给药频率同各单独用药频率。给药4周后眼眶取血,800×g离心3 min分离血清备Cre和BUN检测。取血后即刻行颈脱位法处死小鼠,解剖后取瘤块,称其质量,取肾组织检测药物分布量。
1.4 观察动物体质量及存活情况
实验动物按其体质量随机分组,分别于造模前、给药前及给药结束后称体质量,本实验仅比较给药结束后各组实验动物的体质量。实验整个过程中记录各组实验动物的死亡数目,计算各组实验动物的存活率。
1.5 测定肿瘤质量
实验动物给药4周,颈脱位法处死小鼠后,在接种乳腺癌细胞MCF-7处原位解剖取瘤块称重。
1.6 检测血清肌酐
取血清0.1 ml加入钨酸蛋白沉淀剂1 ml,充分混匀,800×g离心10 min,取上清按Cre检测试剂盒说明书进行测定,测定吸光度(absorance,A)并按以下公式计算血清 Cre含量:血清 Cre(μmol·L-1)=(A测定管-A空白管)/(A标准管-A空白管)× 标准管浓度(10 μmol·L-1)×11。
1.7 检测血清尿素氮
取血清 0.05 ml加入2.5 ml肟溶液1 g·L-1、酸溶液2.5 ml,混匀,置沸水中15 min,立即用自来水冷却。使用酶联免疫检测仪,测定A值后,按以下公式计算血清 BUN含量:BUN(mmol·L-1)=(A测定管-A空白管)/(A标准管-A空白管)×标准品浓度(10 mmol·L-1)×样本测试前的稀释倍数。
1.8 液质联用仪检测肿瘤组织中的药物分布
姜黄素和MMC的质谱条件:Survyor型液相色谱仪及LCQ DECA XPplus质谱仪配有ESI离子化源和离子阱质量分析器,Xcalibur1.3 workstation数据处理系统。色谱柱:Agilent Zorbax Extend-18栓(2.1 mm×150 mm,5 μm);流动相:色谱甲醇和超纯水;流速:0.3 ml·min-1;柱 温:30℃;进 样 量:2 μl(MMC:5 μl)。上机实验条件,ESI界面:阳离子模式;毛细管温度:姜黄素270℃,MMC 310℃;喷雾电压:姜黄素5 kV,MMC 4 kV;毛细管电压:姜黄素26 V,MMC 7 V;鞘气流(N2):姜黄素10 AU,MMC 32 AU;辅助气流(N2):姜黄素0 AU,MMC 15 AU。表1为时间-流动相组成梯度。
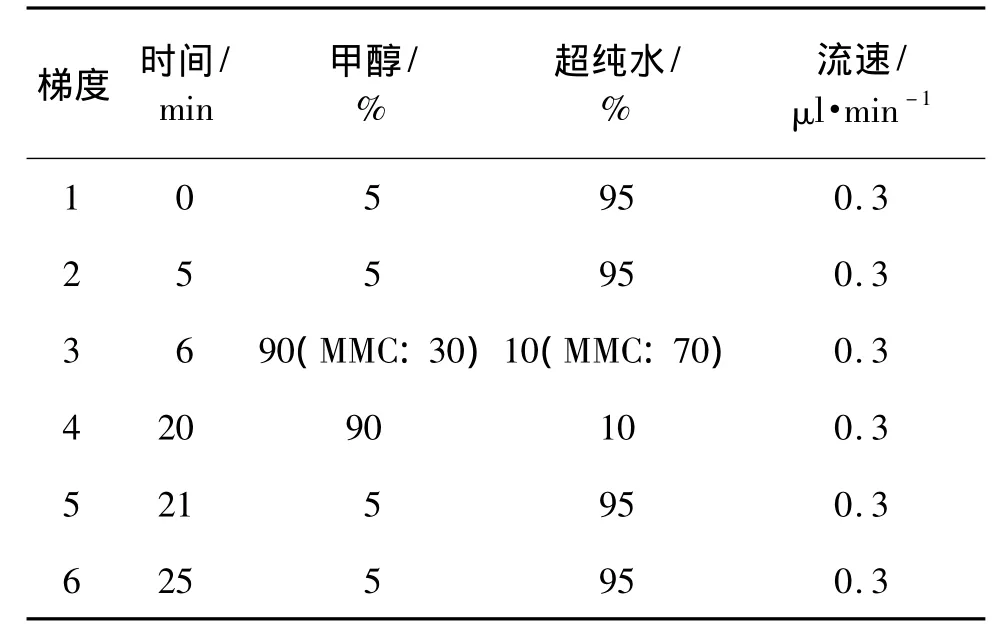
表1 液质联用仪检测姜黄素与丝裂霉素C(MMC)的流动相梯度Tab.1 Chromatographic gradient for analysis of curcumin and mitomycin C(MMC)
1.9 色谱法检测肾组织丝裂霉素原型药物分布
取0.2 g肾组织,生理盐水匀浆后,2200×g离心10 min后取全部上清,加入5倍体积的甲醇,2200×g离心10 min,取全部上清,氮吹仪将其吹干浓缩,再在40℃水浴上以 50% 甲醇-水溶剂溶解成 200 μl,20 000×g离心15 min,取上清,用于色谱检测。
1.10 统计学分析
等效线图解法分析药物联合应用的效应。用公式q=E(AB)/[EA+(1 -EA)×EB][4]计算 q值,判定两药合用是否增效。其中,E(AB)为两药合用的抑制率,EA和EB为两药单用的抑制率,q=0.85~1.15表示两药作用相加,q>1.15表示两药作用协同,q<0.85表示两药相互拮抗。
2 结果
2.1 姜黄素与丝裂霉素联合对动物体质量及存活率的影响
小鼠给予 MMC 1,1.5 和2 mg·kg-1出现食欲缺乏和体质量减轻。MMC 2 mg·kg-1组体质量较模型对照组减轻了38%(表2)。姜黄素100 mg·kg-1+MMC 1,1.5 和 2 mg·kg-1联合用药组的小鼠食欲正常,与单独给与 MMC 1,1.5 和2 mg·kg-1组比较,体质量分别增加了12%,24%和18%(P<0.05),与正常对照组比较无显著性差异(表2)。MMC 2 mg·kg-1组存活率为 4/8,MMC 1.5 mg·kg-1组存活率为7/8,而姜黄素 100 mg·kg-1+MMC 1,1.5 和 2 mg·kg-1联合用药组则无死亡,存活率均为8/8。

表2 姜黄素与MMC联合对BALB/c裸鼠体质量的影响Tab.2 Effect of curcumin combined with MMC on body mass of BALB/c nude mice
2.2 姜黄素与丝裂霉素联合对肿瘤生长的影响
如表3所示,与模型对照组比较,MMC 1 mg·kg-1对肿瘤大小无明显影响;单独给予姜黄素或MMC 1.5 和2 mg·kg-1后肿瘤质量比模型组分别减少了44.2%,64.5%及 84.5%;姜黄素联合 MMC 1,1.5 和2 mg·kg-1组的肿瘤质量分别减少了 40.9%,86.5%和82.7%,均有显著性差异(P <0.05)。其中,姜黄素 +MMC 1.5 mg·kg-1显著抑制裸鼠肿瘤的生长,表现为协同抑瘤作用(q=1.17)。
2.3 姜黄素与MMC联合对小鼠肾功能的影响
表4结果显示,与模型组比较,MMC 1,1.5和2mg·kg-1血清中 Cre水平分别升高了14%,27%和82%,BUN水平分别升高了37%,52%和54%,差异显著(P<0.05),表明MMC对肾功能有损伤作用。分别与相应单用MMC组比较,姜黄素+MMC 1,1.5 和2 mg·kg-1联合用药后,Cre 水平分别降低了19%,25%和43%,BUN水平分别降低了37%,41%和34%,差异显著(P<0.05)。提示姜黄素与MMC联合用药后改善了MMC所致的肾功能损伤。
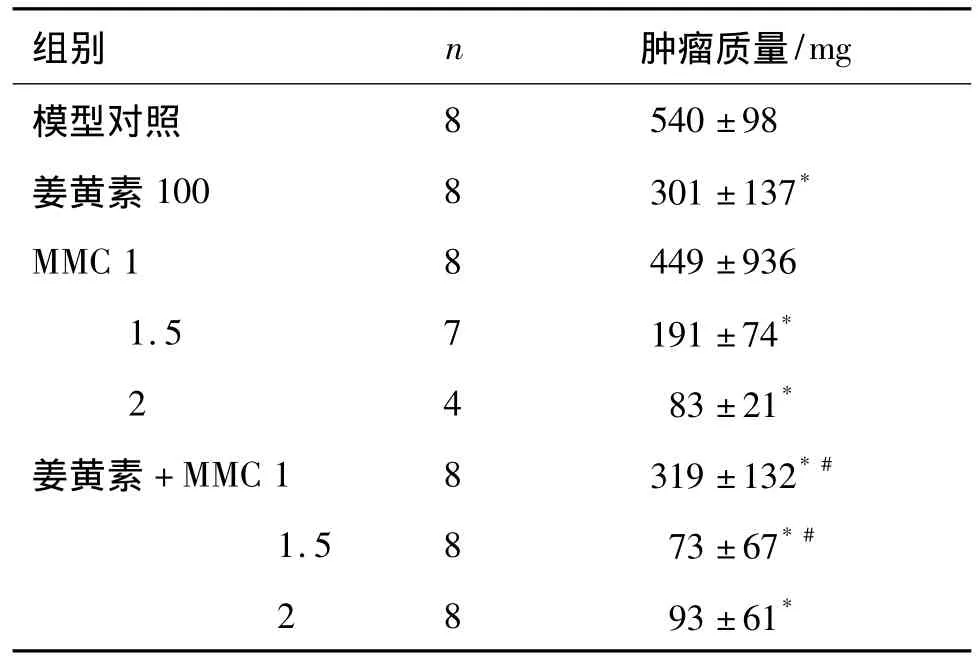
表3 姜黄素与MMC对BALB/c裸鼠肿瘤质量的影响Tab.3 Effect of curcumin combined with MMC on tumor mass of BALB/c nude mice
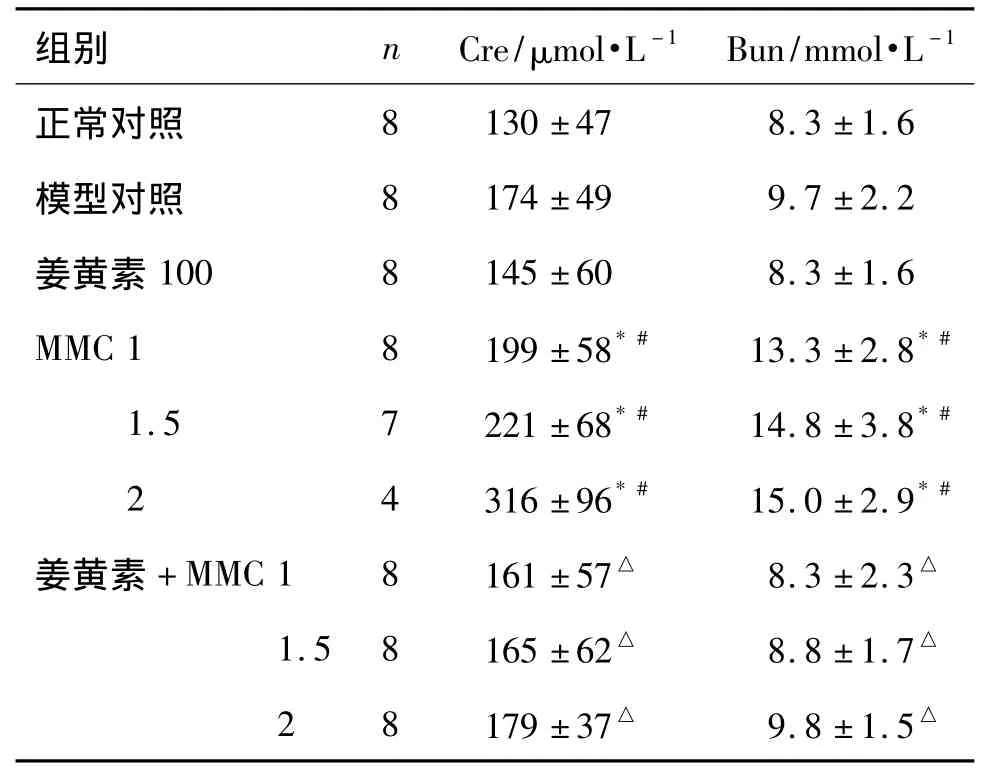
表4 姜黄素与MMC联合对BALB/c裸鼠血清肌酐(Cre)及血清尿素氮(BUN)的影响Tab.4 Effect of curcumin combined with MMC on levels of serum creatinine(Cre)and blood urea nitrogen(BUN)in BALB/c nude mice
2.4 姜黄素对丝裂霉素肾分布量的影响
姜黄素与MMC的检测均采用选择离子模式。姜黄素标准品的出峰时间为8.57 min,在质荷比为367.3出现分子离子峰。MMC标准品的出峰时间为11.10 min,在质荷比为357.3出现分子离子峰。
在姜黄素与不同剂量MMC联合用药组小鼠肾组织中均检测到姜黄素和MMC原型药物(表5)。其中,单独用MMC 1,1.5 和2 mg·kg-1组中MMC 原型药物的分布量分别为(11.2 ±5.5,19.9 ±5.2 和33.5 ± 3.9)g·g-1,而姜黄素 +MMC 1,1.5 和 2 mg·kg-1组中MMC原型药物的分布量分别为(0.99±0.53,2.34 ±1.73 和 5.2 ±1.05)g·g-1。与相应的单药组比较,姜黄素与MMC联合用药后,肾组织中MMC的分布量分别减少了91%(P<0.01),88%(P <0.01)和84%(P <0.01),提示 MMC 与姜黄素联合用药后,MMC的肾分布量减少。
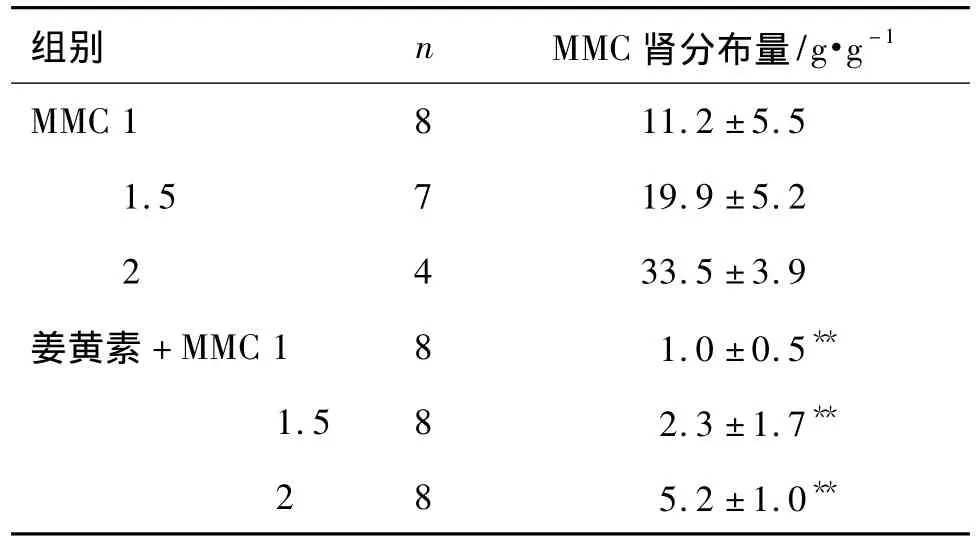
表5 姜黄素对MMC在BALB/c裸鼠肾分布量的影响Tab.5 Effect of curcumin on MMC distribution in BALB/c nude kidneys of mice
3 讨论
本实验结果显示MMC 2 mg·kg-1抑制了MCF-7细胞异种移植瘤裸鼠体内肿瘤的生长,然而其也表现了实验动物致死的毒性,该组实验动物死亡一半,且余下的一半的实验动物也表现出了明显的毒性作用,如食欲缺乏,体质量减轻,出现了明显的肾功能损伤。姜黄素 100 mg·kg-1与 MMC 1.5 mg·kg-1联合用药组实验动物全部存活,且降低了MMC的用药剂量,逆转了MMC引起的肾功能损伤,提高了实验动物的生存率和生存质量。研究发现,MMC单独处理 MCF-7 细胞的 IC50浓度为 5 μmol·L-1,将其与IC50浓度的姜黄素联合应用时,其IC50浓度降至1.5 μmol·L-1。可见,姜黄素与 MMC 联合用药后MMC达到相同的半数抑制效应的浓度显著降低,我们将进一步探讨姜黄素与MMC联合应用对肾原代细胞生长的影响与毒性。
肾代谢药物的能力不仅与药物消除速度有关,而且与药物或毒物肾内浓度有关[8]。化疗药物在靶器官的浓聚,会增加其对靶器官的损伤,造成不良反应。本研究发现,姜黄素与不同剂量MMC联合用药在减轻肾功能损伤的同时,肾组织中检测到的MMC的含量明显低于MMC组,提示姜黄素能显著降低MMC肾中的分布水平,这可能是姜黄素改善MMC肾毒性的原因之一。
本研究表明,姜黄素可以减少MMC抑制肿瘤的用药量,并能够通过减少MMC在肾的分布,降低肾毒性,为中西药结合治疗肿瘤的增效减毒研究提供思路和实验依据。
[1] Kim KH,Park HY,Nam JH,Park JE,Kim JY,Park MI,et al.The inhibitory effect of curcumin on the growth of human colon cancer cells(HT-29,WiDr)in vitro[J].Korean J Gastroenterol,2005,45(4):277-284.
[2] 李昱辰,仲来福.姜黄素对顺铂所致大鼠肾毒性的防护作用[J].毒理学杂志,2006,20(2):91-93.
[3] Zhou QM,Zhang H,Lu YY,Wang XF,Su SB.Curcumin reduced the side effects of mitomycin C by inhibiting GRP58-mediated DNA cross-linking in MCF-7 breast cancer xenografts[J].Cancer Sci,2009,100(11):2040-2045.
[4] Volpato M, Seargent J, Loadman PM, Phillips RM.Formation of DNA interstrand cross-links as a marker of mitomycin C bioreductive activation and chemosensitivity[J].Eur J Cancer,2005,41(9):1331-1338.
[5] Wu HI,Brown JA,Dorie MJ,Lazzeroni L,Brown JM.Genome-wide identification of genes conferring resistance to the anticancer agents cisplatin,oxaliplatin,and mitomycin C[J].Cancer Res,2004,64(11):3940-3948.
[6] Campbell FC,Collett GP.Chemopreventive properties of curcumin[J].Future Oncol,2005,1(3):405-414.
[7] Navis I, Sriganth P, Premalatha B. Dietary curcumin with cisplatin administration modulatestumour marker indices in experimental fibrosarcoma[J].Pharmacol Res,1999,39(3):175-179.
[8] 苏成业.肾脏的药物代谢与肾脏病时药代动力学的改变[J].中国临床药理学杂志,1986,2(4):244-250.

