雌激素的神经保护机制
胡佳丽(综述),高霄飞(审校)
(1.第二军医大学临床医学八年制2005级,上海 200433;2.第二军医大学神经生物学教研室,上海 200433)
1923 年Allen Doisy Bioassy发现了一类十八碳固醇激素,命名为雌激素。雌激素是由卵巢、睾丸、胎盘或肾上腺皮质所产生,其不仅有促进和维持女性生殖器官和第二性征的生理作用,并对内分泌系统、机体的代谢、骨骼的生长和成熟、皮肤等各方面均有明显的影响。近10年来雌激素相关研究向多个方向发展,包括大脑神经系统、心血管系统等多个方面。尤其是雌激素在中枢神经系统方面的研究引起了人们的重视。大量的实验研究表明,雌激素有多方面的神经保护作用,如减轻缺血/再灌注损伤、降低兴奋性氨基酸的释放、减少自由基的形成、减轻脑缺血区脑灌注量的减少、改善记忆功能等。目前认为,雌激素神经保护作用的途径主要有以下三个方面:①雌激素通过与其核型受体结合发挥作用;②雌激素激活膜型雌激素受体,从而介导第二信使途径;③雌激素直接介导抗氧化作用。在此就以上三个方面对雌激素神经保护机制的研究进展予以综述。
1 直接基因组作用
1.1 雌激素核型受体 雌激素核型受体包括两个亚型:雌激素受体(estrogen receptor,ER)α和β。ER是甾体类激素受体,属于核受体超家族成员,有着共同的分子结构(图1):N末端A/B区,包含激素依赖的转录激活区1(ligand dependent activation function 1,AF-1),此区的基因序列和长度变化最大;C区,由两个锌指蛋白组成,与特异DNA结合,以达到转录靶基因的目的,ERα和ERβ在此区的氨基酸同源性达到97%;D区,核易位信号的关键结构域;E/F区,称为配体结合域,与雌激素的结合有关。同时该区还含有一个激素依赖的转录激活功能区2(ligand dependent activation function 2,AF-2)。ERα 和ERβ在E区的氨基酸同源性为 59%[1]。
1.2 经典的直接基因组作用 有许多研究者证实了ERα在神经保护方面具有重要的作用,而对于ERβ的研究也在进行之中,如,Wang等[2]的研究证明,ERβ基因剔除的小鼠其大脑皮质中星形胶质细胞的增殖显著减少,并且2年之后其大脑明显较正常小鼠小。在直接基因组机制中,雌激素通过以下步骤发挥其神经保护作用(图2):雌激素与ERs结合可使ERs从其与热休克蛋白形成的抑制性复合体中释放出来,引起ERs同源二聚化,然后入核。随之,ERs与目的基因增强子区的一个回文序列——雌激素反应元件(estrogen response element,ERE)结合,最终形成一个辅助性的调节复合体,作用于转录模板,引起转录的激活或抑制。通过这种作用途径,雌激素可以发挥以下三大作用:①调节结构基因的表达。雌激素可以增加微管相关蛋白的表达促进微管蛋白的聚合以及增加微管的稳定性[3]。微管是神经元骨架的重要成分,参与细胞收缩、伪足运动和胞内运输。正常的微管组装及其动力学可维持中枢神经功能的稳定,微管聚合作用下降可导致脑功能损伤。②对抗凋亡基因的表达。Bcl-2和Bcl-xL是凋亡的抑制因子,而Bax、Bcl-xL/Bcl-2相关促凋亡基因(Bcl-xL/Bcl-2 associated death promotor,Bad)、Bcl-xS是凋亡的增强因子。有研究表明,在海马神经元培养基中加入 β淀粉样蛋白 B(β-amyloid protein B,Aβ)25~35片段,发现雌激素预处理组的存活神经元数量明显多于对照组,抗凋亡蛋白Bcl-xL水平显著升高,Aβ引起肌动蛋白-酶介导的神经丝蛋白降解产物的降解明显抑制,这表明雌激素可能通过上调Bcl-xL的表达来对抗Aβ的致凋亡作用[4]。另外,Dubal等[5]在动物脑缺血模型中还发现,雌激素能明显减轻脑缺血引起的抗凋亡蛋白Bcl-2表达减少,同时观察到ERβ/ERα比例的升高及ERβ mRNA表达的增加。由此可以得出,雌激素与胞质中的受体特别是与β亚单位结合成为复合物后,提高Bcl-xL/Bcl-2家族的转录水平,促进神经细胞的生存。③可以增加神经生长因子及其受体的表达。神经生长因子通过与其特定受体TrkA或者低亲和力的神经营养素受体 p75(p75 neurotrophin receptor,p75NTR)作用进行信号转导。有实验发现,在神经生长因子和雌激素同时存在时,TrkA mRNA的表达显著增加。同样的,脑源性神经营养因子通过与其特定受体TrkB或者低亲和力受体p75NTR作用进行信号转导。研究发现,脑源性神经营养因子的水平随着雌激素周期而变化,卵巢切除的雌性大鼠其海马和皮质的脑源性神经营养因子mRNA的水平也下降[6]。这些都提示雌激素可以增加神经生长因子及其受体的表达,从而对神经元起到保护作用。
但是,仍然有许多无法用经典基因组机制解释的现象存在:①胞内钙离子浓度增高会引起氧化应激和脂类过氧化,导致神经元死亡。雌激素可以快速降低钙内流的速度,而经典的基因机制作用于基因转录水平,其速度较慢。②使用核型雌激素受体拮抗剂后,依然能观察到雌激素发挥其神经保护作用,表明雌激素的作用不受雌激素核型受体拮抗剂的影响。③在mRNA和蛋白合成抑制剂存在的条件下,雌激素依然有神经细胞保护作用。这些现象表明,雌激素发挥其神经保护作用不仅仅是通过经典直接基因组机制,必定还存在其他途径。
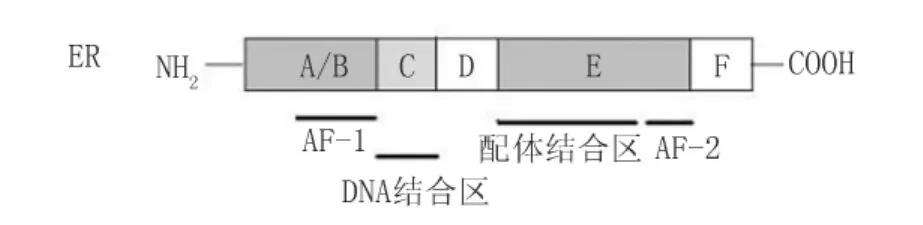
图1 ER结构示意图[1]
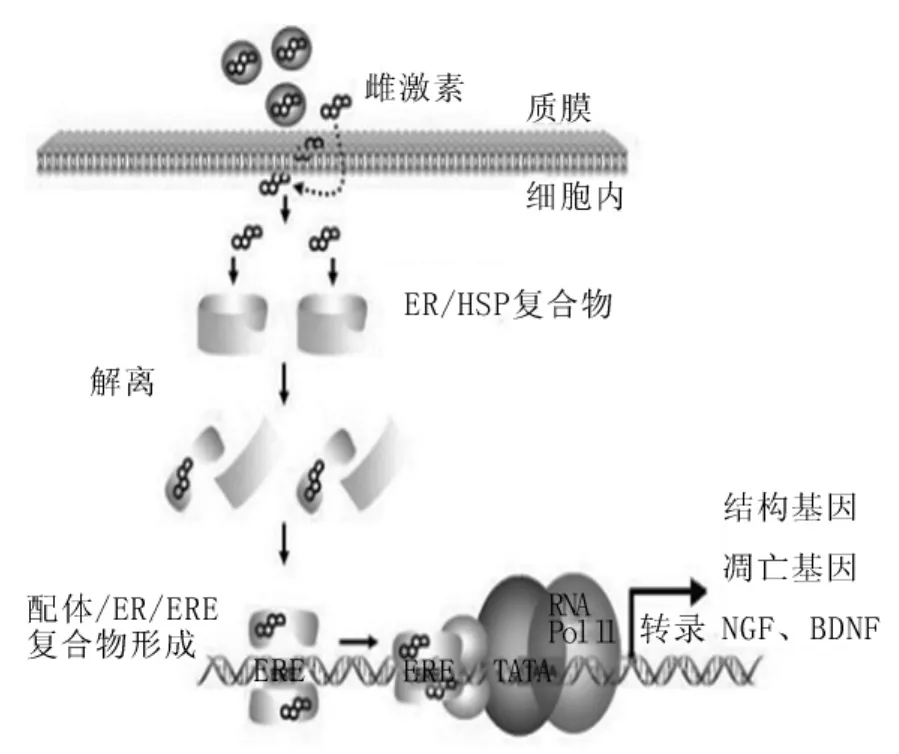
图2 经典的基因组机制示意图[7]
2 间接基因组作用
2.1 膜型受体(membrane estrogen receptor,mER)1977年Pietras和 Szego首次发现质膜上有种能对17-β雌二醇起快速反应的物质,由此提出了mER这一新概念。但直至今日,对于mER的具体结构还存在许多争议。目前,主要有以下几种观点:①1980年和1999 年,Sadler等[8]和Razandi等[9]先后在膜表面发现ERα及ERβ也有表达。因此认为,ERα和ERβ不仅可以作为雌激素的核型受体,还能作为膜型受体。在海马神经元,雌激素与膜ERα结合后,激活代谢型谷氨酸受体,继而使有丝分裂原蛋白激酶(mitogen-activated protein kinases,MAPK)依赖的 cAMP 反应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化,从而引起一系列反应。②1999年,Rarandi等[9]提出一种观点,认为mER是经典ER的变异体。③Toran-Allerand等[10]提出了第三种膜相关受体ER-X。雌激素与ER-X结合,诱导细胞外信号调节激酶1(extracellular signal-regulated kinase 1,ERK1)和细胞外信号调节激酶2(extracellular signalregulated kinase 2,ERK2)的苏氨酸磷酸化,但雌激素的这种诱导作用不能被ER拮抗剂氟维司群(fulvestrant,ICI182,780)所拮抗,因此认为ER-X是一种ICI不敏感的 ER[11]。Toran-Allerand曾讨论ER是否是由热休克蛋白900、各种信号激酶甚至淀粉样前体蛋白组成的多分子复合物。④最近的研究认为,mER是一种 G蛋白耦联的受体,而且认为该受体为GPR30。虽然对于GPR30位于细胞膜还是内质网存在争论,但证实GPR30能介导快速信号转导途径,也能调控基因转录[12]。实验表明,虽然雌激素介导的磷脂酰肌醇3激酶(phosphonionsitid-3 kinase,PI3K)途径能被ERα所介导,但此途径也能由GPR30所介导。在某些情况下,ERα和GRP30都是必需的,但当ERα缺乏时,GPR30能替代ERα介导雌激素依赖的效应。在另外一些情况下,GPR30是ERα的拮抗剂。⑤还有一种观点认为mER是STX-结合蛋白,此蛋白通过减少促性腺激素释放激素神经元上β-内啡肽和氨酪酸突触,导致兴奋性降低,从而调控促性腺激素释放激素的分泌[13]。关于mER的真实结构存在不小的分歧,需要人们进一步去探索。
2.2 快速信号转导机制
2.2.1 ERK/MAPK和CREB 雌激素可通过ERK/MAPK信号通路发挥重要作用。雌激素结合膜受体,通过下游分子 Src、Ras、Raf、Mek级联快速激活ERK。MAPK被激活后,引起CREB磷酸化,从而引起基因表达的改变。例如,MAPK激活后使蛋白激酶C活化,继而通过佛波醇使得分泌型淀粉样前体蛋白α的含量增加,从而导致Aβ生成的减少。除此之外,MAPK还是糖原合成激酶3β的抑制剂。MAPK可以使糖原合成激酶3β的第九位的丝氨酸残基磷酸化,从而抑制其活性,促使分泌型淀粉样前体蛋白生成增加[14]。Aβ具有神经毒作用,能诱导神经元的死亡、胞内钙超载、自由基产生等。Aβ的沉积能诱发和加重阿尔茨海默病。雌激素可通过ERK/MAPK信号通路减少Aβ的沉积,起到神经保护作用。
除了ERK/MAPK途径外,人们还发现在雌激素神经保护过程中丝氨酸-苏氨酸蛋白激酶(serine/threonine kinase,Akt)/蛋白激酶 B(protein kinase B,PKB)途径也发挥了重要作用。
2.2.2 PI3K/Akt 研究认为,脑缺血后与细胞凋亡有关的信号转导通路主要为MAPK和PI3K/Akt信号通路。目前认为信号通路在细胞凋亡过程中有双重的作用,而PI3K/Akt信号通路是重要的细胞存活信号通路。王志敏等[15]研究发现,在缺血/再灌注大鼠模型中,PI3K/Akt信号通路参与了脑缺血的病理过程且与脑缺血损伤程度有关。Akt活化后能经多种途径发挥神经保护作用,其机制主要有:①通过直接或间接影响CREB发挥细胞存活调控作用。Pugazhenthi等[16]证实,雌激素通过激活 Akt/PKB 途径,从而使CREB磷酸化,最终增加Bcl-2的表达,起到神经保护的作用。同时,CREB还能提高脑源性神经营养因子的表达。②促使凋亡相关因子,如caspase-9、Bad磷酸化而失活,抑制其促凋亡作用。在中脑神经元中,雌激素能使Akt磷酸化,继而下调caspase-9及 Bad的表达,起到神经保护作用[17]。③抑制糖原合成酶激酶3的活性,使糖原合成酶激酶3失活而阻止凋亡发生[18]。④调控转录因子家族核因子κB,从而提高抗凋亡蛋白Bcl-xL和Bcl-2的表达[19]。
3 抗氧化作用
多种因素(如谷氨酸、过氧化氢、淀粉样蛋白等)均可引起氧化应激,使生物膜结构中不饱和脂肪酸发生脂质过氧化反应,磷脂被降解,膜结构变性失能,由此引起细胞死亡。许多研究认为,雌激素能通过对抗氧化作用来实现神经保护。Behl[20]在用β淀粉样蛋白、谷氨酸、过氧化氢处理的大鼠神经细胞培养液中加入雌激素,以观察其对氧化应激诱导的神经细胞死亡的保护作用。结果发现,雌激素及一些雌激素诱导剂均可阻止过氧化物的积聚,从而保护神经细胞免受上述物质的损害。Behl等[21]进一步证实,这种雌激素的抗氧化效应不能被雌激素受体拮抗剂三苯氧胺所阻断,抗氧化特性与雌激素受体及甾体结构无关,而在于分子A链C3位羟基,既通过结构-活性关系实现抗氧化作用。此外,雌激素的代谢产物儿茶酚雌激素也具有很强的抗氧化活性作用。雌激素还可促进超氧歧化酶的表达及激活,而超氧歧化酶是体内重要的抗氧化酶。
4 展望
雌激素通过多种方式发挥其神经保护的作用。它能抵抗细胞凋亡,增加神经生长因子及其受体的表达、抗氧化、抗炎症等,对阿尔茨海默病、帕金森病、脑膜瘤、多发性硬化、自身免疫性脊髓炎等神经系统疾病的治疗提供了新的方法[22]。但是,在雌激素展示其强大功能的同时,尚有许多问题需要解决。不同雌激素受体分子机制有何差异及如何互相作用、是否还有未发现的雌激素作用机制等,这些问题都有待进一步研究。
[1]蔡晶,曹治云,杜建.雌激素受体的基因结构、组织分布及表达量的研究进展[J].中国老年学杂志,2007,27(24):2468-2471.
[2]Wang L,Anderson S,Wamer M,et al.Morphological abnormalities in the brains of estrogen receptor bata knockout mice[J].Proc Natl Acad Sci USA,2001,98(5):2792-2796.
[3]Benitez-King G,Ramirez-Rodriguez G,Ortiz L,et al.The neuronal cytoskeleton as a potential therapeutical target in neurodegenerative diseases and schizophrenia[J].Curr Drug Targets CNS Neurol Disord,2004,3(6):515-533.
[4]Pike CJ.Estrogen modulates neuronal Bc1-xL expression and betaamylold-induced apoptotis:relevance to Alzheimer's disease[J].Neurochem,1999,72(4):1552-1563.
[5]Dubal DB,Shughrue PJ,Wilson ME,et al.Estradiol modulates Bcl-2 in cerebral ischemia:a potential role for estrogen receptors[J].Neurosci,1999,19(15):6385-6393.
[6]张馨,周建军,徐运.雌激素脑保护的基因和非基因机制学说[J].中国临床康复,2005,9(5):143-145.
[7]Belcher SM.Rapid signaling mechanisms of estrogens in the developing cerebellum[J].Brain Res Rev,2008,57(2):481-492.
[8]Sadler SE,Maller JL.Identification of asteroid receptor on the surface of enopusoocytes by photoaffinity labeling[J].J Biol Chem,1982,257(1):355-361.
[9]Razandi M,Pedram A,Greene GL,et al.Cell membrane and nuclear estrogen receptors(ERs)originate from a single transcript:studies of ER alpha and ER beta expressed in Chinese hamster ovary cells[J].Mol Endocrinol,1999,13(2):307-319.
[10]Toran-Allerand CD.On the genesis of sexual differentiation of the general nervous system:morphogenetic consequences of sleroidal exposure and possible role of alpha-fetoprotein[J].Prog Brain Res,1984(61):63-98.
[11]VToran-Allerand CD.Minireview:a plethora of estrogen receptors in the brain:Where will it end?[J].Endocrinology,2004,145(3):1069-1074.
[12]Kelly MJ,Rønnekleiv OK.Control of CNS neuronal excitability by estrogens via membrane-initiated signaling[J].Mol Cell Endocrinol,2009,308(1/2):17-25.
[13]Micevych P,Dominguez R.Membrane estradiol signaling in the brain[J].Neuroendocrinology,2009,30(3):315-327.
[14]Goodenough S,Schafer M,Behl C.Estrogen-induced cell signalling in a cellular model of Alzheimer's disease[J].Steroid Bwchem Mol Biol,2003,84(2/3):301-305.
[15]王志敏,杨玉欣,孙丽红,等.PKB/AKT与脑缺血神经细胞凋亡的研究[J].医学研究杂志,2008,37(7):68-70.
[16]Pugazhenthi S,Nesterova A,Sable C,et al.Akt/protein kinase B up-regulates Bcl-2 expression through cAMP-response elementbinding protein[J].J Biol Chem,2000,275(15):10761-10766.
[17]Beyer C,Ivanova T,Karolczak M,et al.Cell type-specificity of nonclassical estrogen signaling in the developing midbrain[J].J Steroid Biochem Mol Biol,2002,81(4/5):319-325.
[18]Enguita M,DeGregorio-Rocasolano N,Abad A,et al.Glycogen synthase kinase 3 activity mediates neuronal pentraxin 1 expression and cell death induced by potassium deprivation in cerebellar granule cells[J].Mol Pharmacol,2005,67(4):1237-1246.
[19]Vegeto E,Benedusi V,Maggi A.Esteogen anti-inflammatory activity in brain:a therapeutic opportunity for menopause and neurodegenerative diseases[J].Front Neuroendocrinol,2008,29(4):507-519.
[20]Behl C.Oestrogen as a neuroprotective hormone[J].Nat Rev Neurosci,2002,3(6):433-442.
[21]Behl C,Skutella T,Lezoualc'h F,et al.Neuroprotection against oxidative stress by estrogens:structure-activity relationship[J].Mol Pharmacol,1997,51(4):535-541.
[22]Tomassini V,Pozzilli C.Sex hormones,brain damage and clinical course of Multiple Sclerosis[J].J Neurol Sci,2009,286(1/2):35-39.

