华支睾吸虫GST2-TP22.3融合蛋白的构建及其免疫原性初步研究*
李彩霞,王慧玲,胡旭初,余新炳
2.广东省人民医院肝胆外科,广州 510080
3.中山大学中山医学院寄生虫学教研室,广州 510080
华支睾吸虫(Clonorchis sinensis)又称肝吸虫(liver fluke),其寄生在人体肝胆管内所引起的以肝胆病变为主的疾病称为华支睾吸虫病(clonorchiasis),又称肝吸虫病,是我国主要的食源性寄生虫病之一[1]。2005年,华支睾吸虫病被广东省政府列为重点防治的地方病。2006年,华支睾吸虫病被卫生部列为我国重点防治的寄生虫病之一,因此,加强对华支睾吸虫病的诊断和防治工作是目前的当务之急。
目前华支睾吸虫病的诊断主要依靠病原学检查和免疫学检查。传统的病原学方法是镜检粪便中的虫卵,由于华支睾吸虫排卵具有周期性且虫卵很小,容易漏诊,且操作费时费力,不适合流行病学调查;免疫学诊断的抗原主要是成虫粗抗原,但粗抗原制备困难,来源有限,且交叉反应较严重。寻找高敏感性和高特异性的抗原成分,是解决华支睾吸虫病早期快速准确诊断的关键。
有研究发现华支睾吸虫成虫谷胱甘肽转移酶2(C.sinensis cy tosolic 28-kDaG lutathione transferases,Cs GST2)对华支睾吸虫病具有重要诊断价值[2],但其敏感性不甚理想。华支睾吸虫表膜相关蛋白能引起显著的免疫保护,有良好的免疫原性,被视为潜在的诊断抗原[3]。本研究将华支睾吸虫GST2和表膜相关蛋白编码基因TP22.3先后克隆至原核表达载体pET32a(+),构建融合蛋白,获得了高效表达并已纯化,初步证明具有良好的免疫原性,为进一步研究其免疫反应性以及作为诊断抗原价值奠定基础。
1 材料与方法
1.1 材料
1.1.1 文库,质粒,菌株 华支睾吸虫成虫从市场购买的新鲜猫肝获得,华支睾吸虫成虫cDNA质粒文库由本室构建,其克隆载体为pBluescriptⅡSK的改造载体(即Eco RⅠ和NotⅠ之间的序列改造为S f iⅠA和S f iⅠB接头序列)由上海联众科技研究院完成,大肠杆菌DH 5α、BL21及原核表达质粒pET32a(+)为本室常规保存。
1.1.2 实验动物 清洁级SD雄性大鼠(5~7 w),由中山大学实验动物中心提供。
1.1.3 主要试剂和工具酶 Ex Taq酶(含dN TP),Eco R Ⅰ,SaLⅠ,K pnⅠ,Bam HⅠ和T4 DNA连接酶,DNA分子量标准(DL15 000,DL2 000)均购自TAKARA公司;异丙硫代-β-D半乳糖苷(IPTG),购自美国Promega公司;Ni-IDA Agarose(cat No:69670)购自美国Novagen公司;蛋白分子量标准购自立陶宛MBI公司;DNA凝胶回收试剂盒,质粒纯化试剂盒购自北京赛百盛基因公司;辣根过氧化物酶标记的山羊抗大鼠IgG、DAB(3,3二氨基联苯胺)显色试剂盒均购自武汉博士德生物工程有限公司;PVDF膜购自Millipore公司;弗氏完全佐剂和弗氏不完全佐剂均购自美国Sigma公司;TMB显色试剂盒购自美国BD公司。
1.2 方法
1.2.1 基因识别和引物合成 将获得的华支睾成虫unigene进行Blastx分析,从中选取华支睾吸虫GST2基因以及一个表膜相关蛋白基因(质粒编号为18D11),后者根据其分子量大小暂命名为华支睾吸虫22.3kDa表膜相关蛋白(Cs TP22.3)。利用DNA club和 PCRdesign软件,根据 Cs GST2、Cs TP22.3及pET32a(+)特异性酶切位点设计4条引物:Cs GST2上游引物 P1引入保护性碱基GCA和K pnⅠ酶切位点,下游引物P2删除中止密码子TGA,引入保护性碱基ATA和Bam HⅠ酶切位点;Cs TP22.3上游引物P3引入保护性碱基CGGC和EcoR I酶切位点,下游引物P4加入保护性碱基AAAC和SaLⅠ酶切位点。
P1:5′-GCAGGTACCATGAAACACAGACA -3′;P2:5′- ATAGGATCCCAGGACGGTCTCT-3′;P3:5′-CGGCGAATTCATGTGCGCGCTT-3′;P4:5′-AAACGTCGACTCATACCCACGGT-3′。引物由上海英俊生物技术有限公司合成。
1.2.2 基因PCR扩增及鉴定 分别以P1、P2和P3、P4为引物,PCR扩增Cs GST2和Cs TP22.3基因片段。Cs GST2反应条件:预变性,95℃,3min;变性,94℃,1min;退火,57℃,50s;延伸 72℃,1min;30个循环。最后再72℃延伸8min。Cs TP22.3反应条件:预变性,94℃,5min;变性,94℃,30s;退火,56℃,30 s;延伸,72℃,90 s;35个循环。最后再72℃延伸8min。分别取PCR产物用1.2%琼脂糖凝胶电泳鉴定。
1.2.3 重组质粒pET32a(+)-Cs GST2-Cs TP22.3构建及鉴定 将Cs GST2基因扩增产物和质粒pET32a(+)经K pnⅠ和Bam HⅠ双酶切后回收,连接,构建重组pET32a(+)-CS GST2质粒,经鉴定后,将Cs TP22.3基因扩增产物分别以Eco RI和SaLⅠ双酶切,与同样经双酶切的pET32a(+)-Cs GST2连接,构建重组质粒pET32a(+)-Cs GST2-Cs TP22.3。转化感受态大肠杆菌BL21/DE3,经鉴定重组成功后,将此菌接种于5m L LB培养液(含氨苄青霉素)37℃振摇过夜培养,分别取2m L菌液抽提质粒送测序鉴定及10μL重新接种入LB培养液(含氨苄青霉素)37℃振摇培养至 OD600=0.6,加入 IPTG至终浓度为1mm ol/L。37℃诱导表达4h后离心收集沉淀,加入1×SDS上样缓冲液100μL,煮沸5min。取10μL裂解上清作12%SDS-PAGE电泳。同时设pET32a(+)质粒的诱导前后及重组质粒的诱导前做对照。
1.2.4 重组pET32a(+)-Cs GST2-Cs TP22.3融合蛋白的纯化 大量培养、诱导表达、离心收集菌体(方法与1.2.3相同)。超声破菌后 4°C离心13 000r/min×20min,收集包涵体沉淀。分别用0.15m ol/L的PBS、含2m ol/L尿素的PBS重悬包涵体、离心弃上清,然后将包涵体用含6mol/L尿素的PBS溶解变性后,离心收集上清,用0.45μm 滤膜过滤,参照Ni-IDA Agarose说明书,进行蛋白纯化,收集蛋白洗脱液。将蛋白洗脱液于0.15mol/L的PBS(p H 7.4)中透析24h。
1.2.5 免疫大鼠血清的预吸附 取一个经pET-32a(+)质粒转化的BL21/DE3单菌落,按照1.2.3方法培养1 000m L含pET-32a(+)质粒的大肠杆菌菌液,4℃、8 000r/min离心 20min,上清弃去,加入10m L PBS重悬沉淀菌体后冰上超声破碎,4℃、13 000 r/min离心20 min,收集上清即 pET-32a(+)表达后BL21/DE3裂解液,-20℃保存备用。将1.2.4中pET32a(+)-Cs GST2-Cs TP22.3融合蛋白纯化产物按照常规方法免疫SD大鼠,制备抗血清。将上述100μL大鼠血清中加入上述裂解液900μL,于4℃平缓摇振过夜。4℃、13 000 r/min离心20 min,收集上清。上清液再按1∶5比例加入以上裂解液,4℃平缓摇振过夜。4℃、13 000 r/min离心 20 min,收集上清,分装成小份,-20℃备用。
1.2.6 Western b lotting检测重组蛋白的免疫原性 将纯化后的融合蛋白SDS-PAGE(12%)电泳完毕后采用半干电转移方式,将蛋白条带转移至PVDF膜上。分别以1.2.5中处理过的免疫大鼠血清为一抗、1∶2000稀释的羊抗大鼠IgG为二抗作用后,DAB显色至出现目的条带,去离子水终止反应。
2 结 果
2.1 重组 pET32a(+)-Cs GST2-Cs TP22.3质粒的鉴定 重组质粒pET32a(+)-Cs GST2及重组质粒pET32a(+)-Cs GST2-Cs TP22.3酶切鉴定结果正确,见图1和图2。
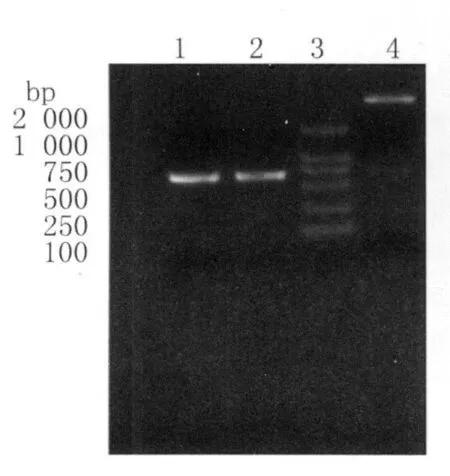
图1 pET-32a(+)-Cs GST2重组质粒的PCR及双酶切鉴定图Fig.1 The identification of the pET-32a(+)-Cs GST2 by PCR amplification and digestion with restriction enzymes
2.2 重组 pET32a(+)-Cs GST2-Cs TP22.3融合蛋白的表达、纯化 SDS-PAGE证实在IPTG诱导下,将表达菌体进行超声破碎后,经离子交换柱进行纯化后获得了纯度较高的融合蛋白,在分子量大小约 62kDa处有一明显蛋白表达条带,与重组pET32a(+)-Cs GST2-Cs TP22.3融合蛋白的分子量大小一致,在其下方亦出现若干较弱蛋白表达条带,分析可能为融合蛋白降解所致(见图3)。
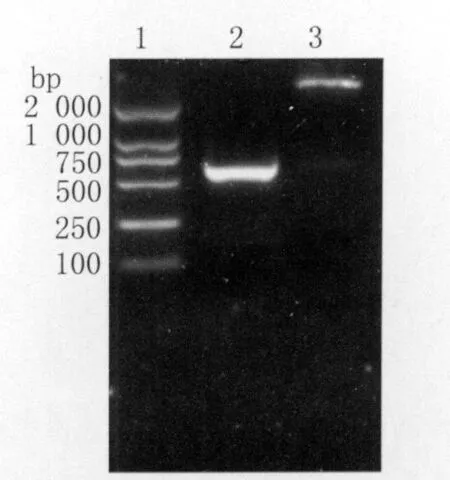
图2 pET-32a(+)-Cs GST2-Cs TP22.3重组质粒的PCR及双酶切鉴定图Fig.2 The identification of the pET-32a(+)-Cs GST 2-Cs TP22.3 by PCR amplification and digestion with restriction enzyme

图3 融合蛋白pET32a(+)-Cs GST2-Cs TP22.3的表达及纯化Fig.3 Expression and purification of pET-32a(+)-Cs GST 2-Cs TP22.3
2.3 Western b lotting鉴定其免疫原性 经Western blotting鉴定发现,免疫大鼠血清能识别相对分子量为62kDa大小的反应条带,与预期值相符。而含空质粒的大肠杆菌样品及阴性鼠血清无任何反应带出现,证实了该表达蛋白具有良好的免疫原性(图4)。
3 讨 论
目前,有关华支睾吸虫的生长发育、致病机制以及高效快速诊断方法的研究正在逐步进行,这些研究的全面开展对华支睾吸虫病的防治具有重要意义。传统的病原学诊断因华支睾吸虫排卵的周期性及虫卵比较小,容易漏诊,不适合大规模的流行病学调查。华支睾吸虫抗原种类多而复杂,在宿主体内表达的数量、种类或时机可能随病人的个体免疫背景和病程而异,因此,使用单一抗原进行检测可能会导致敏感性低。因此对华支睾吸虫病的血清学检测,尚未发现敏感性与特异性均较满意的检测抗原。但随着基因工程技术的发展,可依据需要对基因进行剪切、连接等可提高诊断的敏感性和特异性[4],这也是诊断试剂研制的发展方向。
图4 纯化产物被该蛋白免疫的大鼠血清识别Fig.4 The recombinant protein recognized by antisera of SD rat1:Protein marker,2:the purified product of pET-32a(+)with antisera of SD rat,3:The recombinant protein recognized by normal serum of SD rat,4:The recombinant protein recognized by antiseraof SD rat
虫体表膜抗原因与宿主直接接触产生致敏作用,诱发宿主产生免疫应答,并产生保护性免疫力,所以这类抗原在寄生虫感染免疫中倍受重视[5-6],如日本血吸虫表膜相关抗原在血吸虫病疫苗发展和免疫诊断方面起重要作用[7]。华支睾吸虫表膜蛋白(TP22.3)存在于囊蚴和成虫等各期的表膜上,与宿主直接接触,引起宿主较强免疫反应[3],有较高的诊断价值。但进一步研究却发现,表膜蛋白在溶液中不稳定,易降解,严重限制了其作为诊断抗原价值。有报道指出采用融合谷胱甘肽转移酶(GST)标签的原核表达策略,可增加重组蛋白的稳定性[8]。GST是广泛存在于各种生物体内的由多个基因编码的、具有多功能的同工酶,谷胱甘肽转移酶2是华支睾吸虫疫苗理想的候选抗原,且对华支睾吸虫病也具有重要诊断价值 ,但其敏感性仍不甚理想。因此,将GST2和TP22.3构建重组融合蛋白,可望成为诊断华支睾吸虫感染的理想抗原。
在Cs GST2和Cs TP22.3的连接方面,本研究应用传统的基因重组技术,选取特异性的限制性内切酶,成功的将Cs TP22.3和Cs GST2两种华支睾吸虫特异性抗原先后克隆至同一载体 pET-32a(+),充分保持了基因的连续性和完整性,使各个蛋白能够较大程度地保持其原有的生物活性,既增加了Cs TP22.3的稳定性,又可以兼具两种重组蛋白的免疫优势和抗原特性,在保证特异性的基础上提高检测灵敏度。
为了除去可能存在的抗大肠杆菌其它蛋白的抗体和抗pET32a(+)中his标签蛋白的抗体,尽可能消除使用大鼠血清进行免疫原性检测时可能产生的背景,我们首先将血清与转入了pET32a(+)的大肠杆菌BL21/DE3的裂解上清进行反复吸附,从图4可以看出来,我们采取的这种血清吸附方法效果比较理想。后续试验将使用肠激酶切除pET32a(+)质粒上的 his标签蛋白,以获得 Cs GST2-Cs TP22.3融合蛋白,为进一步研究其免疫反应性以及作为诊断抗原价值奠定基础。
[1]吴德,余新炳,吴忠道.华支睾吸虫的流行概况[J].热带医学杂志,2002,2:277-279.
[2]孙颜涛,彭鸿娟.华支睾吸虫病的免疫学诊断研究进展.国外医学寄生虫分册[J].2003,30(5):210-214.
[3]Zhou ZW,Xia H,H u XC,Oraladministration of a Bacillus subtilis spore-based vaccine expressing C lonorchissinensis tegumentalprotein 22.3 kDa confers protection against Clonorchis sinensis[J].Vaccine,2008,26:1817-1825.
[4]Yong TS,Yang HJ,Park SJ,et al.Immunodiagnosis of clonorchiasis using a recombinan t antigen[J].Korean J Parasitol,1998,36(3):183-190.
[5]Trudgett A,McNair AT,H oey EM,et al.Them ajor tegumentalantigen of Fasciola hepatica contains repeated elem ents[J].Parasitology,2000,121(2):185-191.
[6]Loukas A,Tran M,Pearson MS.Schistosom ememb rane proteins as vaccines[J].Int JParasitol,2007,37:257-263.
[7]Moham ed MM,Shalaby KA,LoVerde PT,et al.Characterization of Sm20.8,am ember of a fam ily of Schistosome tegumen tal antigens[J].Mol Biochem Parasitol,1998,30:15-25.
[8]周宇荀,魏东芝,王二力.融合蛋白表达载体pGEX及其应用[J].生命科学,1998,10:122-124.

