黑虎掌菌多糖的组成和抗肿瘤活性*
陈健 张灵芝 韦丁 徐晓飞
(华南理工大学轻工与食品学院,广东广州510640)
黑虎掌菌,学名翘鳞肉齿菌(Sarcodon imbricatus),该菌菌体上长满一层细茸毛,呈黄褐色,并有明显的黑色花纹,形同虎爪,因而得名.国外主要分布于日本、德国,国内主要分布于云南、西藏等地.我国具有长期采集食用黑虎掌菌的历史,民间还有用它入药的记录[1].黑虎掌菌在历史上被视为名贵山珍,是历代宫廷喜爱的贡品之一[2].
国际上,多糖被称为“生物应答效应物”,能增强人体的免疫功能,对肿瘤的生长有一定的抑制作用.目前最常用的体外抗肿瘤药物筛选方法有3种,分别是四甲基偶氮唑盐(MTT)微量酶反应比色法、四唑氮衍生物(XTT)法和磺基罗丹明B(SRB)法,其中MTT法实验周期短,所需细胞数目较少,所得资料较准确,是药物筛选的主要手段[3].
目前对黑虎掌菌多糖的研究很少,特别是关于纯化多糖抗肿瘤活性的研究鲜见报道.文中分析了两种黑虎掌菌子实体纯化多糖的光谱特征及单糖组成,评价了它们在体外的抗肿瘤活性,以期为黑虎掌菌子实体多糖的开发利用提供科学依据.
1 实验部分
1.1 材料及仪器
主要实验材料如下:黑虎掌菌,购于广州一德路干货市场;D354FD树脂,广州市广联津化工有限公司生产;单糖标准品葡萄糖、岩藻糖、木糖、甘露糖及半乳糖,美国Sigma公司生产;Whatman DEAE-52,广州展晨生物科技有限公司进口分装;Sepharose CL-6B,美国 Pharmacia公司生产;完全RPMI-1640培养基、MTT细胞增殖及细胞毒性检测试剂盒,南京凯基生物公司生产;其它试剂均为国产分析纯.
主要实验仪器如下:DZTW型调温电热套,北京市永光明医疗仪器厂生产;旋转蒸发仪,上海亚荣生化仪器生产;721-P型分光光度计,上海现科仪器有限公司生产;BT-200型恒流泵、DBS-100型自动部分收集器,上海沪西仪器厂生产;冷冻干燥系统、3543型培养箱,美国 Thermo公司生产;Vector 33型傅里叶变换红外光谱仪,德国Bruck公司生产;液相色谱系统,美国Waters公司生产;气相色谱系统,美国Aglient公司生产;680型酶标仪,美国伯乐公司生产;CK40-F200型倒置显微镜,日本Olympus公司生产.
1.2 黑虎掌菌多糖的分离纯化工艺
黑虎掌菌子实体干品用95%(体积分数,余同)的乙醇回流提取3次,混合物过滤,残渣用热水回流提取3次,混合物抽滤,滤液合并后减压浓缩,添加无水乙醇至乙醇含量为75%,于4℃冰箱过夜,混合液于4 000 r/min离心15 min,沉淀复溶,将糖液和Sevage试剂(三氯甲烷/正丁醇体积比为5∶1)混合,两者体积比为5∶1,震荡20min,离心,取上部糖液添加D354FD树脂脱色,经过脱色的糖液透析后减压浓缩,浓缩液过DEAE-52阴离子柱层析,收集洗脱液并浓缩,透析,之后过Sepharose CL-6B凝胶柱层析,收集洗脱液并浓缩,透析,最后冷冻干燥得到两种多糖SIPa和SIPb.
1.3 SIPa和SIPb的相对分子质量测定
SIPa和SIPb的均一程度和相对分子质量用高效凝胶渗透色谱测定.样品配制成1 g/L的水溶液,用0.45μm微孔滤膜过滤后进样.色谱条件为:TSKGEL G-4000PWXL柱(7.8 mm×300 mm)与TSKGEL G-2500PWXL柱(7.8mm ×300mm)串联,流动相为0.02mol/L的KH2PO4溶液,流速为0.6mL/min,柱温为35℃.
1.4 红外光谱分析
分别取约2 mg SIPa和 SIPb,与KBr混合研细后,在4000~400cm-1范围内进行红外扫描.
1.5 单糖组成分析
多糖的水解:分别称取10 mg SIPa和SIPb放入小管中,加2 mL 2 mol/L的三氟乙酸,充氮气封管,110℃水解3 h.将水解液减压蒸干,加1.5 mL甲醇溶解,再减压蒸干,重复多次以除尽残余的三氟乙酸.
衍生化:分别往SIPa和SIPb的水解物、单糖标准品中加入10mg盐酸羟胺和1 mL吡啶,90℃水浴30min并振荡,冷却至室温,加入醋酸酐1 mL,继续于90℃水浴中保持30min,生成具有挥发性的糖腈乙酸酯衍生物.
气相色谱条件:采用 Aglient 6890N气相色谱仪、DB-1701毛细管柱(30m×0.25m×0.25μm)及氢火焰离子化检测器;高纯氮作载气,流速为1mL/min.程序升温:柱初始温度为180℃,以2℃/min升至220℃,保持 1 min,以 5℃/min升至 250℃,保持2min;进样口温度为250℃,分流比为1∶14.5,汽化室温度为250℃,检测器温度为300℃,吹扫流速为4.0mL/min.
1.6 黑虎掌菌多糖的抗肿瘤活性实验
取对数生长期的贴壁细胞,1 000 r/min离心10min,用0.25%的胰蛋白酶溶液消化后,用10%(体积分数)小牛血清的RPMI-1640培养基稀释.用玻璃滴管轻轻吹打成单细胞悬液,显微镜下用血细胞计数板计数,制成5×104个/mL的细胞悬液.
往96孔培养板中加入200μL配制好的细胞悬液,最外一层加200 μL磷酸盐缓冲液(PBS),封口,置37℃、5%(体积分数)CO2培养箱内培养24 h.倒掉原培养基,再加入180 μL培养基,分别加入不同浓度的SIPa和SIPb水溶液20 μL,以三蒸水为溶剂对照组,以不加细胞和多糖溶液的培养基为空白对照组,每组5个平行样.封口继续培养48 h,取出培养基,加PBS清洗后,每孔再加入180 μL培养基和20μL MTT,继续培养4 h.小心吸弃上清液,然后每孔加150μL二甲基亚枫,轻轻振荡使深蓝色沉淀物完全溶解,约1 h后用酶标仪测定492 nm波长下各孔吸光值,测定需减去空白对照[4].肿瘤细胞生长抑制率计算公式为

2 结果与讨论
2.1 黑虎掌菌多糖的柱层析分离纯化
多糖分子一般为中性或酸性带负电荷的大分子,因此采用阴离子交换柱层析分离黑虎掌菌多糖.
如图1所示,黑虎掌菌多糖的DEAE-52柱层析水洗脱后得到一个峰,收集6到16管;透析后再过Sepharose CL-6B凝胶柱层析,得到两个洗脱峰,8到16管收集后冷冻干燥得SIPa,17到28管为SIPb.
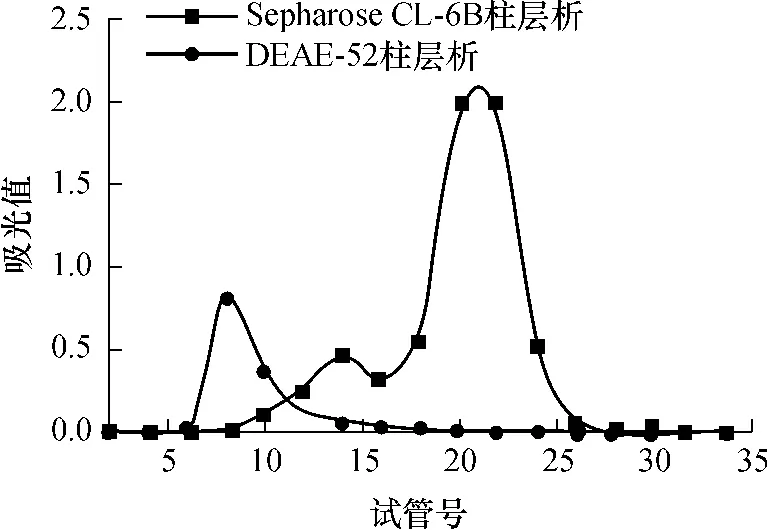
图1 黑虎掌菌多糖的柱层析图Fig.1 Elution patterns of polysaccharides from Sarcodon imbricatus with column chromatography
2.2 SIPa和SIPb的相对分子质量和纯度
图2是黑虎掌菌多糖SIPa和SIPb的高效凝胶渗透色谱图.SIPa的峰位相对分子质量为242769,重均相对分子质量Mw为2.12×105;SIPb的峰位相对分子质量为10 727,重均相对分子质量Mw为1.05 ×104.
多糖相对分子质量多分散性程度用相对分子质量分布指数D表示,即Mw/Mn,其中Mn为数均相对分子质量.D=1时,是相对分子质量均一的聚合物,D越大其相对分子质量分布越宽,多分散性程度越大[5].SIPa和 SIPb的D值分别为 1.25 和 1.10,表明SIPa、SIPb均为相对分子质量分布比较集中的多糖.此外,用凝胶柱层析法分别对SIPa和 SIPb验纯,结果如图3所示,其洗脱曲线均为单一对称峰.高效凝胶渗透色谱法和凝胶柱层析法的检测结果证明,SIPa和SIPb均为单一成分多糖.
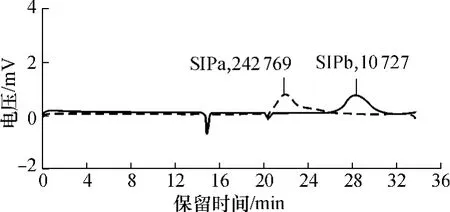
图2 SIPa和SIPb的高效凝胶渗透色谱图Fig.2 High-performance gel permeation chromatograms of SIPa and SIPb

图3 SIPa和SIPb的Sepharose CL-6B柱层析图Fig.3 Elution patterns of SIPa and SIPb on Sepharose CL-6B column
2.3 SIPa和SIPb的化学结构
SIPa和SIPb的红外吸收情况如图4所示.由图4可见:SIPa和SIPb在3410cm-1附近有强吸收,属于O—H伸缩振动的特征吸收;2930 cm-1附近的弱吸收代表CH3、CH2、CH等的C—H伸缩振动;1614cm-1附近的较强吸收以及1400~1200 cm-1的弱吸收都属于多糖的特征红外吸收[6].上述3种红外吸收都是糖类的特征吸收峰,因此可确认SIPa和SIPb均为糖类化合物.此外,1300~1000 cm-1处的吸收属于吡喃环的伸缩振动,所以SIPa和SIPb都是吡喃环结构[7].SIPa 具有 895 cm-1处的吸收,代表 C1—H竖变角振动,表示该多糖以β型吡喃糖苷为主;在异头碳区(950 ~700 cm-1)及 920、809 cm-1处的明显吸收与甘露糖的存在相对应[8],因此 SIPb含有甘露糖.
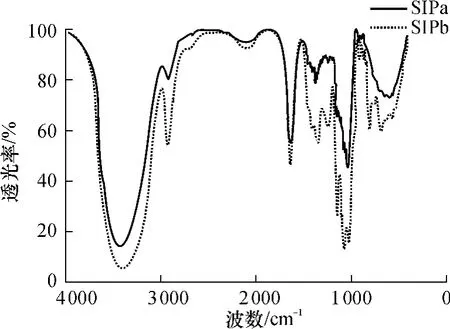
图4 SIPa和SIPb的红外光谱图Fig.4 Infrared spectra of SIPa and SIPb
2.4 SIPa和SIPb的单糖组成
菌类多糖一般是由鼠李糖、岩藻糖、甘露糖、葡萄糖、半乳糖等单糖组成,根据单糖组成情况可分为5类,即杂多糖、甘露聚糖、葡聚糖、糖蛋白和多糖肽[9].对于不同种类的真菌、不同提取方法和提取部位,单糖组成会存在差别.
图5为单糖标准品和SIPa、SIPb的糖腈乙酸酯衍生物的气相色谱图,图5(a)中的5个峰(9.862、11.017、16.362、17.483、18.304min 处)分别表示标准岩藻糖、木糖、甘露糖、葡萄糖和半乳糖.图5(b)显示SIPa为葡聚糖,只含葡萄糖;SIPb为杂多糖,单糖组成为岩藻糖、甘露糖、葡萄糖和半乳糖,摩尔比为8.93∶1∶4.25∶29.18.在研究比较多的菌类多糖中,类似于SIPa属于葡聚糖的有香菇多糖、裂褶多糖,二者都具有抗肿瘤、提高细胞免疫及体液免疫的功能[10];类似于SIPb,单糖组成中含有岩藻糖、甘露糖、葡萄糖和半乳糖的多糖有棘托竹荪多糖,它对小鼠肉瘤S-180具有一定的抑制作用,其平均抑制率为 38.93%[11].
2.5 SIPa和SIPb的抗肿瘤活性
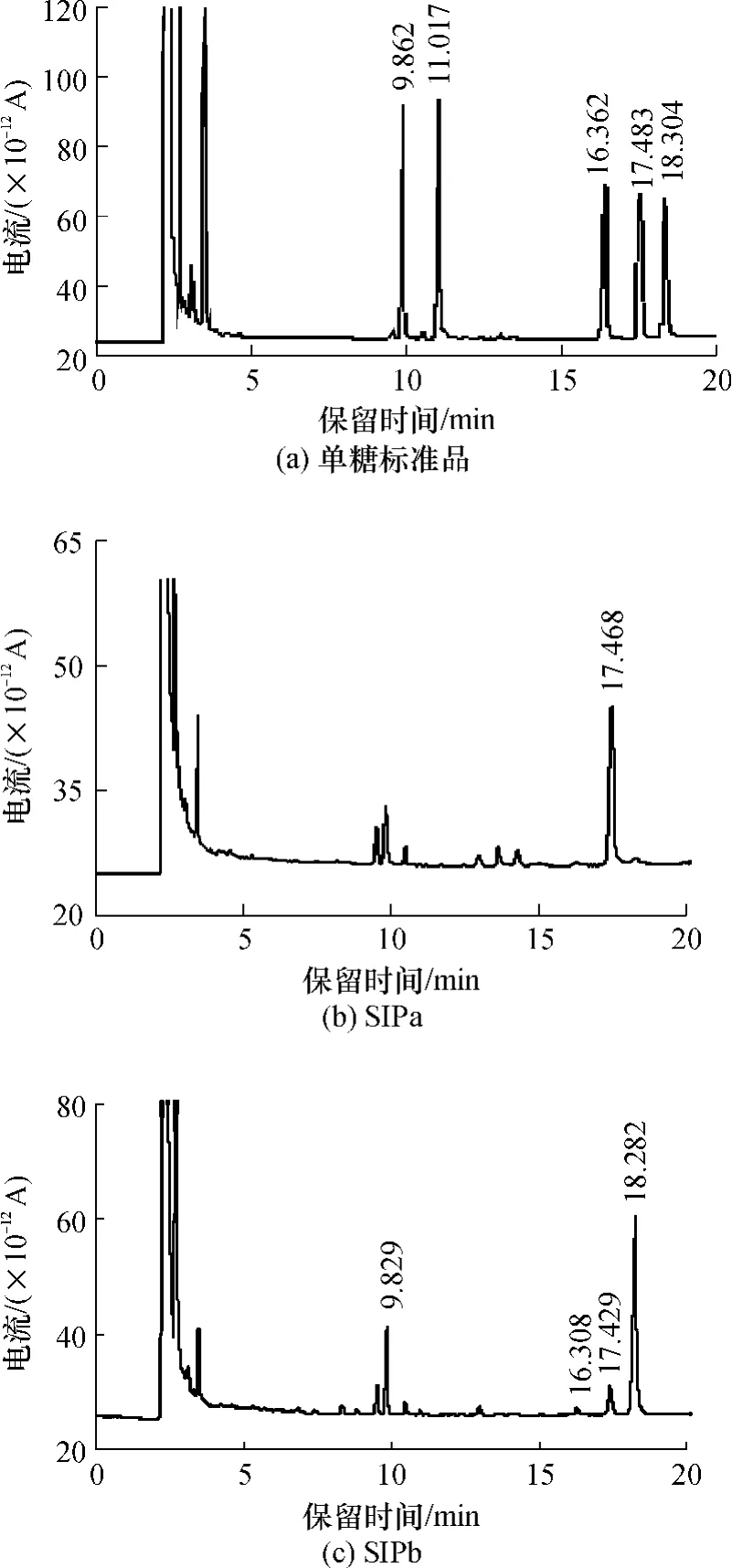
图5 单糖标准品、SIPa和SIPb的气相色谱图Fig.5 Gas chromatograms of standard monosaccharide,SIPa and SIPb
多糖的抗肿瘤作用大小可能与提取方式、提取部位,以及多糖水溶液的相对分子质量、大小、分支度、化学结构等相关.文献[12]的结果显示,用超声法从侧茸菌核和菌丝中提取的多糖的相对分子质量比用热水提取法的高,用热水提取的多糖比用超声法提取的抗肿瘤活性高;提取方法相同时,从侧耳菌核中提取的多糖的相对分子质量越高,抗肿瘤活性也越强.相对分子质量适中的(5.0×105~15.0×105)香菇多糖活性比相对分子质量很低或者很高的多糖的抗肿瘤活性都强[13].相对于空白对照组,SIPa和SIPb对Hep G2和HO-8910细胞的增殖都有抑制作用(见表1),浓度越高,抑制作用越明显,呈剂量依赖性;以SIPb对HO-8910的抑制作用最为显著,最高抑制率为28.51%.SIPb较强的抗肿瘤活性可能与其单糖组分中的甘露糖和葡萄糖有关,因为人体的巨噬细胞有一个多糖受体,该受体对葡萄糖和甘露糖有高度专一性[14],故含有葡萄糖和甘露糖的菌类多糖可能具有抗癌活性[15].
3 结语
文中通过水提醇沉、除蛋白、脱色、离子交换柱层析和凝胶柱层析分离纯化得到两种相对分子质量分布比较集中的黑虎掌菌子实体多糖组分SIPa、SIPb,红外光谱结果证明它们都是多糖类物质.单糖组成分析显示,SIPa只含有葡萄糖,SIPb含有岩藻糖、甘露糖、葡萄糖和半乳糖.MTT实验表明,SIPa和SIPb对人肝癌细胞Hep G2和人卵巢癌细胞HO-8910的增殖都有抑制效果,有进一步研究利用的价值.但对其高级结构、构效关系和药理的研究还不够深入,且生长环境不同、培养条件不同、提取分离技术不同都会造成多糖结构的差异,都会影响其活性;因此,还需要进一步准确分析黑虎掌菌多糖的结构,以充分开发利用其价值.

表1 黑虎掌菌多糖对Hep G2和HO-8910细胞增殖的抑制作用1)Table 1 Growth inhibition of cells Hep G2 and HO-8910 by SIPa and SIPb
[1]冯颖,陈晓鸣,周德群.翘鳞肉齿菌主要生物学特征研究[J].林业科学研究,1996(4):394-399.Feng Ying,Chen Xiao-ming,Zhou De-qun.Studies on the biology ofSarcodon imbricatus[J].Forest Research,1996(4):394-399.
[2]李良生.云南农副土特产品概况[M].昆明:云南人民出版社,1982:216.
[3]徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2002:1784-1786.
[4]Ye H,Wang K Q,Zhou C H,et al.Purification,antitumor and antioxidant activities in vitro of polysaccharides from the brown seaweedSargassum pallidum[J].Food Chemistry,2008,111(2):428-432.
[5]韩哲文,张德震,杨全兴.高分子科学教程[M].上海:华东理工大学出版社,2008:12-14.
[6]Xu W T,Zhang F F,Luo Y B,et al.Antioxidant activity of a water-soluble polysaccharide purified fromPteridium aquilinum[J].Carbohydrate Research,2009,344(2):217-222.
[7]Cai W R,Gu X H,Tang J.Extraction,purification,and characterization of the polysaccharides fromOpuntia milpaalta[J].Carbohydrate Polymers,2008,71(3):403-410.
[8]Chen Y,Xie M Y,Nie S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanoderma atrum[J].Food Chemistry,2008,107(1):231-241.
[9]王立波.食用菌多糖的特性及其提取工艺研究[J].中国食品添加剂,2006(6):68-71.Wang Li-bo.Study on the special characters and extraction of polysaccharides from edible fungi[J].China Food Additives,2006(6):68-71.
[10]Borchers A T,Stern J S,Hackman R M,et al.Mushrooms,tumors and immunity[J].Proceedings of the Society for Experimental Biology and Medicine,1999,221(4):281-293.
[11]林玉满,余萍,刘艳如.棘托竹荪子实体水溶性多糖DE2-2的分离纯化和鉴定[J].食用菌学报,2001,8(1):15-18.Lin Yu-man,Yu Ping,Liu Yan-ru.Isolation,purification and identification of water-soluble polysaccharide DE2-2 from fruitbodies ofDictyophora echinovolvata[J].Acta Edulis Fungi,2001,8(1):15-18.
[12]Zhang M,Zhang L N,Cheung P C K,et al.Molecular weight and anti-tumor activity of the water-soluble polysaccharides isolated by hot water and ultrasonic treatment from the sclerotia and mycelia ofPleurotus tuber-regium[J].Carbohydrate Polymers,2004,56(2):123-128.
[13]李盛,许淑琴,张俐娜.菌类多糖链构象及其表征方法研究进展[J].高分子学报,2010(12):1359-1375.Li Sheng,Xu Shu-qin,Zhang Li-na.Advances in comformation and characterizations of fungi polysaccharides[J].Acta Polymeica Sinica,2010(12):1359-1375.
[14]Lombard Y J.A new method for studying the binding and ingestion of zymosan particles by macrophages[J].Journal of Immunological Methods,1994(174):155-163.
[15]Zhang M,Cui S W,Cheung P C K,et al.Antitumor polysaccharides from mushrooms:a review on their isolation process,structural characteristics and antitumor activity[J].Trends in Food Science & Technology,2007(18):4-19.

