红霉素对白介素-4诱导人支气管上皮细胞表达白介素-6及还原型谷胱甘肽的影响研究
蔡小军,俞云,陆一,叶建林,岳林峰(.江苏无锡市人民医院药剂科,无锡市403;.南京中医药大学江苏省中药药效与安全性评价重点实验室,南京市 009)
支气管哮喘是由多种炎性细胞参与的慢性变态反应性疾病。人支气管上皮细胞(HBE)是炎症反应的主要靶细胞,在支气管哮喘炎症修复中起关键作用,亦是治疗呼吸系统疾病药物的主要作用细胞[1]。哮喘的免疫学发病机制主要是通过T辅助细胞1(Th1)/T辅助细胞2(Th2)反应的失衡导致免疫球蛋白E(IgE)合成增加,直接或间接诱导肥大细胞、嗜酸性粒细胞脱颗粒产生气道高反应及炎症。白介素(IL)-4是目前所知最强的IgE调节因子,可促进IgE生成,从而介导哮喘的发生与发展[2]。红霉素属大环内酯类抗生素,对革兰阳性菌、革兰阴性菌、嗜肺军团菌、支原体等均有抗菌作用,常用于对青霉素耐药的革兰阳性菌感染及对青霉素过敏的患者。红霉素临床首选用于嗜肺军团菌肺炎、支原体肺炎、沙眼衣原体所致的婴儿肺炎及结肠炎;也可用于扁桃体炎、中耳炎、鼻窦炎、大叶性肺炎等。已有研究[3]证实,长期应用小剂量大环内酯类抗生素可以抑制炎症细胞释放炎症介质和抗氧化应激,从而保护HBE,减弱肺部的炎症反应。笔者结合哮喘的发病机制,采用IL-4诱导HBE损伤建立模型,观察红霉素对HBE细胞活力及其释放IL-6与主要抗氧化物质还原型谷胱甘肽(GSH)的影响,探讨红霉素治疗哮喘的可能机制。
1 仪器与材料
1.1 仪器
FORMA3111型CO2培养箱(美国Thermo公司);超净工作台(苏州百神科技网络系统有限公司);倒置相差显微镜(德国Leica Dmil公司);酶联免疫检测仪(美国Thermo Labsystems公司)。
1.2 试药
红霉素原料药(美国Sigma公司,批号:B1001021,纯度:≥98%);DMEM培养基(美国Gibco公司);小牛血清(杭州四季青生物工程材料有限公司);胰蛋白酶、二甲基亚砜(DMSO)(美国Merck公司);IL-4原料药(美国Peprotech公司,批号:200-04);IL-6检测试剂盒(美国Invitrogen公司,批号:ZJAFBZZH02);GSH检测试剂盒(美国Cayman公司,批号:100106);MTT(瑞士Fluka公司)。
1.3 细胞株
正常HBE细胞(16-HBE细胞株),购自湖南远泰生物技术有限公司。
2 方法
2.1 MTT溶液的制备
取MTT 50 mg,溶于10 mL磷酸盐缓冲溶液中,搅拌10 min,经0.22 μm微孔滤器除菌,4℃避光保存,备用。
2.2 分组与给药
取HBE细胞,置于含10%小牛血清的DMEM培养基中,在37℃、5%CO2饱和湿度培养箱内静置培养。取处于对数生长期的HBE细胞,0.25%胰蛋白酶消化单层培养细胞,用含10%小牛血清DMEM培养基制备成单个细胞悬液,以每孔104个细胞接种于96孔培养板中,每孔80 μL细胞悬液。按正常对照组(生理盐水20 μL)、IL-4组(IL-4(0.01 μg·mL-1)10 μL,生理盐水10 μL)、红霉素低、高剂量组(IL-4(0.01 μg·mL-1)10 μL,红霉素(5、50 μg·mL-1)10 μL),加入相应药物,每组8个复孔,混匀后,在37℃、5%CO2饱和湿度培养箱中分别孵育24、48 h。试验重复3次。
2.3 细胞活力的检测
将细胞分别连续孵育24、48 h后,取出,每孔加入新鲜制备的MTT溶液20 μL,继续培养4 h,吸弃上清液,然后每孔加入100 μL DMSO,振荡10 min,使结晶物充分溶解后立即置于酶联免疫检测仪,于490 nm波长处测定各组的吸光度值(OD)。OD值越大,细胞活力越大。
2.4 细胞内IL-6释放量的检测
取“2.3”项下培养的上清液以双抗体夹心法检测每组细胞IL-6的释放量,具体步骤按IL-6检测试剂盒说明书操作。
2.5 细胞内GSH水平的检测
取孵育24、48 h后的细胞悬液,按GSH检测试剂盒说明书操作检测其中GSH水平。
2.6 统计学处理
3 结果
3.1 细胞活力比较
与正常对照组比较,IL-4组细胞孵育24、48 h后活力明显降低(P<0.01)。与IL-4组比较,红霉素低、高剂量组细胞孵育48 h后活力明显升高(P<0.05或P<0.01),结果见表1。
表1 各组细胞活力比较(OD值,±s,n=8)Tab 1 Comparison of human bronchial epithelial cells activity in each grou(pOD,±s,n=8)
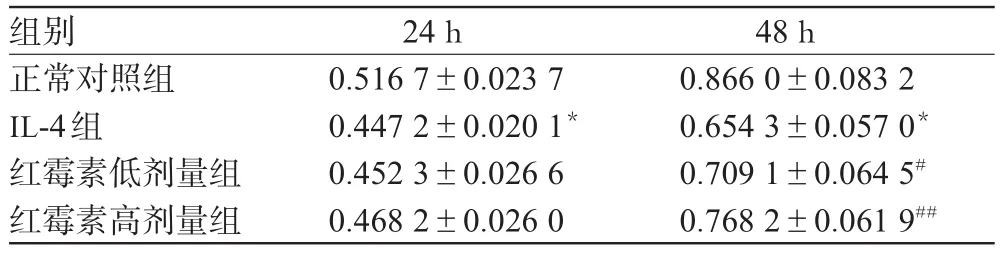
表1 各组细胞活力比较(OD值,±s,n=8)Tab 1 Comparison of human bronchial epithelial cells activity in each grou(pOD,±s,n=8)
与正常对照组比较:*P<0.01;与IL-4组比较:#P<0.05,##P<0.01vs.normal control group:*P<0.01;vs.IL-4 group:#P<0.05,##P<0.01
组别正常对照组IL-4组红霉素低剂量组红霉素高剂量组48 h 0.866 0±0.083 2 0.654 3±0.057 0*0.709 1±0.064 5#0.768 2±0.061 9##24 h 0.516 7±0.023 7 0.447 2±0.020 1*0.452 3±0.026 6 0.468 2±0.026 0
3.2 细胞内IL-6释放量比较
与正常对照组比较,IL-4组细胞孵育24、48 h后IL-6释放量明显升高(P<0.01)。与IL-4组比较,红霉素高剂量组细胞孵育24、48 h后IL-6释放量明显降低(P<0.05或P<0.01),红霉素低剂量组仅孵育48 h后IL-6释放量明显降低(P<0.05),结果见表2。
表2 各组细胞中IL-6释放量比较(pg·mL-l,±s,n=8)Tab 2 Comparison of IL-6 expression in human bronchial epithelial cells in each grou(ppg·mL-l,±s,n=8)

表2 各组细胞中IL-6释放量比较(pg·mL-l,±s,n=8)Tab 2 Comparison of IL-6 expression in human bronchial epithelial cells in each grou(ppg·mL-l,±s,n=8)
与正常对照组比较:*P<0.01;与IL-4组比较:#P<0.05,##P<0.01vs.normal control group:*P<0.01;vs.IL-4 group:#P<0.05,##P<0.01
组别正常对照组IL-4组红霉素低剂量组红霉素高剂量组48 h 78.75±11.62 440.21±16.23*264.96±12.81#169.78±10.68##24 h 59.18±5.53 343.75±12.23*261.96±13.02 187.21±8.26#
3.3 细胞内GSH水平比较
与正常对照组比较,IL-4组细胞孵育24、48 h后GSH水平明显升高(P<0.05)。与IL-4组比较,红霉素低、高剂量组细胞孵育48 h后GSH水平明显降低(P<0.05),结果见表3。
表3 各组细胞中GSH水平比较(μmol·mg-l,±s,n=8)Tab 3Comparison of GSH levels in each grou(pμmol·mg-l,±s,n=8)

表3 各组细胞中GSH水平比较(μmol·mg-l,±s,n=8)Tab 3Comparison of GSH levels in each grou(pμmol·mg-l,±s,n=8)
与正常对照组比较:*P<0.05;与IL-4组比较:#P<0.05vs.normal control group:*P<0.05;vs.IL-4 group:#P<0.05
组别正常对照组IL-4组红霉素低剂量组红霉素高剂量组48 h 1.70±0.26 2.44±0.29*2.03±0.25#1.89±0.30#24 h 1.60±0.23 2.38±0.35*2.34±0.26 2.29±0.22
4 讨论
本研究结果表明,体外培养的细胞经0.01 μg·mL-1IL-4分别刺激24、48 h后活力明显减少,IL-6释放增加。红霉素孵育48 h能明显改善HBE细胞活力,抑制IL-6的释放。
正常机体内存在着氧化/抗氧化平衡调节体系。GSH是含有巯基的非蛋白三肽,其在保持HBE完整性、抵御氧化应激方面起着重要的作用。当氧化负荷增加时,一方面刺激了体内炎症介质的表达而进一步加重了氧化负荷,同时促进了体内保护性抗氧化基因GSH等的代偿性表达,使体内氧化/抗氧化达到新的平衡。当过量氧化剂导致氧化应激时,氧化/抗氧化平衡被破坏,刺激肺部炎症并最终发展成哮喘。本试验结果显示,IL-4组细胞内GSH水平明显升高,提示在IL-4导致氧化应激后,细胞内GSH会反馈性上调,形成了抗氧化应激的适应性或保护性反应。红霉素作用24 h时细胞内GSH水平无明显变化,作用48 h后GSH水平明显降低,表明红霉素并不能直接上调GSH的合成,反而在一定程度上通过某种间接的途径抑制了IL-4对GSH合成的刺激作用。这可能与红霉素抑制IL-4诱导HBE炎症介质IL-6的释放、减轻细胞内炎症负荷后机体反馈调节刺激GSH限速酶谷氨酰半胱氨酸合成酶作用减弱有关。此结果也可以部分解释了临床上为什么需要长期应用小剂量红霉素治疗哮喘才能取得较好治疗效果的原因。本研究为更合理地应用红霉素治疗哮喘等慢性气道炎症性疾病提供了试验依据,但其具体作用机制尚待深入探讨。
[1] Lloyd CM,Hessel EM.Functions of T cells in asthma:more than just Th2cells[J].Nat Rev Immunol,2010,10(12):838.
[2] Chiba Y,Goto K,Momata M,et al.Inducion of RhoA gene expression by interleukin-4 in cultured human bronchial smooth muscle cells[J].J Smooth Muscle Res,2010,46(4):217.
[3] 何志义,邹朝霞,于 亮,等.红霉素对过氧化氢刺激的支气管上皮细胞表达白介素-8与谷胱甘肽的影响[J].中华医学杂志,2005,85(14):976.

