猪BYSL基因克隆、序列特征及表达分析
牛步月,闫晓红,狄生伟,王 洋,李海涛,熊远著,王希彪*
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.华中农业大学农业部猪遗传育种重点实验室,武汉 430070)
胚胎着床是一个复杂的生理过程,主要包括胚胎滋养层细胞与着床期子宫内膜细胞的起始粘附以及胚胎滋养层细胞向子宫内膜的适度侵入。其中,起始黏附过程极为重要,它能启动母胎之间的早期交流,利于着床过程的顺利进行[1]。
Trophinin、Tastin和Bystin为上世纪末新发现的一类介导胚胎着床的细胞粘附分子,其中Trophinin是一种内源性膜蛋白,Tastin和Bystin均为细胞质蛋白。在胚泡植入期,Trophinin分布在子宫内膜上皮细胞以及与之接触的胚泡中。早期的研究发现Trophinin位于细胞质的氨基端可以与Tastin结合,形成细胞粘附分子复合物,介导胚泡与子宫内膜的粘附[2]。1998年,Suzuki等利用酵母双杂交技术从人胚胎滋养层细胞中分离出Bystin[3],体外蛋白质结合试验发现Trophinin和Tastin并不能直接结合,而是借助于Bystin形成Trophinin-Bystin-Tastin细胞粘附分子复合物,一起介导着床时胚泡滋养外胚层和子宫内膜上皮细胞游离端细胞之间的独特粘着。之后的研究发现Bystin可使细胞粘附得到巩固[4-5]。该复合体的异常表达,可通过影响胚胎与子宫内膜的起始黏附导致着床失败[1]。此外,在胎盘早期形成过程中,三者在子宫母胎界面细胞中表达,于妊娠10周以后完全消失,表明它们可能在哺乳动物早期胎盘形成过程中也起着重要作用[6]。
编码Trophinin的基因仅存在于哺乳动物,基因敲除研究发现Trophinin并非小鼠胚胎着床的关键基因[7]。编码Bystin的基因为BYSL(Bystin-like),该基因却存在于多种生物中,例如酵母、昆虫、蛇和哺乳动物等[8]。Aoki等通过基因敲除试验发现,BYSL基因敲除小鼠的胚胎可以正常着床[9],但在第6天死亡,表明该基因是着床后小鼠胚胎存活的关键基因。Adachi等利用RNAi技术发现,BYSL基因表达下调可抑制胚泡的形成[10];BYSL基因沉默也可抑制胚胎干细胞的增殖,表明BYSL基因也是着床前小鼠胚胎存活的关键基因。
鉴于BYSL基因在哺乳动物胚胎发育和着床过程中的重要作用,我们选择该基因作为猪繁殖性状的候选基因。对基因的序列分析和表达模式研究,是开展基因功能研究的前提和基础。但是,通过GenBank数据库检索没有发现猪BYSL基因序列,该基因的表达模式研究尚未见报道。因此,本研究利用同源扩增方法对猪BYSL基因进行克隆;利用生物信息学软件进行序列特征分析;并利用Realtime PCR技术分析该基因的时空表达模式,以期为开展猪繁殖性状分子遗传基础研究提供新的基因素材。
1 材料与方法
1.1 材料
试验动物:9头健康民猪由黑龙江省兰西县民猪保种场提供,分别在性成熟前(1月龄、2.5月龄)和性成熟(4月龄)3个时间点进行屠宰,无菌采取子宫组织;同时,采取4月龄民猪的心脏、肝脏、脾脏、肺脏、肾脏、胃、小肠、脂肪、卵巢和子宫等组织样,置于液氮中速冻后送回实验室-70℃保存备用。
试剂:pMD18-T载体、DNA marker DL2000、SYBR Green I试剂盒(均购自TaKaRa公司);Trizol Reagent RNA提取试剂盒和DEPC(购自Invitrogen公司);反转录试剂盒等(购自Promega公司);凝胶回收试剂盒(购自上海生工);其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 RNA抽提
取100 mg组织样置于无RNA酶的离心管中,充分匀浆后采用Trizol法提取总RNA,利用2%的琼脂糖凝胶电泳验证RNA的完整性,利用紫外分光光度计检测其浓度后,置于-70℃保存备用。具体操作按照RNA提取试剂盒说明书进行。
1.2.2 引物设计与合成
下载人BYSL基因mRNA序列(NM_004053),登录NCBI基因数据库进行BLASTn比对,获取同源性大于80%的猪ESTs序列。利用DNAstar软件包中的Sequencher程序对这些ESTs序列进行拼接。以拼接序列为靶序列,用Primer 5.0软件设计CDS扩增引物。以扩增获得的cDNA序列为靶序列,参照人BYSL基因组结构,设计Real-time PCR引物,引物由上海生物工程技术服务有限公司合成。引物序列如下:
cDNA扩增引物:
荧光定量RT-PCR引物:
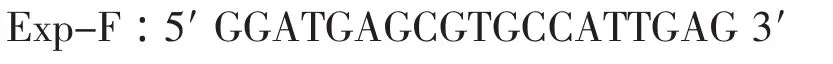

1.2.3 cDNA序列扩增
取3 μg子宫组织总RNA,以Oligo(dT)18为引物,按照反转录试剂盒说明书合成cDNA第一链。以cDNA单链为模板,进行CDS序列扩增。
PCR 反应体系:1 μL dNTP,1 μL Taq 聚合酶,1.5 μL Mg2+,12.5 μL Buffer,上下游引物各 0.5 μL,0.5 μL cDNA模板,用ddH2O将体系调整至25 μL。PCR扩增条件:94℃4 min;94℃45 s,60℃45 s,72℃90 s,扩增35个循环;72℃延伸10 min,4℃保存。PCR产物经1.5%琼脂糖凝胶电泳检测后,用胶回收试剂盒回收目的片段(胶回收操作参见试剂盒说明书)。回收产物与pMD18-T载体连接,转化E.coli DH5α感受态细胞,经过蓝白斑筛选阳性克隆,利用M13引物进行菌落PCR鉴定,挑选阳性菌液送上海生物工程技术服务有限公司测序。
1.2.4 猪BYSL基因时空表达模式
等同条件下反转录各组织的cDNA,然后将3头猪同一组织反转录cDNA混合,构建代表特定组织和特定月龄子宫组织的cDNA池。以β-actin为内参,利用SYBR Green I荧光染料进行Real-time PCR。反应体系为:10 μL SYBR Premix Ex TaqTM,0.5 μL Rox II,上下游引物各 1 μL,0.5 μL cDNA混合模板,用ddH2O将体系调整至25 μL。PCR扩增条件:95℃10 s;95℃ 55 s,60℃ 30 s,30个循环。Real-time PCR反应由ABI 7500 Real-time PCR仪 (Applied Biosystems公司)完成。BYSL和β-actin标准曲线由各自RT-PCR产物(1/10,1/100,1/1 000和1/10 000)梯度稀释后建立。每个样本重复测定3次。内参基因表达稳定性的评估、β-actin和BYSL表达量的计算由SDS软件V1.3.1(Applied Biosystems 公司)完成。利用 2-ΔΔCt法计算BYSL基因相对表达量,利用SPSS10.0软件对目的基因在不同发育阶段子宫组织的表达量进行差异显著性检验。
1.2.5 序列分析与结构预测
将经RT-PCR获得的猪BYSL基因的cDNA序列利用ORF Finder程序进行最大开放阅读框预测;利用DNAstar软件包中的EditSeq程序进行氨基酸序列预测;利用ProtParam软件进行蛋白理化特性预测;利用Prosite软件进行蛋白功能位点分析;利用CDD数据库分析猪BYSL的保守结构域;从GenBank数据库下载人(NP_004044)、牛(NP_001014924)、狒狒(NP_001162223)、小鼠(NP_058555)、大鼠(NP_872615)、狗(XP_532135.2)、鸡(XP_418047)、斑马鱼(NP_957400)和非洲爪蟾(NP_001085058)的BYSL氨基酸序列,利用EBI在线多序列比对软件Clustalw2.0进行序列同源性比对分析。利用分子进化遗传分析软件Mega4,采用邻近相连算法NJ(Neighbor joining Model)构建系统进化树,计算距离采用泊松校验(Poissoncorrection)的方法,自展检验(Bootstrap test)估计NJ法所构系统树的可靠性,重复次数5 000次,其余参数取默认值。
2 结果与分析
2.1 cDNA序列扩增
以猪卵巢组织cDNA为模版,B1、B2和B3引物对为特异引物进行RT-PCR扩增,均获得与预期扩增片段大小相一致的特异性条带(见图1)。
序列测定和分析表明B1、B2和B3引物对扩增片段长度分别为629、836和499 bp。
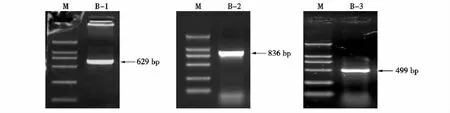
图1 猪BYSL基因部分cDNA片段扩增结果Fig.1 PCR amplification results of partial cDNA of porcine BYSL gene
2.2 序列分析与结构预测
采用ProtParam软件对猪BYSL蛋白进行一级结构预测,结果表明该蛋白分子量约为49.2 ku,等电点为8.67,是碱性蛋白,半衰期30 h,不稳定指数为49.07。利用Prosite软件分析显示,猪BYSL蛋白可能存在 1个 N-糖基化位点(N-glycosylation site),6个蛋白激酶C磷酸化位点(Protein kinase C phosphorylation site),7个酪蛋白激酶II磷酸化位点(Casein kinase II phosphorylation site),1 个豆蔻酰化位点 (N-myristoylation site),3个 Tyrosine kinase phosphorylation site。
利用CDD数据库,发现猪BYSL蛋白包含一个Bystin保守结构域,结构域位于134~435氨基酸处(见图2)。

图2 猪BYSL基因保守结构域Fig.2 Conserved domain of porcine BYSL
利用Clustalw 2.0软件比对分析预测序列与人BYSL基因的编码区序列,发现二者具有87%的相似性。进一步将预测的猪BYSL蛋白序列与人、牛、狒狒、小鼠、大鼠、狗、鸡、斑马鱼和非洲爪蟾等物种的BYSL蛋白序列进行同源性比对分析,结果发现猪与人、牛、狒狒、小鼠、大鼠、狗、鸡、斑马鱼和非洲爪蟾的BYSL蛋白序列相似度分别为90%,90%,89%,87%,87%,87%,68%,71%和69%。因此将预测序列命名为猪BYSL基因(GenBank:EF530129)。
进一步选取上述10种动物的BYSL蛋白序列,利用MEGA4.1(软件)构建系统进化树,分析发现猪BYSL基因在分子进化上与人和牛的亲缘关系较近(见图 3)。
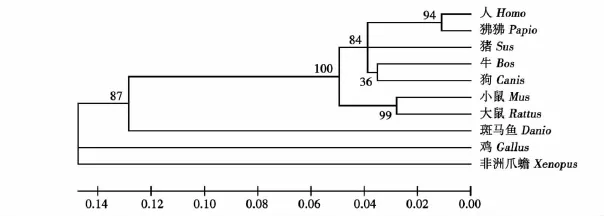
图3 BYSL系统进化树分析Fig.3 Phylogenetic relationship of BYSL
2.3 猪BYSL基因时空表达模式分析
为了研究猪BYSL基因的空间表达模式,利用荧光定量RT-PCR方法检测了BYSL基因在4月龄民猪子宫、卵巢等10种组织中的表达量。结果显示,BYSL基因在所检测的心脏、肝脏、脾脏、肺脏、肾脏、胃、小肠、脂肪、子宫和卵巢等组织中均表达,其中在心脏中表达量最高,其次为肝脏和肾脏,在子宫、卵巢、胃和小肠组织中为中等表达,在脾脏表达量较低,肺脏表达量最低(见图4)。
为了研究猪BYSL基因的时间表达模式,利用荧光定量RT-PCR方法检测BYSL基因在性成熟剂(1月龄,2.5月龄)和性成熟后(4月龄)3个时间点猪子宫组织中的表达情况。结果显示,BYSL基因表达量随着月龄的增加不断升高,在1月龄最低(2.5月龄较高),4月龄最高,方差分析结果表明,4月龄子宫组织中表达量显著高于1月龄和2.5月龄(P<0.05)而1月龄和2.5月龄基因表达量差异不显著(见图5)。
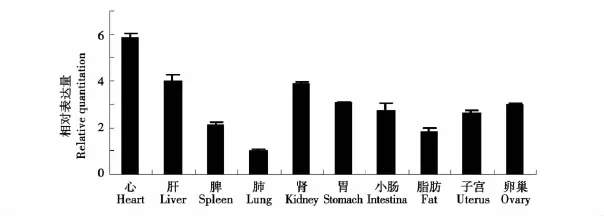
图4 猪BYSL基因的组织表达谱Fig.4 Tissue expression profile analysis of porcine BYSL
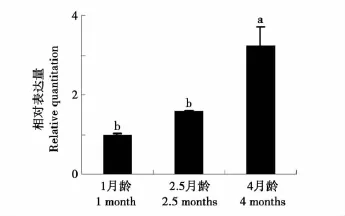
图5 猪BYSL基因子宫组织表达谱Fig.5 Uteurs tissue expression profile analysis of porcine BYSL gene
3 讨论与结论
本研究结合RT-PCR技术和生物信息学方法克隆了猪BYSL基因的cDNA序列,ORF Finder程序分析发现所获得的序列包含一个由1 308个碱基组成的开放读码框,编码436个氨基酸。蛋白质序列分析结果表明,猪BYSL含有一个bystin保守结构域和多个蛋白激酶磷酸化位点。胚胎着床过程中,胚泡与子宫内膜上皮细胞的粘附,会触发一种信号传导级联系统,引起胚胎滋养层细胞迅速增殖[11]。猪BYSL中存在着潜在的蛋白激酶磷酸化位点,很可能在这一信号传导中扮演重要角色。与其他动物氨基酸序列比较结果显示,物种间进化关系越近则它们的BYSL蛋白序列的相似度越高,可见该基因在进化过程中具有较高的序列保守性。通过对猪BYSL基因核苷酸序列和氨基酸序列分析、蛋白结构和功能的预测与分析,进一步证实了本研究所获得序列的正确性。
由于DNA非编码区序列常发生突变、缺失等现象,且编码区的突变不一定引起氨基酸序列的变化,因此,本试验利用猪BYSL基因与其他动物氨基酸序列进行系统进化树分析。分析结果表明建树动物在进化关系上可分为哺乳类动物和非哺乳类动物两大类。其中哺乳类动物中,小鼠和大鼠为一组,人、狒狒、牛、狗和猪等为一组。同源性比较和系统发育分析表明猪与人、牛等高等哺乳动物的亲缘关系最近,其次是鼠类,然后是鱼类,这与动物学上的分类结果趋于一致,从一定程度上反映了这些物种的进化关系。
基因的时空表达模式分析是基因功能研究的基础,对深入研究基因的表达、蛋白的分泌以及基因作用的靶组织都有重要的意义。本研究以民猪为研究对象,分析BYSL基因的时空表达模式。研究发现该基因在子宫和卵巢组织等10个组织中均表达;对不同月龄子宫组织表达模式研究发现,BYSL的表达量随着子宫的发育成熟而不断升高,在4月龄时表达量最高。民猪是生活在东北地区的著名猪种,具有较高的繁殖性能,在4月龄达到初情期[12]。BYSL基因的表达规律与民猪子宫发育成熟相一致,据此,我们推测该基因可能在猪生殖过程中发挥作用,但其是否为子宫发育成熟的关键因子、是否在猪胚胎着床过程中发挥关键作用,仍有待进一步研究。
[1] 孙虹,靳镭.Trophinin,tastin,bystin复合体与胚胎起始黏附[J].中国优生与遗传杂志,2005,13:113-114
[2] 余秋波,王应雄.细胞粘附分子与胚胎着床[J].中国优生与遗传杂志,2005(1):6-8.
[3] Suzuki N,Zara J,Sato T,et al.A novel cytoplasmic protein,bystin,interacts with trophinin,tastin and cytokeratin,and may be involved in trophinin mediated cell adhesion between trophoblast and endometrial epithelial cells[J].Proc Natl Acad Sci USA,1998,95:5027-5032.
[4] Aoki R,Fukuda M N.Recent molecular approaches to elucidate the mechanism of embryo implantation:Trophinin,bystin,and tastin as molecules involved in the initial attachment of blastocysts to the uterus in humans[J].Semin Reprod Med,2000,18:265-271.
[5] Kimber S J,Spanswick C.Blastocyst implantation:the adhesion cascade[J].Semin Cell Dev Biol,2000,11(2):77-92.
[6] Suzuki N,Nakayama J,Shih I M,et al.Expression of trophinin,tastin,and bystin by trophoblast and endometrial cells in human placenta[J].Biol Reprod,1999,60:621-627.
[7] Nadano D,Sugihara K,Paria B C,et al.Significant differences between mouse and human trophinins are revealed by their expression patterns and targeted disruption of mouse trophinin gene[J].Biol Reprod,2002,66:313-321.
[8] Fukuda M N,Miyoshi M,Nadano D.The role of bystin in embryo implantation and in ribosomal biogenesis[J].Cell Mol Life Sci,2008,65(1):92-99.
[9] Aoki R,Suzuki N,Paria B C,et al.The BYSL gene product,bystin,is essential for survival of mouse embryos[J].FEBS Lett,2006,580:6062-6068.
[10] Adachi K,Soeta-Saneyoshi C,Sagara H,et al.Crucial role of BYSL in mammalian preimplantation development as an integral factor for 40Sribosomebiogenesis[J].MolCellBiol,2007,27:2202-2214.
[11] 肖丽娟,杨增明.Trophinin,tastin和bystin在哺乳动物胚胎着床及早期胎盘形成中的作用[J].生殖医学杂志,2002,11(2):120-123.
[12] 许振英.中国地方猪种种质特性[M].杭州:浙江科学技术出版社,1989:16-38.

