猪GSTM2基因的多态性及与生产性状相关性分析
王嘉博,祝继原,俄广鑫,杨少成,刘 娣*
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院,哈尔滨 150086)
谷胱甘肽硫转移酶 (Glutathione S-transferases;简称GSTs)是生物体内一种重要的一相解毒酶,GST mu2基因属于GSTs的mu亚型,mu亚型在消除自由基、过氧化物、亲电子基团和中间数具有酶功能,并参与细胞保护和调节细胞生长,GSTM2具有前列腺素E合成酶(PGES)的活性,可以参与前列腺素E2(PGE2)的合成[1]。有研究表明GSTM2在卵巢中表达,其意义可能在于保护卵子免受有毒物质的伤害和产生PGE2[2]。研究发现,仅在妊娠第3、4天的小鼠宫腔上皮中检测到GSTM2的表达。小鼠胚胎着床发生在妊娠第4天的子夜,妊娠第3、4天是子宫为胚胎着床的准备期,此时孕酮的含量也大量增加,在这一阶段,GSTM2高表达于腔上皮,推测该分子可能与胚胎着床时的子宫分化为接受态有关,并且可能受体内的孕酮调节。GSTM2所起作用以及作用机理有待于进一步研究。
1 材料与方法
1.1 试验材料
PCR-SSCP用组织样:法系大白猪(50头)和大民猪(大白猪♂×民猪♀,100头)两个品种共150个母猪耳组织样,均采自黑龙江省农科院畜牧研究所。
1.2 引物设计及反应条件
根据GenBank上发表的猪GSTM2基因序列(No.DQ988118)和鼠的 GSTM2基因序列(No.BC037068),在第2、第5和第7外显子处设计3对引物(见表1)。

表1 猪GSTM2基因PCR-SSCP分析用引物Table 1 Primers for PCR-SSCP analysis on pig GSTM2 gene
1.3 扩增产物的PCR-SSCP
取2 μL PCR产物置于PCR管中加8 μL变性Buffer,混匀,98℃变性10 min,迅速插入冰中,使之保持变性状态。18%非变性聚丙烯酰胺凝胶电泳。高压250 V预电泳5 min,然后5 V·cm-1,电泳14~16 h后,银染显色[3]。
1.4 统计分析
计算各基因型的频率和PIC(群体杂合度)值,将基因型与各个性状指标进行最小二乘分析(JMP7.0)。
用于分析的统计模型为:Y=μ+G+e其中,Y为性状的表型值,μ为群体均值,G为基因型固定效应,e为剩余效应。
采用x2检验对试验结果进行统计分析。
2 结果与分析
2.1 SSCP检验结果
3对引物经PCR扩增后获得各自长度的特异带,电泳结果见图1。PCR-SSCP结果见图2~4。
从图2可以看到G2位点的多态分析结果,一共6种带型,3个等位基因A、B和C。图3中G5位点的多态分析结果:3种带型,2个等位基因。图4中G7位点的多态分析结果:3种带型,2个等位基因。
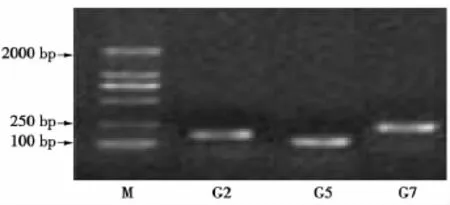
图1 对引物PCR-SSCP扩增产物Fig.1 PCR-SSCP amplification products of three pairs primers

图2 G2引物PCR-SSCP检验结果Fig.2 PCR-SSCP test results of G2 primers
2.2 各基因型在2个猪种中的分布
对法系大白猪和大民猪共150个样品进行PCR-SSCP检验,得到各基因型在这两个猪种中的分布情况。从表2可见G2位点为高度多态位点,并且G2位点法系大白猪与大民猪的等位基因频率存在显著差异。其他两个位点属于中度多态位点,只有三种带型,两个等位基因。
2.3 各基因型与生产性状相关性分析

图3 G5引物PCR-SSCP检验结果Fig.3 PCR-SSCP test results of G5 primer

图4 G7引物PCR-SSCP检验结果Fig.4 PCR-SSCP test results of G7 primer
通过对150头母猪的生产性状记录、对比,将结果与基因型联系、分析。结果见表3~5。最后计算各个基因型之间生产性状的分布差异检验的P值。由此可见,G2、G5、G7位点对母猪总产仔数和活产仔数影响板显著(P<0.01),这三个位点中都是AB基因型个体的总产仔数平均数最高,进一步验证了杂合基因型高于纯合基因型性状的理论。这个位点对断奶窝平均重影响不显著。G2位点对窝平均初生重影响显著。由表3~5可见AB型在总产仔数、活产仔数上最高且与其他基因型差异极显著。AA与BB性状表现基本一致,也进一步说明了杂合基因型优于纯合基因型。

表2 不同品种猪GSTM2基因的基因型频率和基因频率Table 2 Allele ferquencies and genotype frequencies of GSTM2 among two breeds
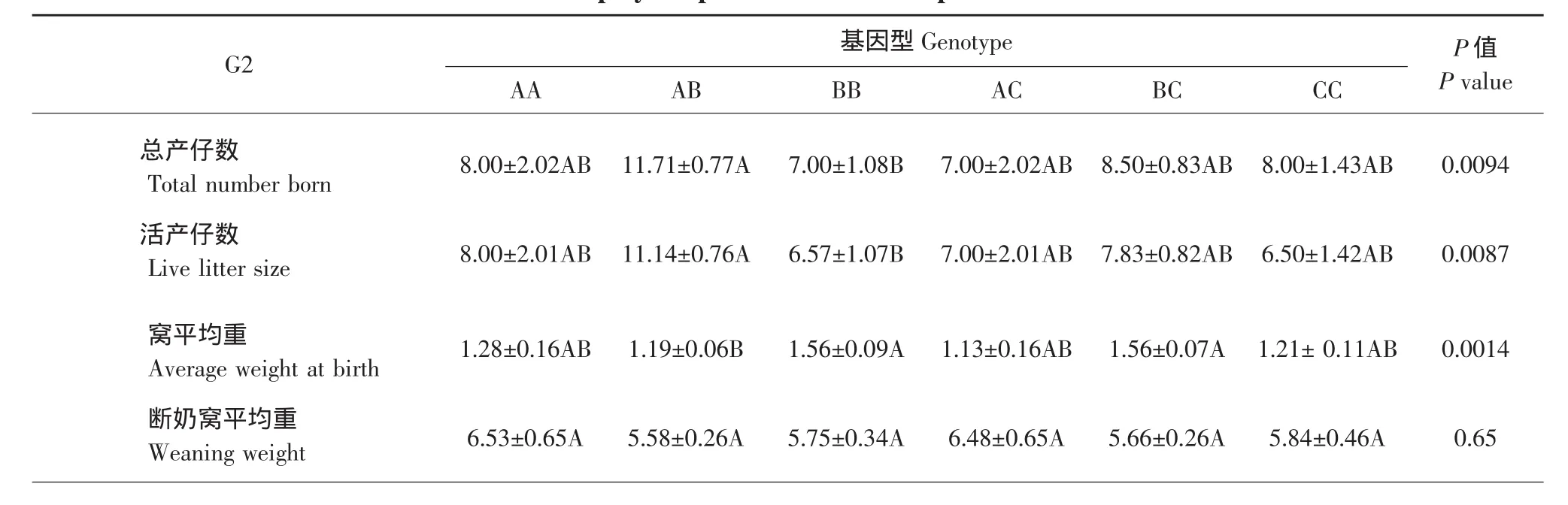
表3 母猪G2多态位点的各生产性状Table 3 G2 polymorphic loci in various production traits

表4 母猪G5多态位点的各生产性状Table 4 G5 polymorphic loci in various production traits
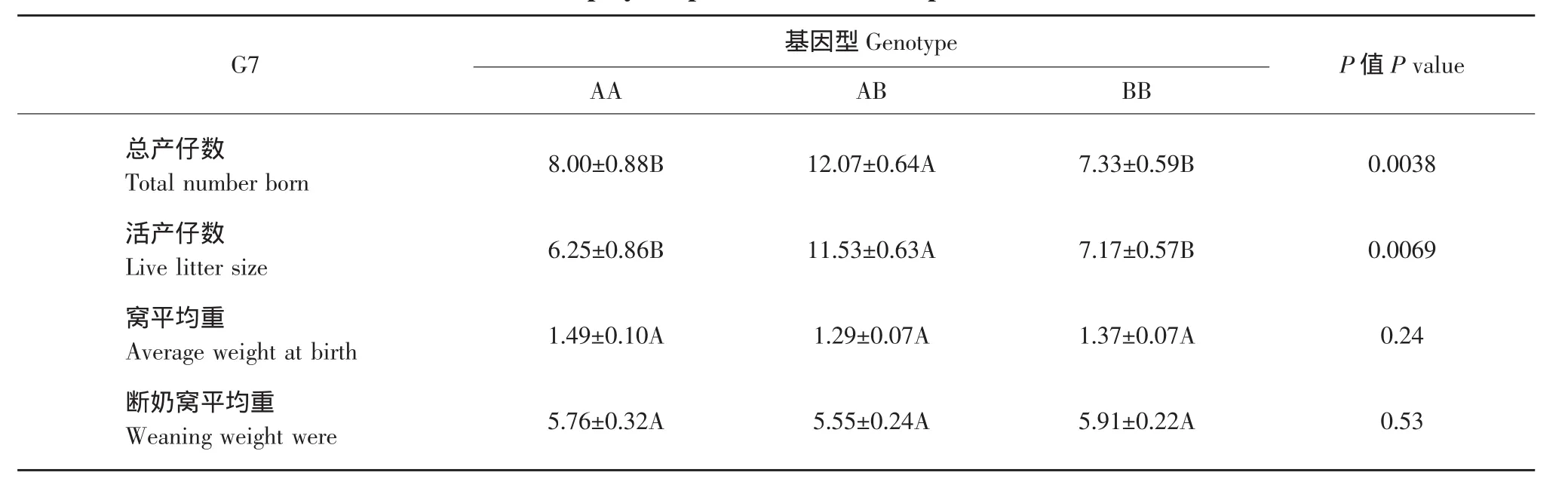
表5 母猪G7多态位点的各生产性状Table 5 G7 polymorphic loci in various production traits
3 讨论与结论
Booth J和Canbes B等先后在肝脏细胞抽提液中发现了能够催化GSH偶联到1,2-二氯-4-硝基苯的活性酶,从而开启了近40年来对谷胱甘肽硫转移酶进行比较生物化学和酶学研究的先河[4-5]。GST mu2基因是一段属于mu亚型,mu亚型在消除自由基、过氧化物、亲电子基团和中间数具有酶功能,并参与细胞保护和调节细胞生长,在人类基因组中mu亚基是在染色体的1p13.3(1号染色体短臂上的一个位置)上编码蛋白[6]。
通过参考GenBank上的GSTM2基因序列,克隆得到猪GSTM2基因序列,通过对比发现了三个多态位点,针对这三个多态位点进行了SSCP-PCR检测。G2位点,该片段中在内含子2的370 bp处以及外显子2的399 bp处存在2个核苷酸多态,其中,外显子内的多态没有导致编码蛋白改变,属于同义突变。G5位点,该片段中在外显子5的1 435 bp处存在核苷酸多态。该处突变导致终止密码子提前,终止翻译。G7位点,该片段中在外显子7的2 466、2 486 bp以及内含子2 395和2 406 bp处存在4个核苷酸多态,没有发现和网上序列一致的基因型,并通过大量测序及基因型观察,这4个核苷酸突变是基因连锁,CACA/ATTG。其中外显子突变导致蛋白质多肽链氨基酸的改变,分别是F/S、E/V。
经过SSCP检测,150个母猪中G2位点上法系大白猪B等位基因占优势,但大民猪中A等位基因占优势,G5位点上2猪种均是B等位基因占优势,G7位点上2猪种均是B等位基因占优势。各基因型与生产性状相关性分析表明,基因中G2、G5、G7各位点的AB型总产仔数都为最高,可进一步说明这三个位点的突变对母猪生产性状影响极显著。
因此,本研究认为GSTM2基因的PCR-SSCP可以作为与猪产仔数相关的遗传标记,研究GSTM2基因的多态性可以探讨GSTM2基因对于猪繁殖性状的重要意义。
[1] Janeric,Ronald W P.A glutathione transferase in human leukocytes as a marker for thesusceptibility to lung cancer[J].Carcinogenesis,1986,7(5):751-753.
[2] Richard C.S,Peter W J,Anthony A F.Glutathione S-transferase:Genetics and role in toxicology[J].Toxicology Letters,2000,112-113:357-363.
[3] 李洪敏,吴雪琼,张俊仙,等.应用PCR-SSCP快速鉴定结核分枝杆菌复合群[J].微生物学通报,2000,27(3):202~204.
[4] 杨海灵.聂力嘉,朱圣庚,等.谷胱甘肽硫转移酶结构与功能研究进展[J].成都大学学报,2006,3(1):19~24.
[5] 王智慧,吴逸明,吴拥军.人谷胱甘肽硫转移酶Pi基因的克隆及表达[J].医药论坛杂志.2004,25(11):6~8.
[6] Huang Jingshu,Xiong Yuanzhu.Cloning,sequence analysis and identification of a nonsense mutation-mediated mRNA decay of porcineGSTM2gene[J].ActaBiochimicaetBiophysicaSinica,2007,39(8):560-566.

