核结合因子相关的急性髓系白血病的临床分析
李 巍,秘营昌,刘兵城,周春林,林 冬,王慧君,刘旭萍,李庆华,卞寿庚,王建祥
中国医学科学院 北京协和医学院 血液病学研究所 血液病医院白血病诊疗中心,天津 300020
Leukemia Diagnosis and Treatment Center,Institute of Hematology and Blood Disease Hospital,CAMS and PUMC,Tianjin 300020,China
半数以上的成人急性髓系白血病 (acute myeloid leukemia,AML)伴有非随机的染色体异常,它们和白血病细胞的生物学特征 (如细胞形态、免疫表型等)、治疗及预后都有密切的联系。其中常见的为AML伴t(8;21)(q22;q22)[AML伴t(8;21)]和AML伴inv(16)(p13,q22)/t(16;16)(p13;q22)[AML伴inv(16)/t(16;16)],分别在AML的染色体异常中占10% ~12%、12%[1]。WHO血液淋巴组织肿瘤分类中结合细胞形态学、免疫表型、细胞遗传学及临床学特点将两者列为AML伴重现性遗传学异常。t(8;21)(q22;q22)易位形成了AML1-ETO融合基因[2];inv(16)(p13;q22)与 t(16;16)(p13;q22)2种染色体异常均可导致形成核结合因子 β (core binding factor β,CBF β)-MYH11融合基因。CBF α和CBF β形成异源二聚体,基因产物为AML1,为t(8;21)(q22;q22)易位产生的基因之一,因此AML伴t(8;21)和AML伴inv(16)/t(16;16)在发病机制上存在共同之处,常将二者并称为CBF AML。AML伴t(8;21)和AML伴inv(16)/t(16;16)在1998年西南肿瘤协作组提出的危险因素分组中均为低危组,在临床上一直作为预后良好的亚型,化疗的完全缓解(complete remission,CR)率高,较正常核型和其他异常染色体核型的患者可获得更长的无复发生存期[3]。本研究通过对 AML伴 t(8;21)和 AML伴inv(16)/t(16;16)患者的一般情况、免疫分型、染色体核型、治疗情况等进行回顾性分析,分别对AML伴t(8;21)和AML伴inv(16)/t(16;16)患者发病的临床特征、治疗情况、生存情况进行对比研究,从而了解影响AML伴t(8;21)和AML伴inv(16)/t(16;16)患者的主要因素及两组患者之间的差异。
对象和方法
对象 选取1995年11月至2008年2月我院收治的130例初治AML患者。所有患者均进行了形态学、细胞化学、免疫表型、细胞遗传学及/或AML1/ETO、CBF β/MYH11融合基因的分子生物学检查,符合WHO分类的AML伴t(8;21)(AML1/ETO)或 AML 伴 inv(16)/t(16;16)(CBF β/MYH11)。随访截止至2009年4月30日,中位随访23.5个月(0.26~132.49个月)。
诊断 全部患者的外周血及骨髓涂片经瑞氏染色后阅片,进行法美英 (FAB)分型,其中87例符合AML M2、40例符合AML M4Eo、3例符合AML M4。免疫表型分析采用间接免疫荧光标记方法和流式细胞术分析。应用Leica Q500染色体自动分析仪进行核型分析。采用RT-PCR方法进行分子生物学分析。其中AML伴t(8;21)87例、AML伴inv(16)/t(16;16)43例。
临床治疗
AML伴t(8;21)的治疗:58例患者采用标准剂量阿糖胞苷 (Ara-C)为基础的化疗方案进行诱导治疗,方案包括DA、MA、HAA、HAM、HAD;DNR-柔红霉素 (45 mg·m-2·d-1×3 d)、MTZ-米托蒽醌(8 mg·m-2·d-1× 3 d)、HHT-高三尖杉酯碱 (2.5 mg·m-2·d-1×7 d)、Amsa-安丫啶(70 mg·m-2·d-1×5 d)、Ara-C-阿糖胞苷 (100 mg·m-2·d-1× 7 d)。29例患者采用含中剂量Ara-C的HAD方案诱导治疗(高三尖杉酯碱 2.0 mg·m-2·d-1×7 d;柔红霉素40 mg·m-2·d-1×3 d;阿糖胞苷100 mg·m-2·d-1×4 d,1.0~1.5 g·m-2·d-1,第 5~7天)。缓解后治疗包括标准剂量的DA、MA、AA、HA、MAC(柔红霉素、米托蒽醌、高三尖杉酯碱、安丫啶、环磷酰胺、阿糖胞苷150 mg·m-2)方案和含有中剂量阿糖胞苷的DA、MA(柔红霉素、米托蒽醌、阿糖胞苷 2.0~3.0 g·m-2·d-1×3 d)巩固化疗方案(共有49例患者采用了含有中剂量阿糖胞苷的方案:1疗程16例、≥2疗程33例),单纯标准剂量Ara-C巩固治疗33例。缓解后巩固治疗的疗程中位数4(1~14)个。
AML伴inv(16)/t(16;16)的治疗:36例采用标准剂量Ara-C为基础的方案诱导治疗,包括DA、MA、HAA、HAM、HAD;7例患者采用含中剂量Ara-C的HAD诱导治疗。缓解后巩固治疗包括标准剂量的DA、MA、AA、HA、MAC、TA和含有中剂量阿糖胞苷的DA、MA,其中32例采用含有中剂量Ara-C巩固治疗 (1疗程16例、≥2疗程16例)、单纯采用标准剂量Ara-C巩固治疗7例。缓解后巩固治疗的疗程中位数5(1~12)个。
疗效判定标准 参考2003年Cheson等[4]报道的国际协作组AML疗效判定标准判断。总体生存 (overall survival,OS)时间定义为确诊之日至死亡 (包括任何原因)或末次生存随访之日结束的时间;无复发生存 (relapse-free survival,RFS)时间定义为自达到无白血病状态起至患者死亡 (包括各种原因)、复发或末次随访检查日的时间。失访病例以末次就诊或随访日期为审视截点。
统计学处理 采用SPSS 13.0统计软件进行处理,组间计数资料的比较采用one way ANOVA分析,组间率的比较采用χ2检验,采用列联表χ2检验比较各影响因素对疗效的影响;采用Kaplan-Meier和寿命表法进行生存分析,不同组别的差异检验采用log-rank法,采用COX回归模型评价影响生存的因素。
结 果
临床特征 130例患者中男性85例 (65.4%)、女性45例 (34.6%),男女比例1.95∶1。其中AML伴t(8;21)男性 58例 (44.6%)、AML伴 inv(16)/t(16;16)男性27例(20.8%)(P>0.05);AML伴t(8;21)女性29例 (22.3%)、AML伴inv(16)/t(16;16)女性16例 (12.3%)(P>0.05)。发病中位年龄为 33(13~69)岁,AML伴t(8;21)发病中位年龄为32(14~65)岁,AML伴inv(16)/t(16;16)发病中位年龄为33(13~69)岁 (P>0.05)。年龄 >60岁4例,AML伴t(8;21)、AML伴 inv(16)/t(16;16)各2例。
发病时中位白细胞计数12.97(1.3~214) ×109/L,AML伴t(8;21)发病时中位白细胞计数11(1.3~129) ×109/L,AML伴 inv(16)/t(16;16)发病时中位白细胞计数32.5(2.46~214)×109/L(P=0.01)。白细胞计数>30×109/L 35例,其中 AML伴 t(8;21)12例 (34.2%)、AML伴inv(16)/t(16;16)23例 (65.7%)。
发病时外周血幼稚细胞比例的中位数为0.44(0~0.93),其中 AML伴 t(8;21)为0.31(0~0.9),AML伴 inv(16)/t(16;16)为 0.58(0.02~0.93)(P=0.43)。发病时骨髓中幼稚细胞比例的中位数为0.59(0.20~0.92)。其中AML伴t(8;21)为0.60(0.20~0.92),AML伴inv(16)/t(16;16)为0.55(0.21~0.89)(P=0.55)。
发病时脾脏肿大29例 (22.3%),其中AML伴t(8;21)6例 (20.7%)、AML伴 inv(16)/t(16;16)23例 (79.3%)(P<0.05)。发病时肝脏肿大8例 (6.2%),其中 AML伴 t(8;21)3例(37.5%)、AML伴 inv(16)/t(16;16)5例(62.5%)(P<0.05)。发病时伴有≥2个部位浅表淋巴结28例 (21.5%),其中AML伴t(8;21)8例 (28.6%)、AML伴inv(16)/t(16;16)20例(71.4%)(P<0.05)。
实验室特征 所有患者均为染色体伴t(8;21)和/或AML1-ETO融合基因阳性、AML伴inv(16)/t(16;16)和/或 CBF β/MYH11融合基因阳性。109例患者成功进行了染色体核型检查,69例中59例伴t(8;21)(检出率为85.5%);40例中17例伴inv(16)、1例伴t(16;16)(检出率为45.0%)。AML伴inv(16)/t(16;16)患者中正常核型的检出率为65%(26/40),而AML伴t(8;21)的检出率为39.1%(27/69)(P<0.05)。伴有复杂核型的检出率分别为12.5%(5/40)、14.5%(10/69)(P>0.05)。伴有+/-8的检出率分别为 2.5%(1/40)、5.8%(4/69)(P>0.05)。伴有+/-7的检出率分别为7.5%(3/40)、4.3%(3/69)(P>0.05)。其中伴有性染色体异常、伴有9q-常见于 AML伴t(8;21),AML伴inv(16)/t(16;16)染色体核型未检出;伴有+22常见于AML伴有inv(16)/t(16;16),AML伴t(8;21)染色体核型未检出。
111例患者完成融合基因检查,70例完成了AML/ETO融合基因检查,AML/ETO融合基因 (+)62例 (检出率为88.6%)。41例患者完成了CBF β/MYH11融合基因检查,CBF β/MYH11融合基因(+)41例 (检出率100%)。AML伴t(8;21)中18例未行染色体核型检测伴有AML/ETO融合基因(+);10例未检出t(8;21)的患者伴有AML/ETO融合基因 (+)。AML伴inv(16)/t(16;16)中3例未行染色体核型检查伴有CBF β/MYH11融合基因(+),22例未检测出inv(16)/t(16;16)染色体核型均伴有CBF β/MYH11融合基因 (+)。
117例进行免疫表型检查,其中AML伴t(8;21)78例、AML伴 inv(16)/t(16;16)39例。AML伴t(8;21)和AML伴inv(16)/t(16;16)在髓系分化抗原 (CD13+、CD33+)均高表达CD34+,两者分别为82.1%(64/78)和87.2%(34/39)(P>0.05)。在单核系分化抗原CD64+的表达两者分别为1.3%(1/78)和28.2%(11/39)(P<0.05);CD14+的表达两者分别为8.9%(7/78)和30.8%(12/39)(P<0.05)。CD19+的表达两者分别为44.9%(35/78)和2.6%(1/39)(P<0.05);CD56+的表达两者分别为35.9%(28/78)和5.1%(2/39)(P<0.05)。CD19+CD56+双表达仅见于 AML伴 t(8,21),在 AML伴 inv(16)/t(16;16)中无表达。
治疗与疗效
诱导治疗情况:127例患者完成1疗程诱导治疗可以判断疗效,总CR率96.1%(122/127),其中1疗程CR率77.2%(98/127)、2疗程CR率13.4%(17/127),>2疗程CR率 5.5%(7/127),3.9%(5/127)骨髓持续未缓解 (表1)。
巩固治疗情况:121例CR患者进行了巩固治疗,采用标准剂量Ara-C巩固治疗40例 (33.1%),中剂量Ara-C巩固治疗81例 (66.9%),1疗程中剂量Ara-C巩固治疗32例 (26.4%),≥2疗程中剂量Ara-C巩固治疗49例 (40.5%)。巩固疗程的中位数为5(1~12)个。
AML伴t(8;21)的82例CR患者均进行了巩固治疗,采用标准剂量 Ara-C巩固治疗 33例(40.2%),中剂量Ara-C巩固治疗49例 (59.8%),1疗程中剂量Ara-C巩固治疗16例 (32.6%),2疗程及以上中剂量 Ara-C巩固治疗33例 (67.3%)(表2)。总的巩固疗程≤4个疗程者44例、>4疗程者38例。AML伴inv(16)/t(16;16)的39例CR患者均进行了巩固治疗,1例CR患者自动放弃巩固治疗。采用标准剂量 Ara-C巩固治疗 7例(17.9%),中剂量Ara-C巩固治疗32例 (82.1%),1疗程中剂量Ara-C巩固治疗16例 (41.0%),2疗程及以上中剂量Ara-C巩固治疗16例 (41.0%)。
至随访截止时,130例患者中66例存活;64例死亡,其中治疗相关死亡9例 (诱导治疗中死亡3例、巩固治疗中死亡6例);5例死于骨髓持续未缓解、33例死于复发、4例死于CR期其他疾病、失访13例、复发43例。130例患者的中位OS为51.64(0.26~132.5)个月 (图 1),中位 RFS未达(1.18~96.62)个月 (图2)。3年 OS率50%、5年OS率41%;3年RFS率59%、5年RFS率54%。

图 1 130例CBF AML患者的OS Kaplan-Meier曲线Fig 1 The Kaplan-Meier curve of the OS of 130 patients with CBF AML

图2 AML伴t(8;21)与AML伴inv(16)/t(16;16)患者RFS的Kaplan-Meier曲线Fig 2 The Kaplan-Meier curve of patients of AML with t(8;21)and AML with inv(16)/t(16;16)
影响疗效的因素
染色体核型:与CBF AML的OS具有显著相关性,其中伴9q-生存期短,预后差 (P=0.002)。染色体核型对AML伴t(8;21)和AML伴inv(16)/t(16;16)的OS影响差异具有统计学意义 (P=0.002),AML伴t(8;21)伴9q-生存期短,预后差 (表2),但染色体核型对 AML伴inv(16)/t(16;16)的预后影响相似,差异无统计学意义。染色体核型对CBF AML的RFS影响相似,差异无统计学意义 (P=0.41)。
年龄:与CBF AML的OS具有显著相关性 (P=0.016),年龄<45岁患者生存期长,预后好。年龄对AML伴t(8;21)和AML伴inv(16)/t(16;16)OS影响差异具有统计学意义 (P=0.007)(表2),其中>45岁的AML伴inv(16)/t(16;16)的生存期短,预后差,但年龄对于AML伴t(8;21)的OS影响相似,差异无统计学意义。对于CBF AML的RFS无明显影响,两者比较差异无统计学意义。
治疗情况:为了比较标准剂量和中剂量Ara-C对CBF AML在巩固治疗中的疗效,本研究取AML伴t(8;21)和AML伴inv(16)/t(16;16)患者相同随访时间的结果进行比较分析。结果说明:巩固治疗中采用≥2疗程中剂量Ara-C对CBF AML的OS影响最显著,缓解后治疗包括≥2疗程中剂量Ara-C患者与标准剂量 Ara-C、1疗程中剂量 Ara-C对 RFS影响相似,差异无统计学意义 (P>0.05)。缓解后治疗予 ≥2个疗程的中剂量Ara-C治疗可以明显改善生存 (P=0.013)(表3)。
讨 论
AML伴t(8;21)与AML伴inv(16)/t(16;16)在发病机制上均涉及CBF,临床上并称为CBF AML。AML伴t(8;21)发病机制为8q22与21q22易位形成AML1-ETO融合基因。AML1-ETO融合蛋白在其基因结构上与野生型AML1相似,从而替代野生型AML1基因与CBF β结合,抑制AML1靶基因的功能,导致造血前体细胞的发育异常而诱导AML的发生。AML伴 inv(16)(p12;q32)/t(16;16)产生的嵌合体融合基因为CBF β转录因子的氨基末端连接到MYH11基因,结果在胞浆内检测到大量的CBF β蛋白,CBF α/β的功能失去活性,导致 AML的发生。两者不仅发病机制存在共同之处,在临床治疗过程中也存在较多相似性,均有较高的临床缓解率,较长的无复发生存时间和生存期。在根据细胞遗传学对AML进行危险因素分组中,均列为预后良好核型组[3]。
表2 影响CBF AML生存的单因素分析 ()Table 2 Univariate analysis of factors influencing the survival of patients with CBF AML()
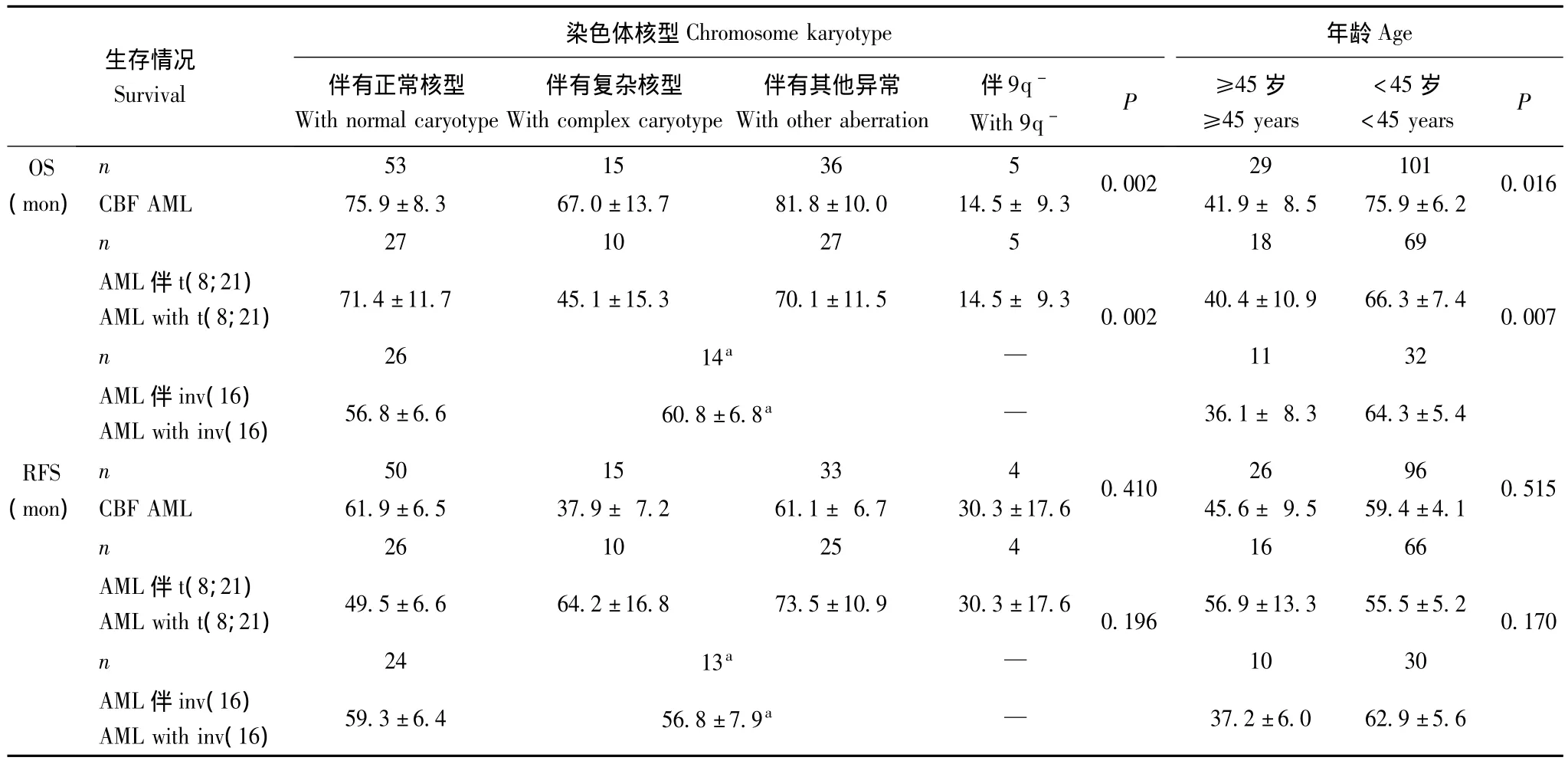
表2 影响CBF AML生存的单因素分析 ()Table 2 Univariate analysis of factors influencing the survival of patients with CBF AML()
AML伴inv(16):AML伴inv(16)/t(16;16);伴有正常核型包括染色体核型为正常核型和正常核型同时伴inv(16)/t(16;16)或t(8;21);—:AML伴inv(16)/t(16;16)患者中染色体核型检测中未出现伴有9q-;a:AML伴inv(16)组患者因单独伴有复杂核型和单独伴有其他异常均少见,故将伴有复杂核型和伴有其他异常两组合并为一组AML with inv(16):AML with inv(16)/t(16;16);With normal karyotype including normal karyotype and normal karyotype with inv(16)/t(16;16)or t(8;21);—:9q-was not detected during karyotype detection for patients with AML with inv(16)/t(16;16);a:This group of AML with inv(16)patients with complex karyotype and with other abnormalities are rare,so combine complex karyotype and with other abnormalities into one group
生存情况Survival染色体核型Chromosome karyotype伴有正常核型With normal caryotype伴有复杂核型With complex caryotype伴有其他异常With other aberration伴9q-With 9q-P年龄Age≥45岁≥45 years<45岁<45 years P OS(mon)n 53 15 36 5 0.002 29 1010.016 CBF AML 75.9±8.3 67.0±13.7 81.8±10.0 14.5± 9.3 41.9± 8.5 75.9±6.2 n 27 10 27 5 18 69 AML伴t(8;21)AML with t(8;21) 71.4±11.7 45.1±15.3 70.1±11.5 14.5± 9.3 0.002 40.4±10.9 66.3±7.4 0.007 n 26 14a—1132 AML伴inv(16)AML with inv(16) 56.8±6.6 60.8±6.8a —36.1± 8.3 64.3±5.4 RFS(mon)n 50 15 33 4 0.410 26 96 0.515 CBF AML 61.9±6.5 37.9± 7.2 61.1± 6.7 30.3±17.6 45.6± 9.5 59.4±4.1 n 26 10 25 4 16 66 AML伴t(8;21)AML with t(8;21) 49.5±6.6 64.2±16.8 73.5±10.9 30.3±17.6 0.196 56.9±13.3 55.5±5.2 0.170 n 24 13a—1030 AML伴inv(16)AML with inv(16) 59.3±6.4 56.8±7.9a —37.2±6.0 62.9±5.6
表3 巩固治疗中中剂量Ara-C对CBF AML生存情况的影响 ()Table 3 Influence of intermediate-dose Ara-C during consolidating therapy on the survival of patients with CBF AML()

表3 巩固治疗中中剂量Ara-C对CBF AML生存情况的影响 ()Table 3 Influence of intermediate-dose Ara-C during consolidating therapy on the survival of patients with CBF AML()
生存情况Survival标准剂量 Ara-C Standard dosage Ara-C中剂量Ara-C疗程Intermediate-dose Ara-C course 1疗程1 course ≥2疗程 ≥2 courses P n 40 32 49 OS(mon) 48.9±7.4 54.6±5.9 59.3±5.3 0.013 RFS(mon)57.5±8.1 47.8±6.5 61.9±5.6 0.254
AML伴t(8;21)与AML伴inv(16)/t(16;16)作为特殊的白血病亚型,两者之间存在不同的临床特征。本研究显示两者均多发于中青年,发病时外周血、骨髓的幼稚细胞比例相似。但AML伴inv(16)/t(16;16)具有发病时外周血高白细胞,肝、脾、淋巴结肿大的特点。本研究AML伴inv(16)/t(16;16)的发病的中位年龄为33岁,发病时白细胞中位数计数32.5×109/L,53.4%伴有脾大,46.5%伴有≥2个浅表淋巴结肿大,与其发病特征相符。法国 AML协作组对110例AML伴inv(16)/t(16;16)患者回顾性分析显示,发病时WBC中位数44×109/L,中位年龄34岁[5],发病时26%伴有脾大,36%伴有浅表淋巴结肿大,21%伴有肝大[6]。
AML伴t(8;21)免疫表型主要表达髓系抗原(CD13、CD33、MPO),与其他 AML相比,CD33、CD11b、CD36和CD14表达较低,但高表达CD34和HLA-DR抗原,同时常表达B细胞抗原CD19、PAX5、CD79a、CD54和 CD56,一般只表达于原始细胞亚群。AML伴inv(16)/t(16;16)在免疫表型上以髓系抗原表达为主 (CD13、CD33、MPO)和全部或部分单核细胞分化抗原表达 (CD14、CD15、CD11b、CD11c、CD64、CD36及溶菌酶),无特异性的抗原表达。本研究CBF AML病例均高表达CD34及髓系抗原CD13、CD33,AML伴t(8;21)CD19阳性率为44.87%、CD56阳性率为35.9%;AML伴inv(16)/t(16;16)以单核细胞分化抗原表达为主 (CD14、CD64),而CD19+CD56+双表达为AML伴t(8;21)特征性表型,在AML伴inv(16)/t(16;16)未检出。
AML伴t(8;21)常同时伴有其他的染色体异常,如-X/-Y,9q-, +8, +/-7及复杂核型,较常见的是性染色体的丢失。本研究60.8%的患者有继发的染色体异常,其中30.4%伴有性染色体丢失,14.5%伴有复杂核型,7.2%伴有9q-,4.3%伴有+7/-7,同时还伴有+/-8,+10及四倍体的病例。AML伴inv(16)/t(16;16)在细胞遗传学上有3种类型:inv(16)(p13q22)、del(16)(q22)和t(16;16)(p13;q22),其中以inv(16)(p13;q22)为多见。由于inv(16)为微量的重排,只能在1/3~2/3的病例中检测出 inv(16)的异常[7],需进一步通过RT-PCR、荧光染色体原位杂交等方法进行协助诊断。约30%的AML伴inv(16)/t(16;16)患者伴有复杂核型和其他染色体异常,其中以+8、+22多见,约占6%[8],较为少见的还有7q-、16q-。本研究证实 inv(16)/t(16;16)的检出率较t(8;21)低 (P<0.05)。细胞遗传学检查中17.5%的患者未检出inv(16)/t(16;16)而伴有CBF β-MYH11融合基因 (+),常见的伴随染色体异常为+22,占7%,较少见的为+/-7,-21等。
目前较一致的观点是CBF AML是一组预后较好的类型,获得良好的1疗程缓解率、无复发生存时间并延长生存期,主要是大剂量Ara-C在治疗中的应用[9]。美国国立综合癌症网络 (NCCN)指南已经将3~4疗程大剂量Ara-C作为本类型的巩固治疗方案。1994年癌症和白血病协作B组 (CALGB)开始在AML伴t(8;21)巩固治疗中采用大剂量Ara-C的方案,4年的无病生存率是60%[10]。此后多中心研究表明在AML伴t(8;21)巩固治疗中采用3~4疗程大剂量Ara-C可以获得5年总生存率76%,中位生存期>43个月,明显延长RFS、OS,优于标准剂量Ara-C、1 疗程大剂量 Ara-C[10]。大剂量的 Ara-C 在AML伴inv(16)的应用,也带来更高的生存时间及无病生存时间。CALGB报道AML伴inv(16)总体CR率86%,5年OS率达53%[1]。2004年CALGB报道采用 3~4疗程 HD-Ara-C的应用,5年 OS率达75%,5年RFS率达57%,但采用3~4疗程HD-Ara-C巩固治疗仅提高RFS,对OS的影响与采用1疗程HDAra-C巩固治疗相似[6]。我院从2002年开始在 AML伴t(8;21)、AML伴inv(16)/t(16;16)诱导及巩固治疗采用中剂量 Ara-C[2~3 g/(m2·d)],缓解后治疗中对中剂量Ara-C的依从性不理想,多数患者进行1、2个疗程,仅有3例完成3个疗程。接受≥2疗程中剂量Ara-C巩固治疗的患者与仅接受1疗程中剂量Ara-C巩固治疗或标准剂量Ara-C巩固治疗的患者比较,前者无复发生存时间、总生存时间均显著延长[11],临床观察结果与CALGB的报道相似,验证了CBF AML临床上诱导化疗缓解率高,总体生存期较长的特点。
综上,AML伴t(8;21)与AML伴inv(16)/t(16;16)存在各自独特的临床特征及预后影响因素,在临床治疗过程中尚需要采用个性化治疗,才能更好地提高患者疗效及预后。
[1]Byrd JC,Mrózek K,Dodge RK,et al.Pretreatment cytogenetic abnormalities are predictive of induction success,cumulative incidence of relapse,and overall survival in adult patients with de novo acute myeloid leukemia:results from cancer and leukemia group B(CALGB 8461)[J].Blood,2002,100(13):4325-4336.
[2]Rowley JD.Molecular genetics in acute leukemia [J].Leukemia,2000,14(3):513-517.
[3]Slovak ML,Kopecky KJ,Cassileth PA,et al.Karyotypic analysis predicts outcome of pre-remission and post-remission therapy in adult acute myeloid leukemia:a Southwest Oncology Group/Eastern Cooperative Oncology Group study [J].Blood,2000,96(13):4075-4083
[4]Cheson BD,Bennett JM,Kopecky KJ,et al.Revised recommendation of the international working group for diagnosis, standardization of response criteria, treatment outcomes,and reporting standards for therapeutic trials in acute myeloid leukemia [J].J Clin Oncol,2003,21(24):4642-4969.
[5]Jacques D,Norbert V,Thierry L,et al.Prognosis of inv(16)/t(16;16)acute myeloid leukemia(AML):a survey of 110 cases from the French AML intergroup [J].Blood,2003,102(2):462-469.
[6]John CB,Amy SR,Mrózek K,et al.Repetitive cycles of high-dose cytarabine benefit patients with acute myeloid leukemia and inv(16)(p13q22)or t(16;16)(p13;q22):results from CALGB 8461 [J].J Clin Oncol,2004,22(6):1087-1094.
[7]Koc Y,Oyan B,Kars A,et al.Randomized trial of continuous influsion versus bolus mitoxantrone in combination with cytarabine in newly diagnosed patients with acute myeloblastic leukemia [J].Hematol Oncol,2004,22(2):43-53.
[8]Prébet T,Boissel N,Reutenauer S,et al.Acute myeloid leukemia with translocation(8;21)or inversion(16)in elderly patients treated with conventional chemotherapy:a collaborative study of the French CBF-AML intergroup [J].J Clin Oncol,2009,27(28):4747-4753.
[9]Miyawaki S,Ohtake S,Fujisawa S,et al.A randomized comparison of 4 courses of standard-dose multiagent chemotherapy versus 3 courses of high-dose cytarabine alone in postremission therapy for acute myeloid leukemia in adults:the JALSG AML201 study[J].Blood,2011,117(8):2366-2372.
[10]Wahlin A,Billström R,Björ O,et al.Results of risk-adapted therapy in acute myeloid leukaemia.A long-term population-based follow-up study [J].Eur J Haematol,2009,83(2):99-107.
[11]Liu J,Mi Y,Fu M,et al.Intensive induction chemotherapy with regimen containing inter-mediate dose cytarabine in the treatment of de novo acute myeloid leukemia [J].Am J Hematol,2009,84(7):422-427.

