重组人骨形态发生蛋白-2原核表达及单克隆抗体制备
王 婧,张 杰,张 颖,马宁宁,谢良志
1中国医学科学院 北京协和医学院 细胞工程中心,北京 100005
2神州细胞工程有限公司,北京 100176
骨形态发生蛋白 (bone morphogenetic protein,BMP)是转化生长因子β超家族的成员,是广泛分布于动物骨组织的酸性蛋白质,在修复骨质缺损和促进骨折愈合、造血系统分化、神经发育和修复等方面发挥重要作用[1]。其中BMP-2诱导成骨的活性最强,是骨骼系统形成和正常发育所必不可少的因子。重组人骨形态发生蛋白2的成熟肽 (recombinant human bone morphogenetic-2 mature peptide,rhBMP-2m)已经被美国FDA批准用于骨质损伤、额面修复及脊椎融合,因此rhBMP-2m具有广泛的临床应用前景。目前,国内外关于rhBMP-2m及其单克隆抗体的生产一直受到工艺的限制不适合其推广应用,如复性困难、工艺难以放大等。本研究利用简单的原核表达系统 (E.coli)获得具有生物学活性的rhBMP-2m并制备能检测真核细胞表达rhBMP-2m的单克隆抗体,为rhBMP-2m研究和商业化生产奠定基础。
材料和方法
材料 雌性Balb/c小鼠 (北京维通利华实验动物技术有限公司);辣根过氧化物酶标记的兔抗鼠IgG(北京义翘神州生物技术有限公司);小鼠胚胎成骨细胞前体细胞MC3T3-E1(中国科学院上海生命科学研究院细胞资源中心);SP琼脂糖凝胶FF填料、反相层析 SOURCE30填料 (美国 GE公司);Tris-HCl、NaCl、尿素、尼克酸等化学试剂 (上海生工生物工程有限公司);大肠杆菌菌株BL21(DE3)/pET24-rhBMP-2m、瞬时转染的 pSTEP-rhBMP-2/293细胞株、转染试剂盒 (北京义翘神州生物技术有限公司)。高压均质仪 (加拿大 ATS工业系统有限公司);7L磁力搅拌罐 (上海保兴生物设备工程有限公司);高效高速冷冻离心机、台式高速离心机 (美国贝克曼库尔特有限公司)。
BL21(DE3)/pET24-rhBMP-2m发酵 取-70℃保存的BL21(DE3)/pET24-rhBMP-2m工程菌株,划LB琼脂平板,含30 mg/L卡那霉素,37℃培养20 h。挑取单菌落接种到2 ml MDG培养基中,培养过夜。然后以2%接种量转接到10 ml MDG中,培养8 h后,以此为种子接种到5L含有ZYM-5052培养基的发酵罐中,37℃,450 r/min搅拌,pH值7.0,培养过夜。收菌前取1 ml菌液,离心收集菌体细胞并超声破碎,用13%还原SDS-PAGE检测rhBMP-2m成熟肽的表达量及可溶性。在此以及之后的步骤中,所有SDSPAGE结果均使用BandScan软件分析。
包涵体的分离、溶解、纯化及复性 将培养过夜的菌液以6500 r/min,最小半径119 mm,最大半径222.8 mm,倾角20°,离心8 min,收集菌体,用细胞裂解液 (1 mmol/L EDTA、1%TritionX-100、1%Tween20、20 mmol/L Tris、pH 9.0)悬浮,高压均质仪破碎。破碎液以6500 r/min,最小半径119 mm,最大半径222.8 mm,倾角20°,离心40 min,弃去上清,收集沉淀,分离得到粗制包涵体。
粗制包涵体进一步使用含有0.5 mol/L尿素的细胞裂解液洗涤第2次,6500 r/min,最小半径119 mm,最大半径222.8 mm,倾角20°,离心40 min收集沉淀。之后,包涵体用溶解缓冲液 (8 mol/L尿素、50 mmol/L Tris、pH8.0)溶解过夜,第2天13000 r/min,最小半径25 mm,最大半径97 mm,倾角25°,离心10 min,收集上清并使用0.22 μm醋酸纤维膜过滤。
变性后的rhBMP-2m使用阳离子柱SP-Sepharose FF(1.6 cm×15 cm)分离纯化。上样前使用缓冲液A(8 mol/L尿素、50 mmol/L Tris、pH7.0)平衡,使用含有1 mol/L NaCl的缓冲液A线性洗脱,每10毫升体积收集一管洗脱液,待SDS-PAGE分析后合并纯度较高的洗脱蛋白组分。洗脱组分通过直接稀释到含有0.75 mol/L尼克酸复性缓冲液,去除变性剂达到复性效果[1]。复性后的蛋白样品使用RPCSource30(1.1 cm×15 cm)分离纯化,上样前使用含有1‰三氟乙酸的去离子水平衡,使用同样含有1‰三氟乙酸的乙腈线性洗脱。合并rhBMP-2m同源二聚体含量相当组分,得到样品Ⅰ和样品Ⅱ。
重组人BMP-2成熟肽活性测定 根据文献[2],小鼠胚胎成骨细胞前体细胞MC3T3-E1在rhBMP-2m刺激培养下向成骨细胞转化,特征性产生碱性磷酸酶。本研究采用含有rhBMP-2m浓度分别为10000、5000、2500、1250、625、312.5、156.25、78.125、39.063、0 ng/ml的条件培养基培养MC3T3-E1细胞,通过测定每个培养条件下的碱性磷酸酶活性变化分析rhBMP-2m的生物学活性,进行3次平行实验。
以每孔2×104个细胞/孔接种 MC3T3-E1于96孔细胞培养板中,在含有10%FBS α-MEM培养基中培养48 h,随后换不含FBS的培养基继续培养24 h,之后换含有1%FBS的条件培养基 (即含有不同浓度rhBMP-2m)刺激培养72 h。最后,吸去培养上清,使用事先预冷的PBS洗板两次,然后每孔中加入100 μl含有10 mmol/L对硝基苯磷酸二钠盐的裂解液,37℃反应30 min,加入1 mol/L NaOH终止反应,在405 nm波长处测定样品所吸收的光密度值。
重组BMP-2成熟肽单克隆抗体的制备 用复性纯化得到的rhBMP-2m样品Ⅰ免疫小鼠,单克隆抗体制备具体过程参照《细胞与分子免疫学实验技术》第二章[3]。
免疫印迹鉴定 将复性纯化得到的rhBMP-2m样品Ⅰ进行还原及非还原SDS-PAGE电泳,用半干转方法将凝胶蛋白带转移到聚偏氟乙烯膜上,5%牛血清蛋白封闭过夜,加入单克隆抗体,室温2 h后加入辣根过氧化物酶标记的兔抗鼠 IgG,最后使用辣根过氧化物酶特异性底物DAB显色。同样的方法,使用pSTEP-rhBMP-2瞬时转染的293细胞裂解液鉴定所获得单克隆抗体的特异性。
结 果
rhBMP-2m的诱导表达 工程菌BL21(DE3)/pET24-rhBMP-2m进行自诱导发酵,发酵液体积为5 L,收样前取样检测其在600 nm处的光密度值为13。13% 还原SDS-PAGE电泳分析 (图1),诱导后全菌在相对分子质量约13000处有一条高表达的蛋白条带,约占全菌蛋白的40%,破菌后80%以上目的蛋白以不溶解的包涵体形式存在。
rhBMP-2m包涵体溶解、纯化及复性结果 SDS-PAGE电泳结果显示,在300~450 mmol/L NaCl间洗脱样品纯度达到90%(图2)。取该样品进行稀释复性,复性率达到75%,即在非还原SDS-PAGE中显示复性后二聚体的含量占总蛋白量的75%。复性后样品浓度小于0.1 mg/ml,纯度约70%。
复性后样品使用反相层析纯化目的蛋白主要在30%~45%乙腈浓度下获得。纯化后获得两组样品,样品Ⅰ浓度为0.7 mg/ml,二聚体占蛋白总量的85%以上;样品Ⅱ浓度为0.28 mg/ml,二聚体占蛋白总量的40%(图3)。两组样品在还原性SDS-PAGE结果中显示纯度均大于95%。在其后的rhBMP-2m单克隆抗体制备及免疫印迹鉴定实验中所使用的样品均为样品Ⅰ。

图1 rhBMP-2m诱导表达及可溶性还原电泳分析Fig 1 Reduced SDS-PAGE analysis of rhBMP-2m induced expression and its dissolubility

图2 变性rhBMP-2m阳离子层析柱纯化结果还原电泳分析Fig 2 Reduced SDS-PAGE analysis of denatured rhBMP-2m purified by cation exchange chromatography
rhBMP-2m活性鉴定结果 复性纯化后获得的rhBMP-2m样品Ⅰ和Ⅱ在40~5000 ng/ml均表现出生物学活性,随着rhBMP-2m的浓度增加,MC3T3-E1细胞产生的碱性磷酸酶活力呈对称S形曲线增长。在相同rhBMP-2m浓度下,MC3T3细胞中样品Ⅰ诱导产生的碱性磷酸酶活性比样品Ⅱ诱导产生的碱性磷酸酶活性高 (图4)。

图4 诱导MC3T3-E1中碱性磷酸酶活性鉴定样品Ⅰ和Ⅱ的生物学活性Fig 4 Biologic activities of samplesⅠandⅡ were measured by the induction of alkaline phosphatase activity in MC3T3-E1 cells
单克隆抗体的获得及鉴定 共筛选得到2株rh-BMP-2m单克隆抗体,分别命名为MM01H和MM03H。采用rhBMP-2m样品Ⅰ进行免疫印迹分析,还原SDS-PAGE条件下免疫印迹结果显示MM01H和MM03H均在相对分子质量13000处杂交出特异性条带,相对分子质量与rhBMP-2m单体相符合;非还原SDS-PAGE条件下免疫印迹结果显示MM01H和MM03H均在相对分子质量26000处杂交出特异性条带,相对分子质量与rhBMP-2m二聚体相符合(图 5)。

图5 免疫印迹分析MM01H单抗和MM03H单抗对抗原的识别Fig 5 Western blot of antigen using MM01H antiboy and MM03H antibody
采用瞬时转染 (转入pSTEP-rhBMP-2质粒)的293细胞裂解液进行免疫印迹分析,结果显示两株单克隆抗体在相对分子质量50000~55000杂交出清晰的条带,相对分子质量与糖基化的全长rhBMP-2(396aa)单体相符合。其中单克隆抗体MM03H免疫印迹结果显示在相对分子质量18000附近出现杂交条带,相对分子质量与糖基化修饰的rhBMP-2成熟肽单体相符合 (图6)。
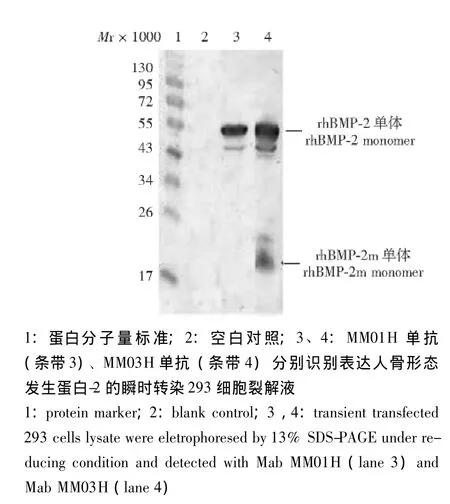
图6 免疫印迹分析MM01H单抗和MM03H单抗对表达人骨形态发生蛋白-2全长基因的瞬时转染293细胞裂解液的识别Fig 6 Western blot of expressing total gene of human morphogenetic protein-2 transient transfection 293 cells lysate using MM01H and MM03H
讨 论
人BMP-2的cDNA编码区全长1188bp,编码396个氨基酸,相对分子质量约45000,基因定位于染色体20p-12。经翻译形成前体蛋白,酶切去氨基端的信号肽、前肽后,得到由114个氨基酸组成的成熟肽,相对分子质量约13000。人BMP-2成熟肽包括7个半胱氨酸,其中6个形成分子内二硫键,1个形成分子间二硫键,成熟肽的同源或异源二聚体BMP-2才具有生物活性[1]。使用Vector NTI Suite9软件分析其结构,结果显示rhBMP-2m具有较强的疏水性。本研究用E.coli工程菌株表达出人BMP-2成熟肽段 (rh-BMP-2m),80%目的蛋白以包涵体形式存在,表明rhBMP-2m包涵体经复性形成具有生物学活性的rh-BMP-2m二聚体非常困难。相对真核表达系统,原核表达系统具有遗传背景清楚、目标基因表达水平高、培养周期短等特点。因此,在解决蛋白复性的基础上,原核表达系统表达生产rhBMP-2m是能够将治疗性rhBMP-2m推向临床应用的良好途径。
第四军医大学陈苏民课题组[4]采用透析法复性,虽然复性过程中目的蛋白浓度可以达到6 mg/ml,但是其中只有1/3的目的蛋白形成rhBMP-2m二聚体,且该课题组得到的rhBMP-2m细胞生物学活性的最低浓度仅为2μg/ml。同时,采用透析法复性在工艺放大时有一定的局限性。Yano等[5]和 Long等[6]的研究显示具有生物学活性的rhBMP-2m最低浓度为30~50 ng/ml。但是文献 [5-6]中提供的复性方法具有相同的缺点,即复性过程复杂 (一般在稀释复性后还需要经过至少两步换液)、最终样品浓度极低 (<20μg/ml)、稳定性差 (在浓缩过程中容易沉淀)。
本研究采用简单的稀释复性法获得了具有生物学活性的rhBMP-2m,虽然rhBMP-2m在复性后纯度有所减低,分析原因可能是复性过程中一些错误折叠使rhBMP-2m有不同的构象。复性后样品经一步纯化即可得到高纯度和高浓度rhBMP-2m蛋白样品。其中rhBMP-2m二聚体占总蛋白量85%以上的样品Ⅰ在40 ng/ml时即表现出生物学活性,复性后样品中正确折叠的二聚体含量与蛋白生物学活性密切相关。本研究采用的工艺,复性缓冲液成分简单、纯化成本低、稳定性好,成功解决了复性困难、复性后样品难浓缩等难题,容易放大到规模化生产。
关于rhBMP-2m的单克隆抗体制备目前报道较少,分析原因可能为免疫的抗原难以制备,同时BMP-2m各物种间高度保守,免疫原性弱,只有轻微的免疫刺激能力[7]。本研究通过原核表达 (E.coli),复性获得具有生物学活性的rhBMP-2m作为抗原免疫小鼠,并用于抗体筛选,最终获得两株结合力强、特异性良好的单克隆抗体 (图5)。获得的单克隆抗体可用于建立rhBMP-2m的检测方法,用于检测其他表达系统的表达量,筛选高表达的细胞株。
瞬时转染 (转入pSTEP-rhBMP-2质粒)的293细胞裂解液免疫印迹显示,rhBMP-2在前体蛋白显色位置在相对分子质量为50000~55000,比理论相对分子质量45000高,是由于rhBMP-2前体蛋白被糖基化,即糖基化发生在其剪切成为成熟肽之前。笔者推测,这种糖基化可能发挥稳定蛋白结构的作用,对rhBMP-2m向细胞外分泌及活性具有重要的意义。
综上,本研究的重要意义是:(1)为今后建立E.coli表达rhBMP-2m规模化生产工艺奠定基础;(2)获得具有结合力强、特异性好的单克隆抗体,为进一步研究生理条件下BMP-2相关疾病的发生提供检测方法;(3)建立抗体检测方法,为rhBMP-2m在其他表达体系中的研究提供监测手段。
[1]Vallejo LF,Brokelmann M,Marten S,et al.Renaturation and purification of bone morphogenetic protein-2 as inclusion bodies in high-cell-density cultures of recombinant Escherichia coli[J].Biotechnology,2002,94(2):185-194.
[2]Kawazoe Y,Shiba T,Nakamura R,et al.Induction of calcification in MC3T3-E1 cells by inorganic polyphosphate [J].J Dent Res,2004,83(8):613-618.
[3]金伯泉.细胞与分子免疫学实验技术[M].西安:第四军医大学出版社,2002:9-16.
[4]王馥丽.高浓度rhBMP-2m复性条件的探讨[D].西安:中国人民解放军第四军医大学,2005.
[5]Yano K,Hoshino M,Ohta Y,et al.Osteoinductive capacity and heat stability of recombinant human bone morphogenetic protein-2 produced by Escherichia coli and dimerized by biochemical processing[J].J Bone Miner Metab,2009,27(3):355-363.
[6]Long S,Truong L,Bennett K,et al.Expression,purification,and renaturation of bone morphogenetic protein-2 from Escherichia coli[J].Protein Expr Purif,2006,46(2):374-378.
[7]安新玲,韩金祥,王世力.骨形态发生蛋白的研究进展[J].食品与药品,2009,11(11):69-72.

