SIK2 shRNA重组腺病毒载体构建及其在3T3-L1脂肪细胞的表达
杜 静,杜 玲,宴耀明,周 薇,陆 红,邹德学
(1.北京大学深圳医院,广东深圳 518036;2.襄樊市中医院,湖北襄樊 441000)
随着人们生活质量的提高,肥胖症与高脂血症的发病率日趋上升,已危害到人们的身体健康和生活质量,其防治成为当今亟待解决的问题。肥胖和高脂血症的主要原因是能量代谢失衡。有研究表明SIK2是一种重要的脂肪组织特异性的能量调控蛋白,在脂肪细胞的能量代谢中发挥着重要的调节作用[1]。RNA干扰技术(RNA interfering,RNAi)是近年来迅速发展起来的生物技术,已成为基因功能研究以及基因治疗的强有力工具[2]。实验以短发夹(Short hair RNA,shRNA)腺病毒为介导,构建靶向干扰脂肪细胞SIK2基因的表达载体,为进一步研究SIK2的功能提供技术手段,对于了解SIK2在脂代谢中的作用和调控机制具有重要意义。
1 材料与方法
1.1 材料3T3-L1细胞系购自ATCC公司。Lipofectamine 2000 脂质体和 Trizol、Adenoviral RNAi表达系统试剂盒购自Invitrogen公司。腺病毒纯化试剂盒购自Cell Biolabs公司。二抗为HRP标记的羊抗鼠IgG抗体、SIK2兔抗鼠抗体、化学发光试剂均购自Santa Cruz公司。胰蛋白酶购自Gibco公司。M-MLV逆转录酶(molony murine leukemia virus reverse transcriptase)购自 Promega公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自Amersham公司,DMEM和胎牛血清购自Gibco公司。SIK2和三磷酸甘油醛脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH)PCR引物由北京奥科生物技术有限公司合成,其余试剂均购自上海生物工程公司。
1.2 方法
1.2.1 重组腺病毒的设计 单链oligo、引物和探针设计:参照已发表的SIK2序列(NM-015191)设计互补ss oligos和引物,见表1。

表1 单链oligo引物设计
Oligo正义链中cgaa序列和反义链中ttcg序列为短发夹RNA的茎环结构,底划线部分序列为和穿梭质粒连接时的接头设计。以上序列由Invitrogen公司合成。
1.2.2 构建shRNA重组腺病毒 单链oligos经95℃变性5 min,与Invitrogen公司提供的线性化卡那霉素抗性pENTR/U6载体进行连接得到pENTR/U6-sh-RNA-SIK2穿梭质粒,转TOP10感受态菌扩增。挑不同单克隆菌送Invitrogen公司测序鉴定。LipofectamineTM2000脂质体转染pENTR/U6-shRNA-SIK2质粒进入3T3-L1细胞。Trizol提取总RNA,以三磷酸甘油醛脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH)的表达作为内参(相应引物的序列见表1)。Real-time RT-PCR筛选最有效RNA干扰pENTR/U6-shRNA-SIK2质粒。筛选得到pENTR/U6-shRNASIK2穿梭质粒、pENTR/U6-shRNA空质粒和腺病毒骨架质粒pAd/BLOCK-iTTm-DEST进行同源重组,氨苄青霉素选择培养基筛选阳性克隆。以空重组质粒作为对照,重组pAd-shRNA-SIK2质粒经Pacl酶切后,用LipofectamineTM2000脂质体转染70%贴壁的HEK293A细胞。收集完全病变培养孔中的细胞及培养液,-20℃和37℃反复冻融3次,上清加入293A细胞中继续感染扩增腺病毒。经多轮感染后获得高滴度的Ad-shRNA-SIK2重组腺病毒和空载体病毒。
1.2.3 重组腺病毒纯化、浓缩和滴度测定 按照试剂盒说明书操作,采用特殊的纯化膜从腺病毒粗提取液中特异性吸附病毒颗粒进行纯化和浓缩。病毒的滴度通过测定游离病毒颗粒的吸光度值进行确定(在260 nm处的1个吸光度值相当于1012病毒颗粒/ml)。提纯后的重组腺病毒浓度可达到0.5×1012病毒颗粒/ml。
1.2.4 3T3-L1前脂肪细胞的诱导分化 3T3-L1细胞按照常规的贴壁细胞方法培养。在细胞状态良好时,传代分瓶(1×105/ml),细胞接触抑制两天后加入含10%胎牛血清的DMEM培养液(含0.5 mM 3-异丁基-1甲基黄呤、10 μ g/ml胰岛素 、0.25 μ M 地塞米松)培养两天,接着换成含10%胎牛血清的DMEM培养液(含10μ g/ml胰岛素)培养两天,最后改为含10%胎牛血清的DMEM培养,每两天换液,直至90%的细胞为成熟的脂肪细胞。
1.2.5 Ad-shRNA-SIK2腺病毒载体转染成熟的3T3-L1,Real-time RT-PCR检测脂肪细胞中SIK2 mRNA的表达 脂肪细胞分别用 2.5×1010、1×1011、2.5×1011纯化病毒颗粒/ml Ad-shRNA-SIK2腺病毒和空载体病毒转染成熟3T3-L1脂肪细胞,并以空载体病毒作为阴性对照,更换培养液后在37℃细胞培养箱中继续培养48小时后,收集细胞,提取细胞总RNA,Real-time RT-PCR检测脂肪细胞中SIK2 mRNA的表达。挑选最佳感染病毒浓度。
1.2.6 Western blot分析沉默效果 pAd-shRNA-SIK2重组病毒和对照空载体腺病毒分别感染3T3-L1分化脂肪细胞48 h后,收集细胞用PBS洗涤3次,提取总蛋白,按《分子克隆实验操作指南》取等量蛋白20 g经十二烷基硫酸钠/聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白,然后电转移至PVDF膜上,一抗分别为SIK2兔抗鼠多克隆抗体和兔抗鼠β-actin多克隆抗体,二抗为HRP标记的山羊抗兔lgG。用化学发光法显色蛋白表达水平。
1.2.7 统计分析 用SPSS 11.0软件进行统计分析。所有计量资料采用均数±标准差(¯x±s)来表示,组间比较采用t检验。以P<0.05为显著统计学差异。
2 结果
2.1 pENTR/U6-shRNA-SIK2穿梭质粒的测序结果送3个穿梭质粒测序后,证实所设计ds oligo已经正确插入pENTR/U6载体中,位于人u6启动子和PolⅢ终止子之间。
2.2 pENTR/U6-shRNA-SIK2穿梭质粒转导3T3-L1细胞后,RT-PCR筛选最佳穿梭质粒:将构建好的3个质粒转导入脂肪细胞后,第5天用Real-time PCR检测3T3-L1脂肪细胞SIK2 mRNA的基因表达,结果以目标基因与GAPDH基因表达的比值表示,结果显示SIK2 shRNA-1,2,3均对SIK2有明显的抑制作用(P<0.05),其中SIK2 shRNA-2对 3T3-L1细胞SIK2表达抑制作用最强,抑制率为86%(图1)。
2.3 不同浓度的Ad-shRNA-SIK2腺病毒载体转染成熟的3T3-L1细胞后,RT-PCR筛选最佳转染浓度:以空载体为对照,Real-time PCR测量三种浓度的2.5×1010、1×1011、2.5×1011纯化腺病毒颗粒/ml转染脂肪细胞后的SIK2mRNA的基因沉默效率。结果显示三种浓度纯化腺病毒颗粒均对成熟的3T3-L1细胞SIK2 mRNA表达有明显的抑制作用(P<0.05),其中2.5×1011纯化腺病毒颗粒/ml的浓度沉默效率最高,达到71%(图2)。

图1 pENTR/U6-shRNA-SIK2穿梭质粒干扰SIK2 mRNA基因表达效果
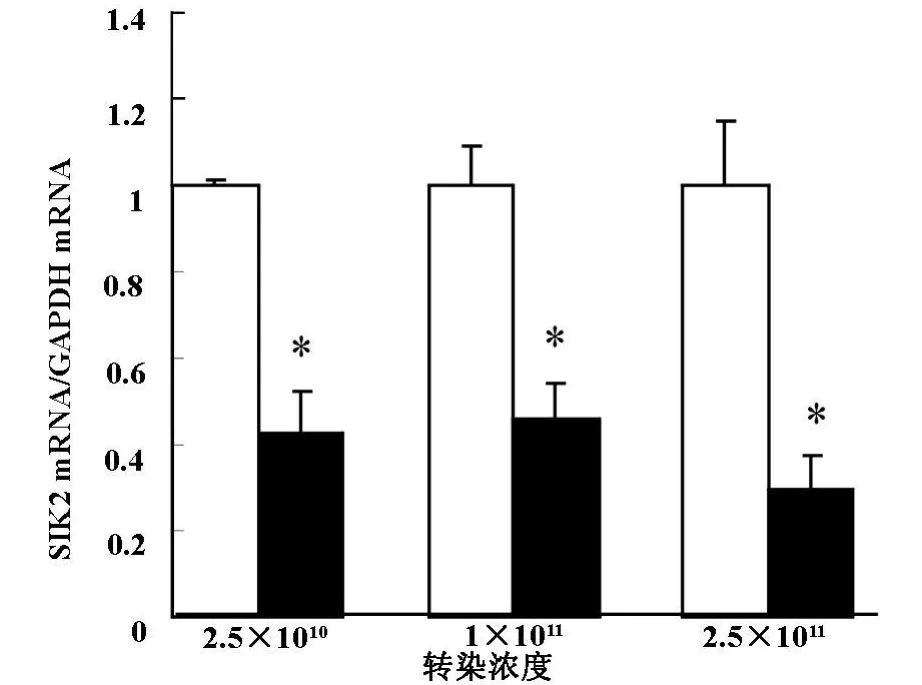
图2 Ad-shRNA-SIK2腺病毒载体干扰SIK2 mRNA基因表达效果
2.4 Western blot检测3T3-L1脂肪细胞Ad-shRNASIK2腺病毒载体的RNA干扰SIK2蛋白表达效果:用2.5×1011病毒颗粒/ml Ad-SIK2腺病毒转染成熟3T3-L1脂肪细胞48 h后,收集细胞经蛋白质印迹分析,可见感染空载体腺病毒的细胞分子量约为120 kD的条带,而感染pAd-SIK2重组病毒的细胞条带明显降低,见图3。

图3 Ad-shRNA-SIK2腺病毒干扰SIK2的蛋白表达
3 讨论
肥胖已成为严重危害人类健康的社会问题。现有大约十亿的成年人是超重,其中3亿成年人是肥胖。肥胖和超体重是高血压、Ⅱ型糖尿病、心血管疾病、脑卒中等多种疾病的重要危险因素[3]。控制肥胖,减少机体脂肪聚集可降低心脑血管等疾病的危险性和发病率。能量代谢失衡是导致肥胖的根本原因。作为细胞能量监测器,腺苷酸活化蛋白激酶(AMPK,5'AMP activated protein kinase)系统一直密切监视着细胞的能量状态。AMPK的活性受AMP/ATP比值的调节。应激反应可通过ATP的产生减少或利用增加,使细胞内AMP/ATP的比值增加,从而激活AMPK。激活的AMPK可激发一系列的反应来恢复细胞内的能量平衡。AMPK可启动分解代谢途径,如脂肪酸氧化和糖酵解,从而增加ATP的产生,同时关闭合成代谢途径,如脂肪酸合成和蛋白合成,减少ATP的消耗[4]。目前AMPK在肌肉和肝脏的能量代谢中的作用有广泛的研究,有关AMPK在脂肪组织中的研究较少,作用并不明确。
SIK2是AMPK家族中的丝氨酸/苏氨酸激酶,相对特异性地在脂肪组织表达[5]。有文献报道肥胖或糖尿病老鼠脂肪组织中SIK2的活性升高[6],饥饿时脂肪组织的SIK2表达显著升高[1],SIK2可能是脂肪组织能量的代谢重要调节因子,起着AMPK样的能量感受器作用。明确SIK2在体内脂肪组织内的作用和分子机制,有助于对肥胖和II型糖尿病脂代谢紊乱的理解和认识。本实验采用RNAi技术,以SIK2为靶基因,设计三对编码SIK2shRNA的寡核苷酸链,定向克隆至 shRNA质粒表达载体pENTR/U6-shRNA穿梭质粒,在3T3-L1细胞中表达筛选RNA干扰效率最高的一对SIK2 shRNA-2。通过同源重组,在体外构建表达SIK2 shRNA的腺病毒表达载体。纯化的载体转染到成熟的3T3-L1脂肪细胞系后,在U6启动子作用下在细胞内转录出单链RNA,转录体自身折叠形成特异的短发夹结构shRNA,在细胞内产生发夹状的siRNA,进而特异性导致SIK2 mRNA降解,长期而有效地沉默了小鼠成熟脂肪细胞3T3-L1的SIK2蛋白的表达。本实验通过腺病毒介导的基因转移技术,成功转染3T3-L1成熟脂肪细胞系,特异性地干扰SIK2 mRNA表达(71%),进而导致SIK2蛋白的合成明显减少。SIK2 shRNA腺病毒表达载体的成功构建为进一步观察SIK2基因在脂肪细胞中的作用和分子机制,研究SIK2与肥胖的关系提供了实验基础。随着对SIK2的深入研究,必将促进肥胖病脂代谢紊乱的研究发展,为研究肥胖的基因治疗提供新思路。
[1]Du J,Chen Q,Takemori H,Xu H.SIK2 inhibits expression of lipogenic genes in adipocytes[J].Obesity,2008,16(3):531.
[2]Reynolds A,Leake D,Boese Q,et al.Rational siRNA design for RNA interference[J].Nat Biotechnol,2004,22(3):326.
[3]黄 辉,陈 洁,王景峰,等.EETs下调在高脂诱导肥胖相关高血压中的作用[J].中国病理生理杂志,2008,24(11):2113.
[4]Kahn BB,Alquier T,Carling D,and Hardie DG.AMP-activated protein kinase:ancient energy gauge provides clues to modern understanding of metabolism[J].Cell Metab,2005,1(1):15.
[5]Katoh Y,Takemori H,Horike N,et al.Salt-inducible kinase(SIK)isoforms:their involvement in steroidogenesis and adipogenesis[J].Mol Cell Endocrinol,2004,217(1-2):109.
[6]Horike N,Takemori H,Katoh Y,et al.Adipose-specific expression,phosphorylation of Ser794in insulin receptor substrate-1,and activation in diabetic animals of salt-inducible kinase-2[J].J Biol Chem,2003,278(20):18440.

