TGF-β1对钛表面成骨相关蛋白基因表达的影响*
郑纪伟 韩斐斐 王 瑾 韩建国 丁志江
中国社会渐步入老龄化,牙体缺失情况越来越严重,随着经济水平的增长及对美观要求的提高,种植作为修复缺失牙的重要手段变得越来越重要。种植成功的关键在于形成良好的种植体-骨界面[1],如何获得这种理想的种植体-骨界面结合方式,影响因素主要有种植体、成骨细胞功能和其他外在因素等。外源性细胞因子对成骨细胞的功能具有重要的调节作用,TGF-β1就是其中一类重要的多肽类生长因子。鉴于TGF-β1对于成骨细胞作用的复杂性和多样性,以及有关TGF-β1对接种于钛片表面的成骨细胞作用的报道相对较少,本研究采用体外实验的方法,探讨特定浓度的TGF-β1对钛表面成骨细胞的增殖、分化的影响。
1. 材料与方法
1.1 实验材料和主要仪器 MC3T3-E1成骨细胞系(ATCC中心,美国);TGF-β1(Peprotech公司,英国);GAPDH引物及其它引物均由上海生工合成(见表1)。
纯钛片(Strauman公司,瑞士)TA2,直径15mm,厚约1mm,使用喷砂机用TiO2均匀喷砂处理3min,10%盐酸处理1min,去离子水清洗,5%碳酸氢钠中和,去离子水清洗三次,高温高压消毒备用。
1.2 实验方法
1.2.1 细胞培养及钛片表面细胞接种 取出冻存的成骨细胞,置42℃水浴使其快速融化。转移至离心管,磷酸盐缓冲液(Phosphate buffer saline,PBS)冲洗,DMEM完全培养液重悬。转移至培养瓶,加入含10%胎牛血清的完全DMEM培养液,置37℃,5%CO2培养箱中培养,待细胞长成单层后,倒掉瓶内的培养液,加少许消化液,静置5~10分钟。倒掉消化液,制成细胞悬液,送回二氧化碳培养箱培养。将处理好的钛片置于6孔培养板中,每孔六片,平铺板底。取处对数生长期的成骨细胞,0.25%胰酶+0.02%EDTA消化,DMEM培养基混悬成单细胞悬液,调整细胞浓度1×105个/ml,取100ul滴种于钛片表面,置于CO2培养箱中培养。4~6h后加入含10%胎牛血清的DMEM培养液2ml,放入CO2培养箱中继续培养。细胞贴壁后,3d换液一次。
1.2.2 TGF-β刺激 实验分为实验组和对照组,实验组加入0.5ng/ml TGF-β1刺激细胞,对照组不加TGF-β1,采用酶消化法分别收集培养后1d,3d,7d后的细胞,每孔中六块钛板的细胞作为一个样本,应用RT-PCR检测蛋白表达情况并做对比分析。
1.2.3 逆转录聚合酶链反应(RT-PCR)(1)总RNA提取:采用TRlzol试剂盒,提取总RNA,紫外分光光度计测定260nm和280nm处的OD值,检测总RNA的纯度,并做快速琼脂糖电泳,分析RNA的完整性。(2)逆转录为cDNA。(3)以此为模板行PCR反应。反应体系为10×PCR Buffer 5μl,25mmol/L MgCl23μl,10mmol/L dNTP 1μl ,Primer1 1μl,Primer2 1μl,cDNA 3μl,5U/μl Taq DNA polymerase 0.8μl, sterilized ddH2O 35.2μl。反应条件:94℃预变性4min后,以92℃变性40秒,按照表1中所列出的最佳退火温度退火45秒,72℃延伸1分40秒,为一个循环,共35个循环,最后再于72℃延伸15min。(每样本重复三管)(4)产物经1.0%琼脂糖电泳,并经凝胶成像系统分析。

表1 引物序列、产物大小及退火温度
1.2.4 成像系统分析及统计学处理 体外实验中基因的表达量与电泳条带的亮度成正比,以GAPDH为内参照,Gene Ruler100bpDNA Ladder为标记,对电泳条带进行图像光密度半定量分析,RT-PCR产物经1.0%琼脂糖电泳,并经成像系统分析后得到各个条带的灰度值,用目的基因的灰度值比上内参的灰度值就是这个基因相对表达的量,防止因细胞数目差异而造成误差。测量和计算各组目的扩增带与内参灰度值的比值,数据均以均数±标准差表示,采用SPSS 11.0软件包进行统计学处理,组间比较应用方差分析和q检验分析,P<0.05认为差异有显著性意义。
2. 结果
2.1 培养细胞形态学观察
成骨细胞铺板后24h,大部分细胞贴壁,呈纺锤形,大部分细胞带有突起,数目和长短不一,且形成分散的集落,大小不等,融合后呈复层生长(见图1)。
2.2 TGF-β1刺激后OC、BSP、COL-I和内参在不同培养时间的成骨细胞中的表达对照情况(图2-8,表2)
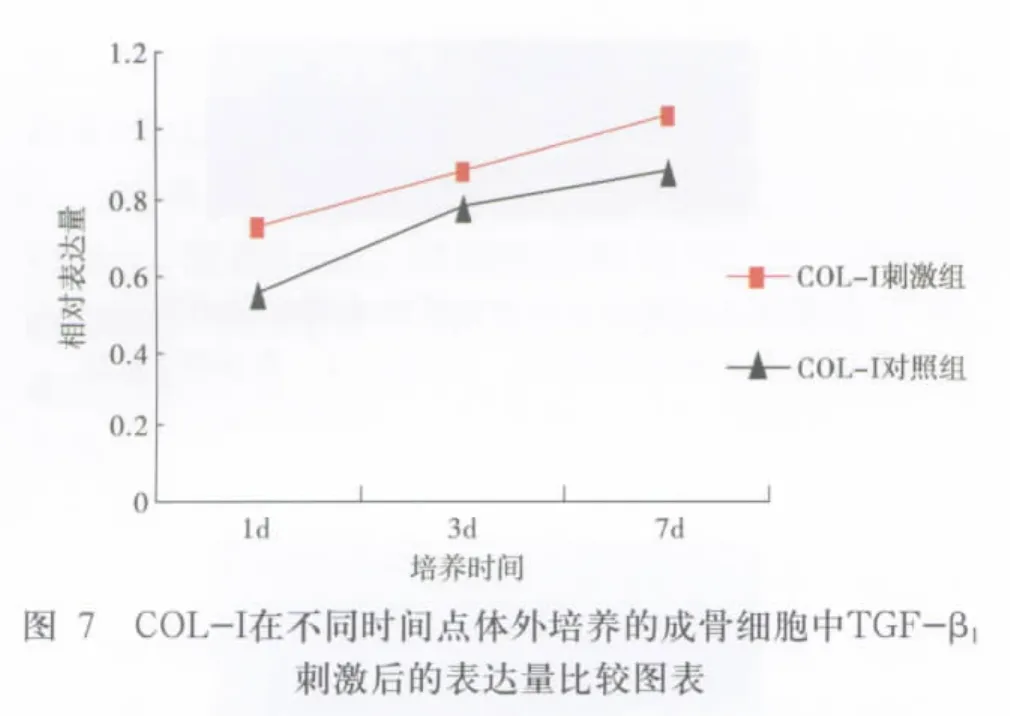
外源性TGF-β1加入后,对几种细胞因子表达影响的相对半定量分析结果如表2。由图2-图7可以看出,与对照组相比,实验组中OC、BSP和Col-I表达量均有显著增加,且统计学分析组内及组间比较P<0.05,表达量变化均有统计学意义。图8为内参在不同时间点体外培养的成骨细胞中0.5ng/mlTGF-β刺激前后的表达对照情况,1-6泳道中均可见大小约250bp左右的电泳条带,与设计的片段大小基本一致。凝胶成像系统光密度分析后可见各组内参表达量基本一致。





表2 RT-PCR相对半定量分析TGF-β1刺激后体外培养的成骨细胞各个时间点三种细胞因子的表达结果(±s,n=9)
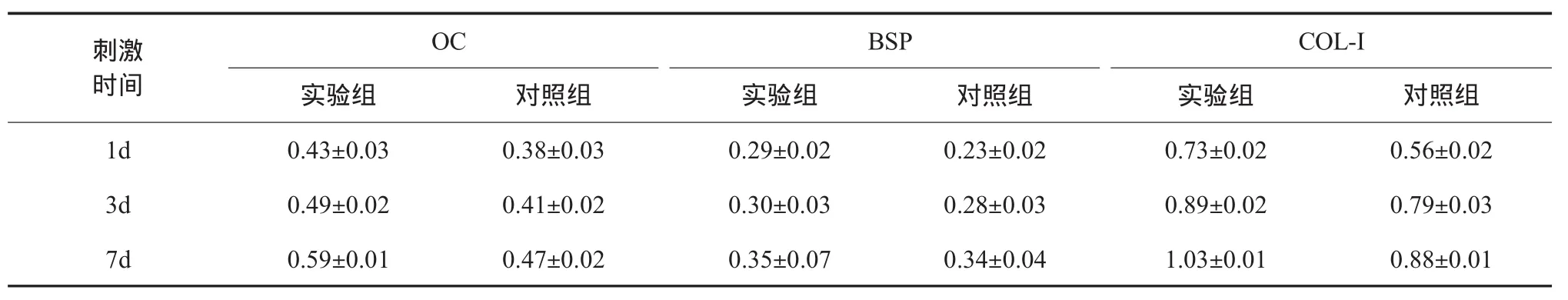
表2 RT-PCR相对半定量分析TGF-β1刺激后体外培养的成骨细胞各个时间点三种细胞因子的表达结果(±s,n=9)
注:每种蛋白各时间点之间比较,P<0.05,均有统计学意义。
?
3.讨论
种植体植入牙槽骨的机械创伤使周围骨组织释放大量生长因子,启动骨的修复,达到种植体周围骨性融合。成骨细胞是骨改建过程中最重要的功能细胞,同时也是种植体-骨界面形成过程中最活跃的细胞之一,在这个过程中,多种生长因子通过刺激成骨细胞的增殖和活性,对种植体周围骨的生长起着重要的调控作用。TGF-β1就是其中重要的多肽生长因子,它的应用能够有效的促进种植体的骨整合,是目前所知的作用最为复杂和多样的生长因子,参与调控组织修复和重建,并能诱导成骨细胞的分化[2-3]。本研究选用钛片模拟种植体,通过体外构建成骨细胞模型,加入特定浓度TGF-β1刺激细胞生长,利用RT-PCR的方法,检测不同时间TGF-β1刺激后体外培养的成骨细胞中几种蛋白因子的表达情况,探讨TGF-β1对钛片表面成骨细胞增殖分化的影响,为临床种植体的设计和应用提供相应的实验依据。

本实验细胞来自美国ATCC中心的MC3T3-E1成骨细胞系,可采用液氮冷冻等方式长期保存,经多次传代后其遗传性质及生物学特征均不发生变异,复苏后的冻存细胞仍具有稳定的生物学特征,因此可以为体外培养成骨细胞进行分析提供基础。成骨细胞是骨发生和骨形成的重要细胞,具有合成、分泌组成骨基质的胶原和糖蛋白的作用,并通过钙化基质形成骨组织。在体外培养系统中的成骨细胞表型发育与其体内发育分化有着较大的相似之处,通过酶消化法,成骨细胞在体外培养的情况下,重演了体内成骨细胞从细胞增殖、细胞外基质成熟到基质矿化的整个过程,因而可作为一个良好的研究成骨细胞表型发育的体外模型系统。
钛及钛合金因具有优良的生物相容性、机械性能、耐腐蚀性和较好的可加工性而成为目前临床上应用最广泛的骨内、牙植入材料。经过适当加工后的钛片与成骨细胞有很好的组织相容性,能使成骨细胞贴附于钛片表面,并在一定条件下影响成骨细胞的增殖和分化。以往对此的研究较少,所以复合钛片后观察对成骨细胞矿化相关蛋白表达的影响有非常大的临床意义。
TGF-β1对骨代谢的调节作用非常复杂,在不同条件下表现为促进或抑制细胞增殖的双重调节[4-6]。成骨细胞是骨组织中合成分泌TGF-β1的主要细胞,成骨细胞通过合成分泌TGF-β1,调节其自身增殖分化和代谢,从而调节骨代谢[7]。通过预实验,本实验室得到了可产生不同影响的TGF-β1的大致浓度。本次实验中所选0.5ng/ml TGF-β1可以增强细胞的增殖活性,增加几种矿化相关蛋白的表达,诱导成骨细胞分化,这符合细胞因子在低浓度下起刺激作用,而在高浓度下起抑制作用的普遍规律[8]。
骨钙素是反映成骨细胞分化成熟的指标,它能准确反映成骨细胞的成骨功能,本实验中选取TGF-βl为0.5ng/ml时,骨钙素分泌量增多,细胞生长旺盛,这提示,0.5ng/ml TGF-β能促进成骨细胞形成、活性增加。BSP是矿化组织特异性的,是矿化组织分化的晚期标志。参与细胞粘附、细胞转移和信号识别,作为骨细胞外基质参与骨代谢。在成骨过程中它的主要作用是作为羟基磷灰石形成的初始核心,启动矿化过程,在矿化开始后刺激羟基磷灰石晶体的生长。BSP的表达局限于矿化组织,是矿化组织特异性的。胶原蛋白是骨组织的主要成份,以I型胶原蛋白为主。定向分化的成骨细胞增殖分化过程中,首先表达I型胶原蛋白,I型胶原蛋白的合成在细胞增值期占主导地位,是成骨细胞分化扩增晚期、基质形成早期的产物,在骨形成与矿化过程中发挥重要作用[9],一般认为 I型胶原与早期成骨分化有关[10]。另外,I型胶原蛋白是成骨细胞分泌基质中主要的定型成分,是钙盐沉着和细胞附着的支架[11]。
目前虽然对TGF-β1调控成骨细胞的机制有了一定的研究,但是还应加强对TGF-β1作用成骨细胞的体内研究;同时,不仅要考虑TGF-β1自身对成骨细胞的影响,也应将TGF-β1与骨形成相关的其他细胞因子和生长因子的协同作用一并加以研究,在分子水平上探讨其作用机理,探讨生长因子之间的相互作用以及生物安全性等方面的问题。TGF-β1在口腔种植领域的应用日益增多,为骨种植中关于骨整合的治疗提供新的手段。
4.结论
经本实验结果对比得出:浓度为0.5ng/ml的外源性TGF-β1对钛片表面的成骨细胞成骨相关因子表达有一定的促进作用。
[1]巢永烈,梁 星.种植义齿学[M].北京医科大学出版社,1999:24:37
[2]张庆诗,刘洪臣.骨生长因子在种植修复中的应[J].中华老年口腔医学杂志,2003,1(2):103-105
[3]宁江海,刘洪臣,龙建银,等.拟TGF-β样多肽对于成骨细胞作用的研究[J].口腔颌面修复学杂志,2000,1(1):36-39
[4]Lind M,Deleuran B,Thestrup-Pedersen K,et al.Chemotaxis of human osteoblasts.Effects of osteotropic growth factors[J].APMIS,1995,103(2):140-146
[5]Strong DD,Wengedal JE, Beachler,et al.Transforming growth factor beta increases type I collagen message in cultured normal human bone cells[J].FASEB J,1998, (2):A842-844
[6]Cheifetz S,Li IW,McCulloch CA,et al.Influence of osteogenic protein-1(OP-I,BMP-7)and transforming growth factor-beta 1 on bone formation in vitro[J].Connect Tissue Res,1996,35(1-4):71-78
[7]卢卫忠,唐康来,杨 柳,等.TGF-β对成骨细胞的作用[J].第三军医大学学报,2000,22(1):99-102
[8]杨贵贞.免疫生物工程纲要与技术[M].长春:吉林科技出版社出版,1991:28-37
[9]Maureen PL,Janet LS,Gary SS,et al.The influence of type 1 collagen on the development and maintenance of the osteoblast phenotype in primary and passaged rat calvarial osteoblast:modification of expression of genes supporting cellgrowth,adhesion and extracellular matrix mine ralization[J].Experimental Cell Research, 1995, 216(1):35-45
[10]Balcerzak M,Hamade E, Zhang L,et al.The roles of annexinsand alkaline phosphatase in mineralization precess[J].Acta Biochim Pol,2003,50(4):1119-1130
[11]Bosshardt DD,Zalzal S,Mckee MD,et al.Develop mental appearance and distribution ofbone sialoprotein and osteopontin in human and rat cenentum[J].AnatRes,1998,250(1):13-33

