海参肠自溶水解物抗氧化活性的研究
郑 杰, 吴 海 涛, 朱 蓓 薇,, 董 秀 萍,
( 1.江苏大学 食品与生物工程学院, 江苏 镇江 212013;2.大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
抗氧化活性肽是具有抑制生物大分子过氧化或清除体内自由基功效的生物活性肽[1],是被广泛研究的一类活性肽,尤其是从水产动物中制备天然抗氧化肽替代化学合成抗氧化剂已经越来越引起人们的广泛关注。一般认为,肽的抗氧化作用与其氨基酸组成、氨基酸序列和空间构象有关[2]。目前,研究学者已经从鲢鱼[3]、金枪鱼[4]、海湾扇贝[5]和虾[6]等多种水产动物中制备得到抗氧化活性肽。海参因其蛋白质含量极高也成为抗氧化活性肽的良好来源。
水产品抗氧化活性肽的制备方法主要有蛋白酶水解法和微生物发酵法两种[7],也有研究人员通过自溶手段制备得到具有抗氧化活性的鱼肉蛋白水解物[8]。海参(Stichopusjaponicus)具有极强的自溶能力,在紫外线照射下可诱导自溶的快速发生[9]。本研究以海参加工过程中的废弃物——海参肠为原料,利用紫外线照射诱导其自溶,制备海参肠自溶水解物,并研究其分子质量分布、氨基酸组成和体外抗氧化作用,旨在为海参肠的开发利用提供理论依据,并进一步丰富海参自溶理论。
1 材料与方法
1.1 原料与试剂
原料:成年鲜活海参,购于大连市长兴水产品市场。海参在低温条件下运至实验室后,立即杀死,取肠清洗后于-20 ℃贮存备用。
试剂:1,1-二苯基-2-三硝基苯肼(DPPH ·,C18H12N5O6),N-Hippuryl-His-Leu(0.43 ku)和Vitamin B12(1.355 ku),Sigma公司;Cytochrome C(12.5 ku),Aprotinin(6.512 ku),上海生工生物工程技术服务有限公司;18肽(2.342 ku),西安联美生物科技有限公司;所用其他试剂均为分析纯。
1.2 主要仪器
LG-1.0型真空冷冻干燥机,沈阳新阳速冻设备制造有限公司;HH-6数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;UV2100型紫外可见分光光度计,上海尤尼柯仪器有限公司;BIO-RAD 680酶标仪,美国BIO-RAD公司;Z323K型冷冻离心机,HERMLE,GERMANY;JJ 200Y型精密电子天平,美国双杰兄弟集团有限公司。
1.3 试验方法
1.3.1 海参肠自溶水解物的制备
海参肠自溶水解物的制备建立在前期研究工作[10]的基础上。新鲜海参肠,打浆,紫外线(30 W,0.5 m)照射30 min后,加入3倍体积的McIIvaine’s缓冲溶液(0.2 mol/L,pH 4.4),于48 ℃自溶4 h,13 500 r/min离心10 min,取上清液,冷冻干燥后即为自溶水解物样品,于低温、干燥条件下贮存备用。经测定,自溶水解物中主要化学成分为蛋白质、糖和脂肪,分别占干物质(去除无机盐)的63.70 %、14.23 %和2.21%。
1.3.2 分子质量分布范围的测定
海参肠自溶水解物分子质量的分布范围采用依利特P230高效液相色谱(依利特,中国)匹配Superdex Peptide 10/300 GL(10 mm× 300 mm)凝胶过滤柱(通用电器医疗集团,美国)测定。进样量:50 μL;进样质量浓度:5 mg/mL;检测波长:220 nm;流动相:0.05 mol/L磷酸盐缓冲液(含0.15 mol/L NaCl,pH 7.0);洗脱流量:0.5 mL/min。分子质量标准品分别选用Cytochrome C(12.5 ku),Aprotinin(6.512 ku),18肽(2.342 ku),Vitamin B12(1.355 ku)和N-Hippuryl-His-Leu(0.43 ku)。对凝胶过滤色谱而言,分子质量的对数(y)与保留时间(x)呈线性关系,经过计算所得分子质量标准曲线为y=-0.083 4x+5.755 4(R2=0.994 4)。
1.3.3 氨基酸组成分析
样品由国家生物医学分析中心采用HPLC法进行氨基酸组成分析。
1.3.4 DPPH ·清除能力的测定
按照文献[11]所述方法,1 mL不同浓度样品溶液与2 mL磷酸盐缓冲液(0.1 mol/L,pH 6.0)以及2 mL DPPH溶液(200 μmol/L,溶于95%乙醇)混合,漩涡振荡后,室温避光保存30 min。在2 000g离心10 min后,取上清液在517 nm下测其吸光值。DPPH ·清除率计算如下:
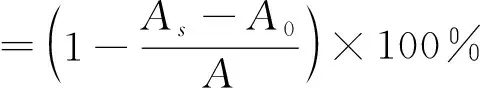
(1)
式(1)中,As为样品吸光值测定值;A0为以95%乙醇代替DPPH溶液时测定的吸光值;A为以去离子水代替样品时的空白测定值。以VC作为阳性对照。
1.3.5 Fe2+螯合能力的测定
按照文献[12]所述方法,1 mL不同浓度样品溶液,与50 μL氯化亚铁溶液(2 mmol/L)和1 mL去离子水混合均匀后室温静置5 min,再加入100 μL菲咯嗪溶液(5 mmol/L),混匀后室温静置5 min,反应结束后,在2 000g条件下离心10 min,取上清液测其在562 nm下吸光值。Fe2+螯合率计算如下:
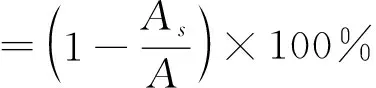
(2)
式(2)中,As为样品测定值;A为用等体积去离子水代替样品后的测定值。以EDTA-2Na作为阳性对照。
1.3.6 还原能力的测定
按照文献[13]所述方法,1 mL不同浓度样品溶液与1 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6)以及2 mL铁氰化钾溶液(质量浓度为10 mg/mL)混合,漩涡振荡,50 ℃水浴加热20 min后加入1 mL三氯乙酸溶液(质量浓度为100 mg/mL)终止反应。混匀后,2 000g离心10 min,取2 mL上清液,并加入2.5 mL去离子水和0.3 mL三氯化铁溶液(质量浓度为1 mg/mL),室温静置10 min后,在700 nm下测定吸光值,吸光值越高则表示还原能力越强,以VC作为阳性对照。
2 结果与分析
2.1 海参肠自溶水解物分子质量分布
海参肠自溶后,蛋白质发生显著降解。采用Superdex Peptide 10/300 GL凝胶过滤色谱柱对海参肠自溶水解物的分子质量分布进行分析,结果见图1。海参肠自溶水解物主要由分子质量在3 ku以下的组分组成(质量分数达到87.7%),而其中又以分子质量在1 ku以下的组分为主体。
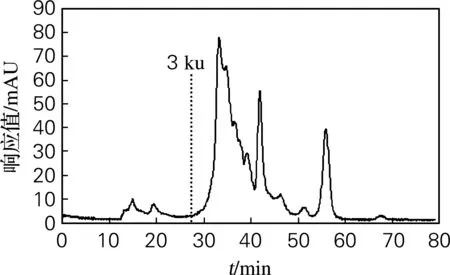
图1 海参肠自溶水解物的HPLC谱图
2.2 海参肠自溶水解物的氨基酸组成
分析海参肠自溶水解物的氨基酸组成,结果见表1。由表1可知,海参肠自溶水解物含有17种氨基酸,包括除色氨酸之外的所有种类的必需氨基酸。此外,还含有较多与抗氧化活性密切相关的氨基酸,如Ala、Val和Leu等。海参肠自溶水解物中必需氨基酸占总氨基酸的27.2%。Glu和Gly的含量相对较高。
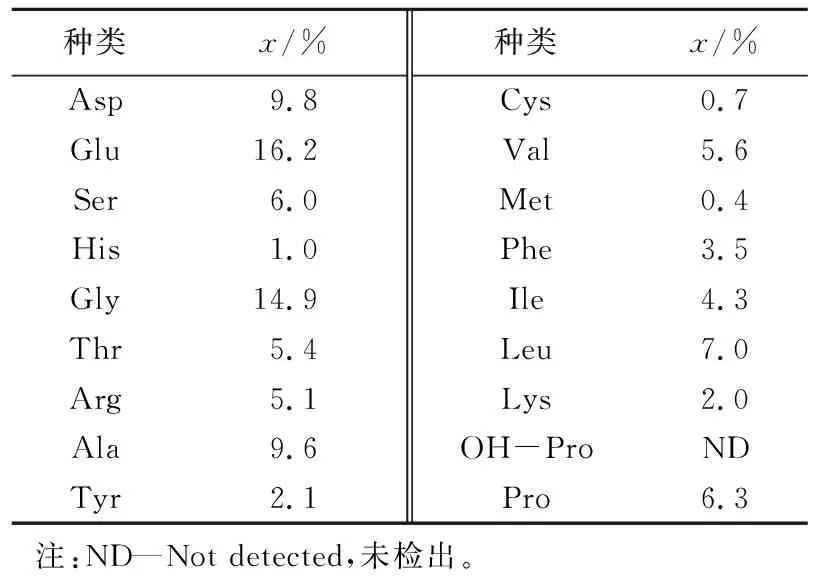
表1 海参肠自溶水解物的氨基酸组成
2.3 海参肠自溶水解物的抗氧化活性
目前报道的水产品抗氧化肽中,分子质量多低于3 ku,主要集中在1 ku左右,其氨基酸残基的数目一般在20个以内[7]。氨基酸组成与肽的抗氧化性密切相关[14],如富含His、Ala、Val、Met和Leu的肽普遍具有较高的抗氧化活性[15]。从分子质量分布范围和氨基酸组成两方面来看,海参肠自溶水解物具有潜在的抗氧化活性,因此进一步对其抗氧化活性进行研究,包括对DPPH ·的清除能力、金属离子螯合能力以及还原能力。
2.3.1 海参肠自溶水解物对DPPH ·的清除能力
DPPH ·是一种脂溶性的自由基,从抗氧化剂中获得一个电子后可形成一个稳定的分子[16-17]。与大多数自由基不同的是,它能在室温条件下保持稳定[18]。用分光光度法进行定量分析即可评价样品的抗氧化能力。由图2可知,海参肠自溶水解物具有一定的DPPH ·清除能力,且清除能力与样品浓度之间存在明显的量效关系,其SC50(DPPH ·清除率达到50%时的样品质量浓度,S-Scavenging)为4.04 mg/mL,明显弱于对照VC。海参肠自溶水解物对DPPH ·的清除能力弱于刘程惠等[19]通过胰蛋白酶酶解所制得的1~3 ku的海参肽[IC50为(1.27±0.09)mg/mL],接近于大马哈鱼鱼精蛋白水解物[20],明显强于军曹鱼鱼皮明胶水解物[21]。
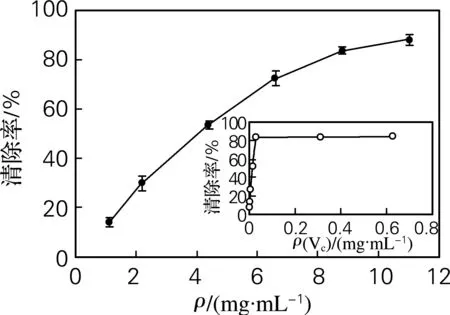
图2 海参肠自溶水解物对DPPH ·的清除能力
2.3.2 海参肠自溶水解物的Fe2+螯合能力
有机体内的许多氧化反应都与金属离子的转变有关,金属离子螯合能力是评价样品对自由基清除能力的一个重要指标。海参肠自溶水解物的Fe2+螯合能力采用菲咯嗪法进行测定。菲咯嗪可与Fe2+结合形成红色络合物,当反应体系中有金属离子螯合剂存在时,此络合物便会分解,红色消失。因此,根据体系颜色的变化即可测定样品的螯合能力[22]。由图3可知,海参肠自溶水解物对Fe2+有一定的螯合能力,且其螯合能力的强弱与样品浓度呈正相关,其CC50(螯合率达到50%时的样品质量浓度,C-Chelating)为5.91 mg/mL。海参肠自溶水解物的螯合能力虽然远远弱于阳性对照EDTA-2Na,但却接近或强于太平洋鳕鱼肉水解物[8]、鲢鱼风味蛋白酶酶解物[23]及鱿鱼明胶[24]。
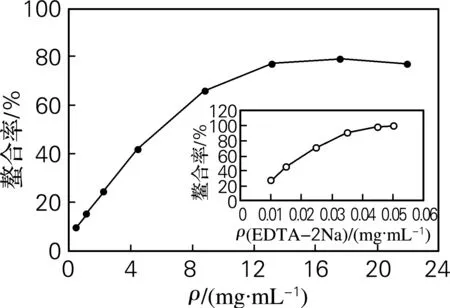
图3 海参肠自溶水解物的Fe2+螯合能力
2.3.3 海参肠自溶水解物的还原能力
在还原能力测定中,反应物在700 nm处的吸光值越大表示还原能力越强。一般情况下,生物活性化合物的还原能力与其抗氧化能力呈正相关[25-26],还原能力越强,表明抗氧化能力越强。图4显示,海参肠自溶水解物的还原能力均与其浓度呈正相关,即随着样品质量浓度的增加,还原能力逐渐增强。当样品质量浓度为13.20 mg/mL时,反应物在700 nm处的吸光值可达到0.72。将A700为0.5时的样品浓度定义为AC0.5,结果显示,海参肠自溶水解物的AC0.5为8.06 mg/mL,这说明海参肠自溶水解物具有一定的还原能力,远强于海蜇蛋白[27],但明显弱于对照VC。

3 结 论
海参肠自溶水解物主要由分子质量小于3 ku的组分组成,含有17种氨基酸。海参肠自溶水解物具有一定的DPPH ·清除能力、Fe2+螯合能力和还原能力,其SC50、CC50和AC0.5分别为4.04、5.91和8.06 mg/mL。
[1] 张君慧,张晖,王兴国,等. 抗氧化活性肽的研究进展[J]. 中国粮油学报, 2008, 23(6):227-233.
[2] KONG Xiangzhen, ZHOU Huiming, HUA Yufei. Preparation and antioxidant activity of wheat gluten hydrolysates (WGHs) using ultrafiltration membranes[J]. Journal of the Science of Food and Agriculture, 2008, 88(5):920-926.
[3] 尤娟,罗永康,沈彗星. 酶法制备鲢鱼蛋白抗氧化肽研究[J]. 渔业现代化, 2010, 37(3):42-47.
[4] JE J Y, QIAN Z J, BYUN H G, et al. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry, 2007, 42(5):840-846.
[5] 张一江,曹文红,毕春波. 海湾扇贝酶解产物清除自由基活性的研究[J]. 食品与发酵工业, 2008, 34(4):60-63.
[6] BINSAN W, BENJAKUL S, VISESSANGUAN W, et al. Antioxidative activity of Mungoong, an extract paste, from the cephalothorax of white shrimp (Litopenaeusvannamei)[J]. Food Chemistry, 2008, 106(1):185-193.
[7] 谢宁宁,陈小娥,方旭波,等. 水产抗氧化肽研究进展[J]. 浙江海洋学院学报:自然科学版, 2010, 29(1):74-80.
[8] SAMARANAYAKA A G P, LI-CHAN E C Y. Autolysis-assisted production of fish protein hydrolysates with antioxidant properties from Pacific hake (Merlucciusproductus)[J]. Food Chemistry, 2008, 107(2):768-776.
[9] ZHU Beiwei, ZHENG Jie, ZHANG Zongshen, et al. Autophagy plays a potential role in the process of sea cucumber body wall “melting” induced by UV irradiation[J]. Wuhan University Journal of Natural Sciences, 2008, 13(2):232-238.
[10] 郑杰,吴海涛,董秀萍,等. 基于主要化学成分变化建立的海参自溶评价指标[J]. 大连工业大学学报, 2010, 29(6):391-395.
(ZHENG Jie, WU Hai-tao, DONG Xiu-ping, et al. Establishment of evaluation indicators for autolysis of sea cucumber based on alteration in main chemical compositions[J]. Journal of Dalian Polytechnic University, 2010, 29(6):391-395.)
[11] CHEN Y, WANG M F, ROSEN R T, et al. 2, 2-diphenyl-1-picrylhydrazyl radical-scavenging active components fromPolygonummultiflorumThunb[J]. Journal of Agricultural and Food Chemistry, 1999, 47(6):2226-2228.
[12] HSU B, COUPAR I M, NG K. Antioxidant activity of hot water extract from the fruit of the Doum palm,Hyphaenethebaica[J]. Food Chemistry, 2006, 98(2):317-328.
[13] ZHU Lijuan, CHEN Jie, TANG Xueyan, et al. Reducing, radical scavenging, and chelation properties ofinvitrodigests of alcalase-treated zein hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2008, 56(8):2714-2721.
[14] SAIGA A, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment[J]. Journal of Agricultural and Food Chemistry, 2003, 51(12):3661-3667.
[15] GUO H, KOUZUMA Y, YONEKURA M. Structures and properties of antioxidative peptides derived from royal jelly protein[J]. Food Chemistry, 2009, 113(1):238-245.
[16] SANCHEZ-MORENO C. Methods used to evaluate the free radical scavenging activity in foods and biological systems[J]. Food Science and Technology International, 2002, 8(3):121-137.
[17] SOARES J R, DINIS T C P, CUNHA A P, et al. Antioxidant activities of some extracts ofThymuszygis[J]. Free Radical Research, 1997, 26(5):469-478.
[18] XIE Zhengjun, HUANG Junrong, XU Xueming, et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry, 2008, 111(2):370-376.
[19] 刘程惠,朱蓓薇,董秀萍,等. 海参酶解产物的分离及其体外抗氧化作用的研究[J]. 食品与发酵工业, 2007, 33(9):50-53.
[20] WANG Yonggang, ZHU Fengrong, HAN Fusen, et al. Purification and characterization of antioxidative peptides from salmon protamine hydrolysate[J]. Journal of Food Biochemistry, 2008, 32(5):654-671.
[21] YANG J I, HO H Y, CHU Y J, et al. Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia (Rachycentroncanadum) skin[J]. Food Chemistry, 2008, 110(1):128-136.
[22] YAMAGUCHI F, SAITO M, ARIGA T, et al. Free radical scavenging activity and antiulcer activity of garcinol fromGarciniaindicafruit rind[J]. Journal of Agricultural and Food Chemistry, 2000, 48(6):2320-2325.
[23] DONG Shiyuan, ZENG Mingyong, WANG Dongfeng, et al. Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp (Hypophthalmichthysmolitrix)[J]. Food Chemistry, 2008, 107(4):1485-1493.
[24] GIMENEZ B, ALEMAN A, MONTERO P, et al. Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J]. Food Chemistry, 2009, 114(3):976-983.
[25] CHEN H M, KOJI M, FUMIO Y. Antioxidative properties of histidin-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1998, 46(1):49-53.
[26] 吴海涛,缪琪,朱蓓薇. 牡蛎水提液的抗氧化特性[J]. 食品与发酵工业, 2005, 31(4):42-45.
[27] YU Huahua, LIU Xiguang, XING Ronge, et al. In vitro determination of antioxidant activity of proteins from jellyfishRhopilemaesculentum[J]. Food Chemistry, 2006, 95(1):123-130.

