趋化因子CXCL10在心肌细胞及巨噬细胞中的表达机制
李子南,翟 原,卢 静,王 钜
(1.首都医科大学实验动物科学部,北京 100069;2.加州大学洛杉矶分校医学院外科学系器官移植中心,洛杉矶 CA91320)
趋化因子CXCL10在心肌细胞及巨噬细胞中的表达机制
李子南1,翟 原2,卢 静1,王 钜1
(1.首都医科大学实验动物科学部,北京 100069;2.加州大学洛杉矶分校医学院外科学系器官移植中心,洛杉矶 CA91320)
目的 探讨心肌缺血-再灌注损伤中趋化因子CXCL10的产生机制。方法 分别用LPS、H2O2、Ca2+载体A23187刺激原代培养的心肌细胞、骨髓来源的巨噬细胞或二者混合培养的共培养系统后,ELISA检测培养基上清中的趋化因子 CXCL10和促炎性细胞因子 IL-1β、IL-6、TNF-α的含量,观察其表达动力学。结果 ①大剂量(10 μg/mL)的LPS刺激心肌细胞主要产生趋化因子CXCL10;刺激骨髓来源巨噬细胞主要产生促炎性细胞因子IL-1β、IL-6、TNF-α。②H2O2、Ca2+通道激活剂并不能使产生趋化因子 CXCL10 或 IL-1β、IL-6、TNF-α 这些促炎性细胞因子。③骨髓来源的巨噬细胞促进心肌细胞表达趋化因子CXCL10;心肌细胞促进骨髓来源的巨噬细胞表达IL-6、TNF-α,但抑制IL-1β的表达。结论 心肌细胞是心肌缺血-再灌注损伤中CXCL10潜在的细胞来源;CXCL10的表达,主要依赖于TLR4的激活。
CXCL10;TLR4;心肌细胞;T细胞;缺血-再灌注损伤
1 材料和方法
1.1 材料
1.1.1 实验动物:心肌细胞原代培养采用Wistar大鼠,8周龄,雄性;骨髓来源巨噬细胞(bone marrowderived macrophages,BMMs)原代培养采用 Wistar大鼠,1日龄,雌雄不限。所有实验动物均来源于首都医科大学实验动物科学部[SCXK(京)2005-0006]。
1.1.2 仪器:CO2培养箱(美国 MMM公司),荧光倒置显微镜(重庆 COIC公司),离心机(美国 Sigma公司)。
1.1.3 主要试剂:DMEM高糖培养基、双抗、L-谷氨酰胺均为美国HyClone公司产品,特级胎牛血清为德国 Biochrom AG公司产品,BrdU、多粘菌素 B、HEPES为德国 Merck公司产品,胶原酶Ⅱ为美国Worthington公司产品,胰蛋白酶为美国 Amresco公司产品,脂多糖(lipopolysaccharide,LPS)、钙离子载体(calcium ionophore)A23187为美国Sigma公司产品,H2O2为北京现代东方精细化学品有限公司产品,Rat CXCL10检测试剂盒为武汉优尔生科技股份有限公司产品,Rat IL-1β、IL-6、TNF-α 检测试剂盒为北京四正柏生物科技有限公司产品。
1.2 方法
1.2.1 细胞培养:①心肌细胞原代培养:75%乙醇消毒新生大鼠体表,开胸取出心脏,在无菌PBS中洗去血液,并剪成1 mm3的小块,随后将这些组织块移入50 mL离心管中,加入8 mL心肌组织消化液(0.05% 胰酶,0.05% 胶原酶 II,0.5%BSA),放在恒温摇床上37℃摇5min消化组织。将离心管取下后自然沉淀后吸取上清,沉淀的组织块中继续加入新鲜的组织消化液。重复上述消化步骤数次直至大部分组织块被消化完。除第一次外,其余次消化得到的上清立即加入等体积的心肌细胞培养基(含10%血清、1%双抗、2 mol/L L-谷氨酰胺、0.01 mol/L BrdU、50 mg/L多粘菌素 B的 DMEM)中和消化,并1000 r/min离心6 min,获得的沉淀大部分为心肌细胞。用培养基重悬细胞,过200目细胞筛,并接种在培养皿中培养90 min使非心肌细胞贴壁,而后收集上清中未贴壁的心肌细胞,以2×106个/皿的密度接种于6孔细胞培养板中,5%CO2、37℃培养48h,换液,进行下步实验。LPS组的培养基中不加入多粘菌素B。②L929条件培养基的制备:以5×105个/瓶的密度将L929系细胞接种于75cm2细胞培养瓶中,并补充 L929培养基(含10%特级胎牛血清、1% 双抗、10 mmol/L HEPES、2 mmol/L L-谷氨酰胺的 DMEM)至50 mL。5%CO2、37℃培养7d后收集培养基上清,过0.45 μm滤器,滤液便为 L929条件培养基(L929-conditioned medium)。③骨髓来源巨噬细胞原代培养:脱颈处死动物,75%消毒体表,取出两侧完整股骨,放入盛有酒精的无菌培养皿中浸泡。之后剪断股骨,暴露骨髓腔,用5mL注射器吸取BMM培养基(含20%L929条件培养基、10%血清、1%双抗、1%多粘菌素 B的 DMEM),将骨髓腔中的骨髓冲出,获得其中的造血干细胞。收集洗液,充分吹打后以5×106个/皿的密度接种于100 mm培养皿中,在5%CO2、37℃下培养7 d,并每3 d更换一次培养基。第8天时将分化成熟的BMM消化下来,以5×105个/孔的密度接种于6孔细胞培养板中。24h后换液,进行下步实验。LPS组的培养基中不加入多粘菌素B。④共培养系统建立:两种细胞原代培养方法同上。获得成熟的 BMM后,将其消化下来,与新制备的心肌细胞悬液混合,最终以1×106心肌细胞混合5×105BMM/孔的密度,接种于6孔细胞培养板中。培养基使用心肌细胞培养基,LPS组的培养基中不加入多粘菌素B。
1.2.2 实验分组:按不同药品(PBS、低剂量LPS、高剂量 LPS、H2O2、钙离子载体 A23187)刺激三种细胞(心肌细胞、BMMs、共培养系统)后三个时间点(6 h、12 h、24 h),分为 39 组(BMM、共培养系统均不做1 μg/mL LPS 组),每组 3 皿细胞。
1.2.3 药品剂量:H2O2是一种典型的氧自由基,常用于模拟由各种自由基造成的应激状态或损伤;而钙离子载体A23187是一种常用的钙离子通道激活剂,可使培养基中包含 Ca2+通过钙通道进入细胞内,造成细胞内钙超载。为了模拟再灌注损伤过程中的氧化应激以及钙超载,H2O2和离子载体A23187的应用浓度应使细胞处于一种应激状态,而不应该引起明显的细胞死亡。通过查阅文献以及预实验结果,二者浓度均选取为 0.02 μmol/L[4,10]。低剂量 LPS组采用 1 μg/mL,高剂量 LPS组采用10 μg/mL。上述浓度均为在培养基中的终浓度。
1.2.4 ELISA:①分别设标准孔、待测样品孔、空白孔。设标准孔7孔,依次加入100 L不同浓度的标准品。空白孔加100 μL标准品/样品稀释液,其余孔加细胞培养上清100 mL,酶标板加上覆膜,37℃温育2。②弃去液体,甩干,不用洗涤。每孔加生物素化二抗(临用前配制)100 mL,酶标板加上覆膜,37℃温育1 h。③弃去孔内液体,每孔用400 μL的洗涤液洗涤,浸泡1~2 min,甩干(也可轻拍将孔内液体拍干),重复洗板3次。最后一次洗涤后,要把孔内的洗涤液完全甩干。④每孔加酶结合物(临用前配制)100 μL,加上覆膜,37℃ 温育 30 min。⑤弃去孔内液体,甩干,洗板5次。⑥每孔加底物溶液90 μL,酶标板加上覆膜,37℃避光显色(反应时间控制在15~25 min,不要超过30 min。当标准孔的前3~4孔有明显的梯度蓝色,后3~4孔梯度不明显时,即可终止)。⑦每孔加终止溶液50 μL,终止反应,此时蓝色立转黄色。终止液的加入顺序应尽量与底物溶液的加入顺序相同。如出现颜色不匀一,请轻轻晃动酶标板以使溶液混合均匀。在确保酶标板底无水滴及孔内无气泡后,立即用酶标仪在450 nm波长测量各孔的吸光度(A值)。⑧各标准品及样本值扣除空白孔值后作图(七点图)。以标准品的浓度为纵坐标,A值为横坐标,绘出标准曲线,计算出回归方程。将样品的 A值代入方程式,计算出样品浓度。
2 结果
2.1 TLR4通路介导趋化因子CXCL10的表达
用不同剂量 LPS刺激心肌细胞,并对CXCL10的表达进行动力学监测。如图1所示,随着刺激时间的增加,心肌细胞CXCL10的表达量不断增加,在10 μg/mL LPS组中,CXCL10的表达量从 6 h的216 pg/mL,上升到 24h的 828 pg/mL(P<0.01)。此外,心肌细胞CXCL10的表达呈现出明显的剂量反应,在24h时,低剂量组(1 μg/mL)CXCL10表达量为213 pg/mL,高剂量组(10 μg/mL)的表达量为828 pg/mL,是低剂量组的4倍(P<0.01)。
用10 μg/mL的LPS(此剂量可明显的使心肌表达CXCL10)刺激BMM,并检测其CXCL10的表达从6h到24h一直保持在低水平(150 pg/mL到200 pg/mL之间)。
用10 μg/mL LPS刺激共培养系统,检测在6、12、24 h时趋化因子CXCL10的表达量,均比心肌细胞高。虽然这种差异没有统计学意义,但是值得注意的是,在共培养系统中,心肌细胞的数量只是单纯培养心肌细胞的一半(106个/孔),但却产生相同甚至更多的CXCL10。
2.2 氧化应激、钙离子超载对CXCL10表达的影响
用H2O2刺激细胞模拟氧化应激,或用钙离子载体A23187刺激细胞模拟钙离子超载,对于心肌细胞不能刺激其产生CXCL10(所有时间组表达量均未超过50 pg/mL)。但是二者可以刺激巨噬细胞产生CXCL10,在12 h组最为明显,其表达量分别是对照组(PBS组)的4倍(P<0.05)和6倍(P<0.05)。

图1 用LPS刺激细胞后,培养上清中CXCL10含量(s,pg/mL)Fig.1 CXCL10 concentrations in the medium at 6 h,12 h and 24 h after LPS stimulation(s,pg/mL)

图2 用H2O2或钙离子载体A23187刺激细胞后,不同时间培养上清中CXCL10含量(s,pg/mL)Fig.2 CXCL10 concentration in the medium at 6 h,12 h and 24 h after H2O2or calcium ionophore A23187 stimulation(s,pg/mL)
2.3 TLR4 通路介导 IL-1β、IL-6、TNF-α等促炎性细胞因子的表达
与CXCL10相比,LPS并不能明显的刺激心肌使其产生 IL-1β、IL-6、TNF-α等促炎性细胞因子,只有在24 h组中IL-6这个指标与对照组(PBS组)有统计学差异。
对于BMM,虽然大剂量的LPS不能刺激其产生趋化因子CXCL10,但是却可以产生其他促炎性的细胞因子,IL-1β(12 h组和 24 h组)、IL-6(6 h组)、TNF-α(12 h组)均与其对照组(PBS组)有统计学差异。

图3 用LPS刺激细胞后,不同时间培养上清中IL-1β、IL-6、TNF-α的含量(s,pg/mL)Fig.3Concentrations of IL-1β,IL-6 and TNF-α in the medium at 6 h,12 h and 24 h after LPS stimulation(s,pg/mL)
从共培养系统组可以看出,对于LPS诱导的IL-6、TNF-α表达,心肌细胞与 BMM表现出协同作用。对于 IL-6 和 TNF-α,在 6、12、24 h 时共培养系统的表达量均高于心肌细胞和巨噬细胞单独培养(P<0.05)。而对于IL-1β这个指标来说,共培养系统组却要低于单独培养的BMMs组(P<0.05)。
2.4 氧化应激、钙离子超载对促炎性细胞因子表达的影响
图 4 显示,对于 IL-1β、IL-6、TNF-α 这三个指标,心肌细胞、巨噬细胞或共培养系统的H2O2组及钙离子载体 A23187组均与对照组(PBS组)无统计学差异。
3 讨论
课题组前研究已证实,在发生缺血-再灌注损伤的心肌组织中有趋化因子 CXCL10 的表达[7,8];但是,心肌组织是由心肌细胞(实质细胞)、固有的巨噬细胞(间质细胞)等多种细胞成分组成,所以CXCL10的细胞学来源并不确定。本次实验利用细胞培养的方法发现,与肝脏不同[13],心肌细胞作为心肌组织中的实质细胞可以表达趋化因子 CXCL10,但这种表达需要大剂量的LPS刺激才可以产生。
在细胞实验中,LPS可以特异性的激活 TLR4通路;而在动物实验中,当再灌注发生时,受损的组织所释放内源性配体(如热休克蛋白、高迁移率族蛋白1等)可激活TLR4[11],介导多种促炎性的细胞因子、趋化因子的表达。除TLR4被激活外,再灌时恢复氧气供给的心肌组织中会有大量的氧自由基产生,造成细胞的氧化应激甚至损伤,引起心肌细胞一系列基因表达的改变[9];并且,缺氧造成的能量代谢障碍也会引起细胞内外离子交换紊乱,Ca2+在细胞内聚集,即“钙超载”(Ca2+overload),Ca2+作为一种重要的第二信使,其在细胞内的累积势必影响相关信号通路下游的基因表达改变。
综上所述,除 TLR4通路外,氧化应激、钙离子超载也可能引起趋化因子CXCL10的表达,故在本次实验中设置了H2O2组以及钙离子载体 A23187组。本次实验结果显示,H2O2诱导的氧化应激、钙离子载体A23187诱导的钙离子超载,二者均不能刺激心肌表达任何的趋化因子或细胞因子。这说明,当心肌发生再灌注损伤时,CXCL10以及其他促炎性因子的产生主要是由TLR4通路介导的。
TLR4主要在单核/巨噬细胞的细胞膜上表达,有报道称在心肌细胞上同样有 TLR4的表达[15]。本次研究发现,大剂量(10 μg/mL)的LPS可以激活心肌细胞上的TLR4,而且主要引起CXC10的表达,而不是表达IL-1β、IL-6、TNF-α等促炎性细胞因子,提示在大剂量LPS诱导心肌细胞TLR4激活后,选择性激活其下游的MyD88非依赖性通路产生CXCL10。相反,10 μg/mL LPS不能使 BMM 产生 CXCL10,但是却能使其表达 IL-1β、IL-6、TNF-α 等促炎性细胞因子,提示BMM上的TLR4被大剂量LPS激活后,主要通过 MyD88依赖性通路表达 IL-1β、IL-6、TNF-α等促炎性细胞因子。
近期,已有国外研究小组报道,微量(10 ng/mL)的LPS就可以刺激BMM产生CXCL10以及IL-6、TNF-α[13];但本研究小组研究发现,大剂量 (10 μg/mL)的 LPS刺激 BMM后,却未观察到明显的CXCL10表达的上调,提示 BMM,LPS诱导的 TLR4下游通路的选择与剂量有关,即微量 LPS刺激时MyD88依赖性及非依赖性通路都被激活,而高剂量LPS抑制MyD88非依赖性通路,而不影响MyD88依赖性通路。
共培养系统对大剂量LPS的反应性结果表明,心肌细胞、巨噬细胞在对趋化因子CXCL10以及促炎性细胞因子 IL-6、TNF-α的表达中表现出协同作用;在IL-1β的表达中表现出拮抗作用。二者之间的这种协同或抑制作用可能是由别的分子(如IFN-β)或通路(如JAK-STAT通路)介导,其机制还需要进一步研究证明。
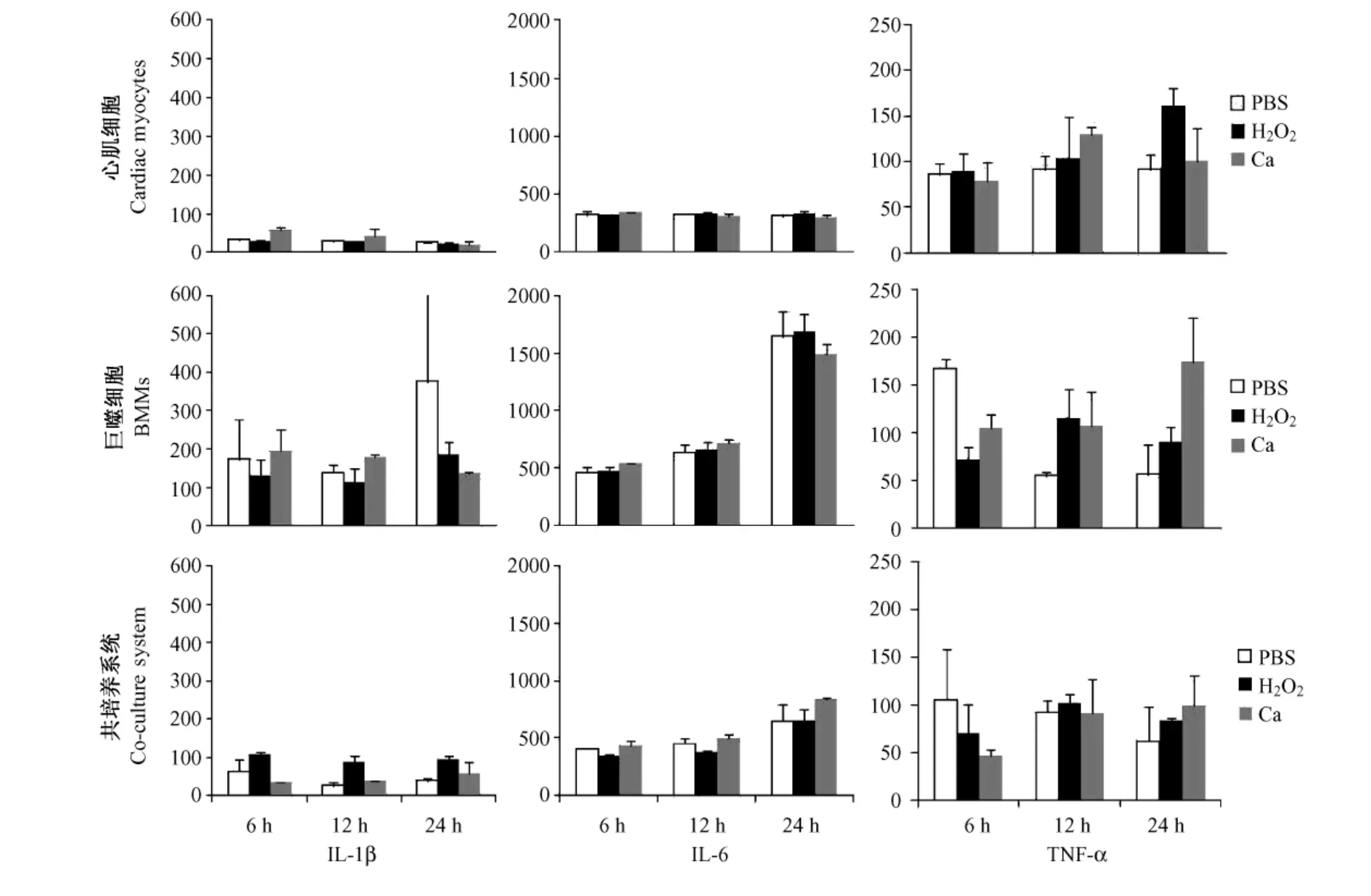
图4 用H2O2或钙离子载体A23187刺激细胞后,不同时间培养上清中IL-1β、IL-6、TNF-α含量(s,pg/mL)Fig.4 Concentration of IL-1β,IL-6 and TNF-α in the medium at 6 h,12 h,24 h after H2O2or calcium ionophore A23187 stimulation(,pg/mL)
[1] Taub DD,Lloyd AR,Conlon K,et al.Recombinant human interferon-inducible protein 10 is a chemoattractant for human monocytes and T lymphocytes and promotes T cell adhesion to endothelial cells[J].Exp Med,1993,177(6):1809-1814.
[2 ] Sallusto F,Lenig D,Mackay CR,et al.Flexible programs of chemokine receptor expression on human polarized T helper 1 and 2 lymphocytes[J].Exp Med,1998,187:875-883.
[3] Raffaella B,Giancarlo B,Paola PB,et al.Differential expression of chemokine receptors and chemotactic responsiveness of type 1 T helper cells(Th1s)and Th2s[J].Exp Med,1998,187:129-134.
[4 ] Peterséna A,Castilhoa RF,Hansson O,et al.Oxidative stress,mitochondrial permeability transition and activation of caspases in calcium ionophore A23187-induced death of cultured striatal neurons[J].Brain Res,2000,857(12):20-29.
[5 ] Yang Z,Day YJ,Toufektsian MC,et al.Myocardial infarct-sparing effect of adenosine A2A receptor activation is due to its action on CD4+T lymphocytes[J].Circulation,2006,114:2056-2064.
[6 ] Oyama J,Blais CJ,Liu X,et al.Reduced myocardial ischemiareperfusion injury in Toll-like receptor 4-deficient mice[J].Circulation,2004,109:784-789.
[7] 吴琼,翟原,焦守恕,等.CD4+T细胞在大鼠心肌缺血再灌注损伤中的作用[J].中国实验动物学报,2009,17(1):65-70.
[8] 吴琼,翟原,焦守恕,等.大鼠心肌缺血再灌注损伤中诱导CD4+T细胞募集的趋化因子的表达[J].中国比较医学杂志,2009,19(4):38-41.
[9 ] Kemp TJ,Causton HC,Clerk A.Changes in gene expression induced by H2O2in cardiac myocytes[J].Biochem Biophys Res Commun,2003,307(2):416-421.
[10] Przygodzki T,SokalA,Bryszewska M. Calcium ionophore A23187 action on cardiac myocytes is accompanied by enhanced production of reactive oxygen species[J].Biochim Biophys Acta,2005,1740(3):481-488.
[11] Zhai Y,Shen XD,O'Connell R,et al.Cutting edge:TLR4 activation mediates liver ischemia-reperfusion inflammatory response via IFN regulatory factor 3-depedndent MyD88-independent pathway[J].J Immunol,2004,173:7115-7119.
[12] Zhai Y,Shen XD,Hancock WW,et al.CXCR3+CD4+T cells mediate innate immune function in the pathophysiology of liver ischemia/reperfusion injury[J].J Immunol,2006,176:6313-6322.
[13] Zhai Y,Qiao B,Gao F,et al.Type I,but not Type Ⅱ,interferon is critical in liver injury induced after ischemia and reperfusion[J].Hepatology,2008,47:199-206.
[14] Zhai Y,Shen XD,Gao F,et al.CXCL10 regulate liver innate immune response against ischemia and reperfusion injury[J].Hepatology,2008,47:207-214.
[15] Frantz S,Kobzik L,Kim YD,et al.Toll4(TLR4)expression in cardiac myocytes in normal and failing myocardium[J].J Clin Invest,1999,104(3):271-280.
Mechanism of CXCL10 expression in cardiac myocytes and bone marrow-derived macrophages
LI Zi-nan1,ZHAI Yuan2,LU Jing1,WANG Ju1
(1.Department of Laboratory Animal Sciences,Capital Medical University,Beijing 100069,China;2.Dumont-UCLA Transplantation Center,Department of Surgery,UCLA School of Medicine,Los Angeles,CA 91320,USA)
Objective To investigate the mechanism of CXCL10 expression during myocardial ischemia-reperfusion injury.Methods To stimulate cardiac myocytes,bone marrow-derived macrophages(BMMs)and co-culture system with LPS,H2O2or calcium ionophore A23187 respectively,and then test the CXCL10,IL-1β,IL-6,TNF-α levels in the supernant of medium by ELISA.Results ①High dose(10 μg/mL)LPS could induce cardiac myocytes to express CXCL10 as well as BMMs to produce IL-1β,IL-6,TNF-α. ②H2O2,calcium ionophore A23187 failed to induce CXCL10 expression or IL-1β,IL-6,TNF-α expression,either on cardiac myocytes or on BMMs. ③BMMs promote CXCL10 induction of cardiac myocytes,while cardiac myocytes promote IL-6 and TNF-α induction of BMMs.Oppositely,the IL-1β induction of BMMs was inhibited by cardiac myocytes in this research.Conclusion Cardiac myocytes could be the potential cellular resource during myocardial ischemia-reperfusion injury.It is mainly the activation of TLR4 that cause CXCL10 expression.
Ischemia-reperfusion injury;Cardiac myocyte;TLR4;T cell;CXCL10
CXCL10;TLR4
A
1005-4847(2011)01-0059-06
10.3969/j.issn.1005-4847.2011.01.014
CXCL10属于趋化因子中CXC亚家族,可趋化多种炎性细胞,包括T淋巴细胞、单核细胞和自然杀伤(NK)细胞等进入炎症部位,从而介导Th1型炎症反应性疾病[1-3]。在本课题组之前的研究中已证明,发生再灌注损伤的心肌组织中有CD4+T细胞的浸润,这种浸润伴随着T细胞特异性的趋化因子CXCL10 表 达 上 调[7,8]。本 次 研 究 主 要 探 讨:①TLR4通路是否参与了CXCL10的表达?②CXCL10产生的细胞学机制。
李子南(1985-),男,硕士研究生。研究方向:再灌注损伤的免疫损伤机制。
王钜,教授。E-mail:wangju@ccmu.edu.cn
2010-11-08

