瑶山甜茶可溶性糖的测定
邹青松,陈 山,王 晓,陈 玮,李素霞,韦艳君
(广西大学糖业工程技术研究中心,广西南宁530004)
瑶山甜茶可溶性糖的测定
邹青松,陈 山*,王 晓,陈 玮,李素霞,韦艳君
(广西大学糖业工程技术研究中心,广西南宁530004)
为探明瑶山甜茶中可溶性糖的含量和种类,采用蒽酮—硫酸比色法测定其可溶性总糖含量,运用高效凝胶过滤色谱法(HPGFC)测定多糖分子量分布范围,并利用高效液相色谱—蒸发光散射检测器(HPLC-ELSD)法在两种流动相体系中测定和分析其低分子寡糖和单糖的种类与含量。结果表明,瑶山甜茶中可溶性总糖含量为15.20%,相对标准偏差(RSD)为0.996%;多糖分子量Mw范围为51551~55628,RSD为0.64%~1.23%;单糖种类主要为木糖、果糖和葡萄糖,相对含量分别是0.54%、52.18%和42.76%。
瑶山甜茶,可溶性糖,蒽酮-硫酸法,高效凝胶过滤色谱法(HPGFC),高效液相-蒸发光散射法(HPLC-ELSD)
瑶山甜茶是多年生落叶带刺灌木,经鉴定为蔷薇科悬钩子属植物[1],广泛分布于广西金秀、桂平、藤县等地区,学名Rubus Suavissimus S.Lee,国外也称之为Tien cha或Chinese sweet tea,因其叶具有强烈的甜味口感而得名,并在民间入药用于补肾降压,被当做一种茶而饮用已久。甜茶的主要甜味成分是甜茶甙,约占甜茶干叶重量的5%[2],质量浓度为0.025%时其甜度是蔗糖的115倍,这使得瑶山甜茶具有优良天然甜味剂的品质[3-4]。随着人们生活水平的提高,人口老龄化加剧以及肥胖发生率的增加,糖尿病的发病率呈逐年上升趋势。据统计[5],中国已确诊的糖尿病患者仅城市地区就高达4000万,城乡人群发病率正以令人担忧的速度递增。这使得寻找新的非糖低能量天然甜味剂的问题亟待解决,也为瑶山甜茶提供了潜在的巨大市场。近年来研究表明,甜茶及其提取物具有抗过敏[6]、抑制糖基转化以及防止肥胖和治疗糖尿病等药效功能,将甜茶用作食品或药品中的重要成分已有文献报道[7-9]。然而,甜茶的甜味物质在报道中多为甜茶甙及其衍生物,甜茶自身的糖类物质未见确切报道。本文利用蒽酮-硫酸比色法测定瑶山甜茶中可溶性总糖,采用HPGFC法测定甜茶中多糖含量以及平均分子量分布范围,利用高效液相色谱法(HPLC-ELSD)测定瑶山甜茶中的寡糖和单糖种类和含量,为瑶山甜茶这一优良的食药两用资源的产品深开发提供实验数据和依据。
1 材料与方法
1.1 材料与仪器
甜茶干叶 产于广西金秀大瑶山,经粉碎后过40目筛;葡萄糖、果糖、蔗糖 均为分析纯,上海国药集团;低聚果糖 由广西奥立高生物有限公司提供,纯度大于99%;系列葡聚糖标准品 重均分子量(Mw)范围为5900~778,000,Sigma公司;乙腈、乙酸乙酯 均为色谱纯,美国Fisher公司;其它试剂 均为国产分析纯;实验用水 超纯水。
桌面超滤膜组件 安玛西亚中国有限公司;UV-2501PC双光束紫外可见分光光度计 日本岛津公司;高效液相色谱系统 Waters-600-ELSD-2000,配Empower软件系统,美国Waters公司;HPLC色谱柱2,大连伊利特公司;Agilent 1100高效液相色谱系统 配示差折光检测器,Agilent GPC软件系统,美国Agilent公司;TSK凝胶柱 日本东洋曹达公司;HPGFC色谱柱。
1.2 实验方法
1.2.1 样品预处理[10-12]甜茶干叶经石油醚回流提取2h脱脂处理后,风干备用。称取20g处理好的甜茶干叶置于1000mL大烧杯中,按照料液比=1∶30(w/v,g/mL)加入90℃的超纯水,并把烧杯迅速置于85℃水浴锅中,以电动搅拌机300r/min搅拌,20min后趁热抽滤,重复浸提一次。提取液经活性炭颗粒(2%添加量,70℃水浴摇床,60r/min,30min)脱色,抽滤后得到滤液,取250mL浓缩至约50mL时用四倍的无水乙醇做醇沉处理,置于冰箱4℃冷藏室过夜,离心所得沉淀物采用真空冷冻干燥法冻干,得甜茶糖类粉末TPS1。剩余滤液采用截留分子量为10万(MWCO 100kDa)的超滤膜去除蛋白质等大分子物质和进一步脱色,透过液经真空旋转蒸发浓缩后,同样进行醇沉和真空冷冻干燥处理,得到TPS2。
1.2.2 蒽酮-硫酸法测定总糖条件[13]准确称取经石油醚处理过的干叶5g,置于250mL具塞三角瓶中,加沸水50mL,加盖超声提取10min后再进行85℃水浴提取10min,趁热抽滤,滤液冷却后定容与100mL容量瓶中,得提取液。参照文献[13],以葡萄糖为对照观测指标,采用紫外分光光度法在波长为620nm处测定甜茶可溶性总糖。
1.2.3 HPGFC色谱条件[14]色谱柱:TSK4000PW凝胶柱(7.5×300mm),TSK-3000SW 凝胶柱(7.5×300mm),TSK-Guard SW(7.5×75 mm)保护柱;柱温:23℃;柱压:0.262MPa;流动相为超纯水,超声脱气后备用;流速0.8mL/min;进样量:20!L。
精密称取系列葡聚糖标准品,用超纯水定容于5mL容量瓶,得到10.0mg/mL的标准品溶液;另分别配制此浓度的TPS1和TPS2溶液。所配溶液先经10000r/min高速离心5min,再取上清液经0.45!m的滤膜过滤后进样测定。
1.2.4 HPLC色谱条件[15-18]色谱柱:Hypersil ODS NH2(250mm×4.6mm i.d.,5!m),流动相流速:1.0mL/min;ELSD-2000条件:漂移管温度100℃,氮气做载气,载气流速为 2.5L/min。以超纯水配制4.0mg/mL的TPS1用于HPLC-ELSD测定,对照品糖液浓度为1mg/mL,所配溶液先经10000r/min高速离心5min,再取上清液经0.45!m的滤膜过滤后进样测定。
流动相体系1:参照文献[15]和[16],并通过预实验摸索,选定流动相体系1为乙腈/乙酸乙酯/水=65/25/10(v/v/v),进样量为15!L。
流动相体系2:参照文献[17]和[18],并通过预实验摸索,选定流动相2为乙腈/水=75/25(v/v),进样量为5!L。
2 结果与分析
2.1 总糖测定
蒽酮-硫酸比色法的原理是糖类在高温下被浓硫酸水解成单糖并迅速衍生成糠醛或羟甲基糖醛后,再与蒽酮结合成蓝绿色化合物,该物质在620nm处有最大紫外吸收峰,并在150!g/mL范围内,其颜色深浅与可溶性糖成正比。而且该法快速方便,在无需细分糖类的情况下,可以一次性测出总量,故本工作采用此法测定瑶山甜茶中总的可溶性糖。测定结果显示,葡萄糖标准曲线为y=0.007x+0.008(R=0.9978),线性范围是0~100!g/mL,参照此标准曲线,结合试样的吸光值得到瑶山甜茶总可溶性糖为15.20%,其RSD为0.996%(n=3)。
2.2 HPGFC测定多糖分子量
HPGFC(高效凝胶渗透色谱)是高效液相色谱这一大类中体积排阻色谱法(SEC)的一种,是使用水溶液的凝胶过滤色谱法。HPGFC以分子筛为原理,不同分子量的物质通过凝胶柱时,小分子量物质被吸附从而延后被洗出,大分子物质则率先被洗出[19]。
选用蓝色葡聚糖,作为测试大分子多糖保留时间t0的对照物,选用葡萄糖作为测试小分子糖保留时间tT的对照物,样品的保留时间为tR,若tR居于t0和tT之间,则表明样品在选用的流动相的HPGFC系统中均为选择性渗透,选用的色谱柱系统无误[20]。结果测得t0为12.773min,tT为29.952min,所测葡聚糖标准品以及样品的保留时间都在这个范围之内,表明选用的色谱系统和测定条件合适。
在1.2.3实验条件下,Mw在5900~112000之间的葡聚糖的洗脱体积(Ve)和相对分子质量对数值(lgMw)线性关系良好,拟合曲线方程为 lgMw=-0.124Ve+7.076(r=0.9950),如图1所示。每一个样品分别进样三次,分析样品的洗脱体积,确定5900~112000间的拟合曲线可以作为对照标准曲线。利用GPC软件进行分析,对照标准曲线,可知TPS1中多糖的Mw为55628,TPS2为51551,RSD为0.64%~1.23%。利用origin 8软件对色谱图进行拟合分析,发现HPGFC测定数据呈较好的正态分布。

图1 葡聚糖分子量对数值与保留时间对应关系

图2 广西甜茶糖类物质HPGFC色谱图
2.3 HPLC分析瑶山甜茶小分子糖类

表1 HPLC-ELSD测定各种糖的色谱图的分析报告
赵仁邦[15]等确定了乙腈/乙酸乙酯/水=60/25/15(v/v/v)的流动相体系在HPLC-ELSD法中能够很好地分离出枣的木糖、葡萄糖和果糖等单糖,同时可以分离出蔗糖;闫建荣[11]等利用乙腈/水 =70/30(v/v)体系在HPLC-ELSD法同时检测到云南甜茶中葡萄糖、蔗糖等8种单糖和二糖。
许秀敏[17]等在流动相为乙腈/水=75/25(v/v)的条件下采用HPLC-ELSD法较好地分离了低聚果糖的 1~5糖,Mabel M J[13]等则采用液质联用(LC-MS)法探明了低聚果糖里面除了1~5糖外,基本没有其它糖,其单糖是葡萄糖,二糖是蔗糖。
采用的乙腈/乙酸乙酯/水 =65/25/10(v/v/v)体系、乙腈/水=75/25(v/v)体系两种流动相分析瑶山甜茶的小分子糖(包括单糖、二糖至五糖)。
2.3.1 基于流动相体系1的HPLC检测 采用乙腈/乙酸乙酯/水=65/25/10(v/v/v)体系作为流动相,瑶山甜茶提取物中小分子糖的HPLC色谱图如图3所示。

图3 广西甜茶单糖高效液相分析
2.3.2 基于流动相体系2的HPLC分析检测 采用乙腈/水=75/25(v/v)流动相体系,瑶山甜茶提取物中小分子糖的HPLC色谱图如图4所示。经过实验探索后发现,该流动相体系结合1.2.4的条件,可以很好地分离低聚果糖的1~5糖,故采用低聚果糖为对照品,进行HPLC分析检测。
2.3.3 重现性和分离度测定 在体系1中以葡萄糖重复进样三次并测定其峰面积的方法来判断实验方法的重现性,在体系2中则用蔗糖来进行重现性实验。实验测定果糖峰面积平均值为312454,RSD(n=3)为1.53;蔗糖峰面积为181430,RSD(n=3)为1.25。两种流动相体系中实验所得色谱图的特征峰的分析报告见表1。
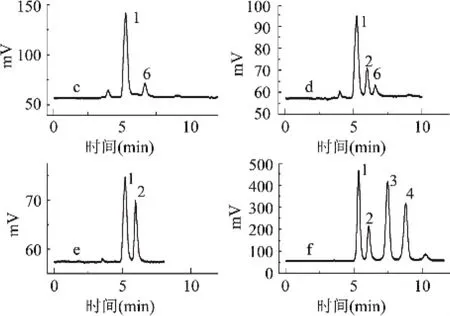
图4 广西甜茶1~5糖高效液相分析
2.3.4 分析与讨论 水提醇沉法是获得植物性多糖的常用途径,刘凌等[10]和吴晓鹏等[11]利用此法分别获得了枸杞多糖和苦丁茶多糖。而活性炭脱色法则是多糖脱色的常用方法,郑婷婷等[21]利用水提醇沉法得到芦荟多糖后对其进行了活性炭脱色;在甘蔗制糖领域里,活性炭也被认为是一种高效的糖液脱色剂[22]。单糖微溶于乙醇,蔗糖不溶于乙醇,在水中特别是热水中溶解度非常大。蔗糖在酸性水溶液中极易水解,其速度约为麦芽糖的1000倍[23]。若以得到成分较为单一或分子量较为集中的多糖为目的,一般要在水提醇沉等工艺后会对提取物进行去除单糖和低聚糖,如柴瑞娟等[24]采用了80%的乙醇5倍回流提取2h去除荞麦中的单糖和低聚糖。本实验以探索瑶山甜茶中的各种糖类为目的,故在乙醇沉淀获得TPS1和TPS2后没有采取相应的工作去除单糖和低聚糖等工作。Koh G Y等[25]利用70%乙醇沉淀得到的瑶山多糖后,采用苯酚-硫酸法直接测定其含量约为粗提物质量的11%,本文用蒽酮-硫酸法得到的结果是瑶山甜茶中全部的可溶性糖类含量,并且没有经过粗提、醇沉等可能使糖类损失的工艺,所以结果略大于Koh G Y的结果。另外,瑶山甜茶热水浸提溶液的pH经测定在5.6~6.0之间,这也有可能使得本来含有不多的蔗糖降解成了葡萄糖和果糖。
实验中采用的色谱条件,基本上满足了研究的需要,所测得的目标色谱峰分离度良好,测定结果的重现性亦表现良好。经过两种流动相体系的测定,瑶山甜茶中主要的单糖成分为葡萄糖、果糖和木糖,以面积归一化法计算得到果糖占有单糖的52.18%,葡萄糖占42.76%,木糖占0.54%;在本工作的色谱条件下,低聚寡糖中未检出蔗糖成分。而在所得色谱图中,还存在0号和6号两个未知峰,这有待下一步工作继续探索,要更为精确地判定瑶山甜茶所含的水溶性糖类成分,LC-MS法将是比较理想的方法。
3 结论
本文建立了瑶山甜茶可溶性总糖含量、多糖分子量以及低分子糖类种类和含量的测定方法,检测分析了瑶山甜茶干叶中可溶性糖类的种类与含量。实验表明,实验中涉及的蒽酮-硫酸比色法、HPGFC、HPLC等实验方法重现性较好,可操作性较强。本文建立的系列实验方法以及实验思路可以应用于其它植物资源的糖类分析。
[1]李树刚.甜茶,悬钩子属一新种[J].广西植物,1981(4):17-19.
[2]Chou G X,Xu S J,Liu D,et al.Quantitative and Fingerprint Analyses of Chinese Sweet Tea Plant(Rubus suavissimus S.Lee)[J].Journal of Agricultural and Food Chemistry,2009,57(3):1076-1083.
[3]OHTANI K,AIKAWA Y,KASAI R,et al.Minor diterpene glycosides from sweet leaves of Rubus suavissimus[J].Phytochemistry,1992,31(5):1553-1559.
[4]Sugimoto N,K Sato,Liu Hong Min,et al.Analysis of rubusoside and related compounds in tenryocha extract sweetener.[J].Shokuhin Eiseigaku Zasshi,2002,43(4):250-253.
[5]陈国东.糖尿病市场放量可期[N/OL].医药经济报,2008-11-17(A02)[2009-09-26].http://www.yyjjb.com.cn/html/2008-11/17/content_80315.htm.
[6]ONO YOSHIKO.Anti-inflammatory and anti-allergic effects of Tien-cha(Rubus suavissimus S.Lee)[J].Allergy in Practice,2004,317:380-385.
[7]Suntory Ltd.Antiinflammatory agent for food,medicines and cosmetics contains extract of tien cha,Rubus suavissims S.Lee as effective component[P].Japan:JP9118626-A,1997-05-06.
[8]Yakult Honsha Kk.Glycation inhibitor used as food additive,bathing agent or cosmetic to control e.g.ageing and Alzheimer’s disease,joint disease and kidney disease comprises extract of plant[P].Japan:JP2004250445-A,2004-09-09.
[9]EHATA MASANAO.Health tea comprises mixture of yacon stem portion, Eleutherococcus senticosus and/or Rubus suavissimus belonging to Rosaceae family of Rubus genus[P].Japan,JP2003265151-A,2003-09-24.
[10]刘凌,孙慧,周明,等.提取纯化工艺对枸杞多糖抗氧化功能的影响[J].食品与发酵工业,2009,35(7):156-159.
[11]吴晓鹏,王一飞,刘秋英,等.苦丁茶多糖的提取分离纯化及部分理化性质研究[J].食品与发酵工业,2007,33(6):141-144.
[12]李超,王俊儒,季晓晖.天麻多糖的分离及其单糖组成分析[J].中国农学通报,2008,24(7):89-92.
[13]张维杰.糖复合生化研究技术[M].杭州:浙江大学出版社,1999:12-13.
[14]刘丽娅.溶析结晶辅助膜分离技术纯化药用右旋糖酐的研究[D].南宁:广西大学,2008:21-22.
[15]赵仁邦,刘孟军,葛微,等.高效液相色谱法测定枣中的糖类物质[J].食品科学,2004,25(8):138-142.
[16]闫建荣,杨亚玲,刘谋盛.固相萃取高效液相色谱测定鱼腥草、甜茶中的糖[J].云南大学学报:自然科学版,2007,29(4):404-407.
[17]许秀敏,龙朝阳,鲁琳,等.HPLC-ELSD法测定食品中低聚果糖的含量[J].中国卫生检验杂志,2008,18(10):2002-2003.
[18]MabelM J,P T Sangeetha,etal.Physicochemical characterization of fructooligosaccharides and evaluation of their suitability as a potential sweetener for diabetics[J].Carbohydrate Research,2008,343(1):56-66.
[19]于世林.高效液相色谱方法及应用[M].北京:化学工业出版社,2005:144-145.
[20]中华人民共和国药典委员会.中国药典[M].2005版.北京:化学工业出版社,2005:89.
[21]郑婷婷,李多伟,张嘉,等.芦荟中芦荟多糖提取及脱色工艺的研究[J].食品工业科技,2005,26(9):120-121.
[22]霍汉镇,谭必明.活性炭—高效的糖液脱色剂[J].广西轻工业,2003(3):16-19.
[23]王镜岩,朱圣庚,徐长法.生物化学[M].第三版.北京:高等教育出版社,2002:15-40.
[24]柴瑞娟,马加红,徐的琴.水溶液提取荞麦水溶性多糖的研究[J].食品工业科技,2007,28(4):163-164.
[25]Koh G Y,G X Chou,Liu Z J,et al.Purification of a Water Extract of Chinese Sweet Tea Plant(Rubus suavissimus S.Lee)by Alcohol Precipitation[J].Journal of Agricultural and Food Chemistry,2009,57(11):5000-5006.
Determination of the soluble sugar in Rubus Suavissimus S.Lee
ZOU Qing-song,CHEN Shan*,WANG Xiao,CHEN Wei,LI Su-xia,WEI Yan-jun
(Center for Sugar Technology Research,Guangxi University,Nanning 530004,China)
To investigate the content and component of the soluble sugar in R.Suavissimus S.Lee,an anthronesulfuric acid chromatometry method was used to determine total soluble sugar content,and a high performance filter chromatography(HPGFC)was used to determine the molecular of its polysaccharide,and so was high performance liquid chromatography-evaporative light scattering detection(HPLC-ELSD)to determine the component and quantity of the monosaccharide and low-molecular-oligosaccharide.The results showed that the total soluble sugar was 15.2%with RSD of 0.996%,the molecular range was between 51551~55628.Xylose,fructose and glucose was the main monosccharide in R.Suavissimus with a content of 0.54%,52.18%and 42.76%respectively in area normalization method.
Rubus Suavissimus S.Lee;soluble sugar;anthrone-sulfuric acid chromatometry;HPGFC;HPLC-ELSD
TS207.2
A
1002-0306(2011)01-0296-04
2010-01-15 *通讯联系人
邹青松(1983-),男,在读硕士研究生,研究方向:糖料资源功能研究与综合利用。
广西区自然科学基金项目(0731051);广西区研究生创新项目(105930903060)。

