羧甲基化壳聚糖修饰磁性Fe3O4纳米粒子去除Cu(Ⅱ)离子
程昌敬,左 芳,吴莉莉
(西南民族大学化学与环境保护工程学院,四川 成都 610041)
研究开发
羧甲基化壳聚糖修饰磁性Fe3O4纳米粒子去除Cu(Ⅱ)离子
程昌敬,左 芳,吴莉莉
(西南民族大学化学与环境保护工程学院,四川 成都 610041)
采用化学共沉淀法制备磁性Fe3O4纳米粒子,通过在磁性Fe3O4纳米粒子表面接枝高脱乙酰度羧甲基化壳聚糖(CMC),制备了一种新型磁性纳米吸附剂。通过透射电镜、红外光谱、X射线衍射、振动样品磁强计对其进行了表征,着重研究其对Cu(Ⅱ)离子的吸附性能。结果表明:溶液pH值能显著影响吸附剂对Cu(Ⅱ)的吸附效果,pH值为5时其效果最佳。等温吸附数据符合Langmuir 模型,T=298 K、pH=5、V=5 mL时,吸附剂的饱和吸附容量qm高达71.43 mg/g,吸附常数为0.0543 L/mg。
功能化纳米粒子;壳聚糖;Cu(Ⅱ);吸附;Langmuir模型
水体中重金属的污染给人类健康以及生态环境带来了严重的危害。铜虽是人体必需的微量元素,但过量的摄入会引起高血压、贫血、肝损伤等危害[1]。因此,如何有效去除水体中重金属铜离子Cu(Ⅱ)已成为目前亟待解决的重要问题。吸附法是处理含Cu(Ⅱ)废水最常用的方法。磁性纳米粒子,如磁性Fe3O4、γ-Fe2O3由于具有较大的比表面积,且在磁场作用下易于富集分离,因此被认为是一种潜在的重金属吸附剂[2-3]。在实际应用中,为了增加磁性纳米粒子对重金属的吸附容量,往往需要对其表面进行适当的修饰。壳聚糖(CS)由于其分子中大量氨基(—NH2)和羟基(—OH)可与重金属离子形成稳定的螯合物,并且还具有良好的生物相容性、生物降解性,因此是一种磁性纳米粒子改性的优良材料。CS分子中-NH2的含量直接影响着其对重金属离子的吸附容量[4],CS是甲壳素在碱性条件下脱去分子中 2-位乙酰基的产物(脱乙酰化)。其中,脱去的乙酰基(被—NH2取代)与原甲壳素分子中乙酰基数之比称为脱乙酰度。所以,CS的脱乙酰度直接影响着其对重金属离子的吸附容量;CS的脱乙酰度越高,分子中吸附重金属离子的位点(—NH2)也越多,相应地其吸附容量也越大。目前关于使用CS或化学改性CS(如羧甲基化CS,CMC)对磁性纳米粒子进行改性,并将其用做重金属(或贵金属)吸附材料的研究已有不少报道[5-7],但吸附容量均不太理想。而吸附容量大小是吸附剂使用时的一项重要性能指标。由此可见,开发一种对重金属离子具有较高吸附容量的纳米吸附剂具有十分重要的意义。
本研究先将具有高脱乙酰度CS进行羧甲基化处理,制得高脱乙酰度羧甲基化的壳聚糖(CMC),然后通过碳二亚胺活化法将CMC接枝于共沉淀法制备的Fe3O4纳米粒子表面,制备了具有核壳结构的磁性纳米复合材料,其制备过程如图1所示。并将其作为废水中Cu(Ⅱ)的吸附剂,考察其对废水中Cu(Ⅱ)的吸附效果,并对其作用机理进行了初步探讨。研究结果表明:所制备的磁性Fe3O4@CMC纳米粒子对Cu(Ⅱ)具有较高的吸附性能,是一种去除废水中Cu(Ⅱ)的优良吸附材料。
1 实验部分
1.1 原料
氯化亚铁(FeCl2·4H2O)、三氯化铁(FeCl3·6H2O)、氯化铜(CuCl2·2H2O)、氢氧化钠(NaOH)、异丙醇、氯乙酸,成都科龙化工试剂厂,分析纯;高脱乙酰度壳聚糖(CS,脱乙酰度为 97.4%),青岛云宙生物科技有限公司,食品级;碳二亚胺盐酸盐(EDC),Sigma公司;水为去离子水;其它试剂和药品均为分析纯。
1.2 羧甲基化壳聚糖接枝磁性 Fe3O4纳米粒子的制备
1.2.1 羧甲基化壳聚糖(CMC)的制备
将5 g CS加入75 mL异丙醇中,搅拌下缓慢加入125 mL40%的NaOH溶液,于333 K下搅拌碱化1 h。然后滴入溶有30 g氯乙酸的异丙醇溶液100 mL,1 h内滴加完毕,于333 K下反应4 h,然后加入250 mL乙醇(70%)终止反应。过滤固体,滤物分别用70%和90%乙醇洗涤至中性,于323 K下真空干燥。
1.2.2 磁性Fe3O4纳米粒子的制备
将 FeCl3·6H2O(10.8417 g)和 FeCl2·4H2O(3.9817 g)溶于 150 mL去氧去离子中,在室温N2保护下将20 mL NaOH溶液(10 mol/L)逐滴加入上述溶液中,30 min内滴加完。快速搅拌1 h后升温至353 K,继续搅拌1 h,反应结束后,将冷却至室温的反应液进行磁分离,用去离子水、乙醇洗涤至中性,于室温下真空干燥48 h备用。
1.2.3 羧甲基化壳聚糖接枝磁性纳米粒子(Fe3O4@CMC)的制备
于50 mL锥形瓶中加入200 mg Fe3O4和4 mL缓冲液 A(0.003 mol/L磷酸,pH ≈ 6,0.1 mol/L NaCl),再加入1 mL EDC溶液(偶联剂,溶于缓冲液A中,0.025 g/L),超声分散条件下反应10 min。最后,加入5 mL CMC(溶于缓冲溶液A中,50 g/L)在293 K下反应60 min,磁分离Fe3O4@CMC纳米粒子,在2 min内颗粒完全沉降,用注射器移去上清液,固体颗粒分别用去离子水和乙醇(90%)洗涤3∼5次。NaCl作为电解质能引起絮凝作用,碱性介质能加速磁性颗粒的分离和沉降。

图1 羧甲基化壳聚糖接枝磁性纳米吸附剂的合成示意图
1.3 样品测试及表征
样品的形貌采用JEOL的JEM-100CX型透射电子显微镜(TEM)进行表征,将制得的粒子用去离子水稀释后超声30 min,然后滴于涂炭铜网上挥发至干,测试粒子的形貌和大小;粒子的化学成分采用Thermo Nicolet公司的IR 200傅里叶变换红外光谱仪经KBr固体压片后进行分析;粒子的晶体衍射实验采用荷兰飞利浦公司的X pert Pro MPD XRD分析仪进行表征,扫描速度10°/ min,扫描范围为10°~70°;粒子的磁性能采用美国量子公司的MPMS(SQUID)XL磁学测量系统在298 K时进行测试。
1.4 吸附实验
Fe3O4@CMC纳米粒子对Cu(Ⅱ)的吸附实验范围为:吸附温度298 K,pH=2∼5,溶液的pH值用0.1 mol/L的HCl溶液或0.1 mol/L的NaOH溶液进行调节。实验时,将105 mg Fe3O4@CMC纳米粒子加入到5 mL CuCl2溶液中振荡吸附1 h至平衡,磁分离吸附剂。吸附剂的浓度固定为21 mg/mL。过滤清液中Cu(Ⅱ)浓度由美国热电公司的SOLAAR原子吸收光谱仪进行测定。吸附容量用式(1)进行计算。

式中,q为吸附容量,mg/g;C0为Cu(Ⅱ)初始浓度,mg/L;Ce为吸附平衡时溶液中Cu(Ⅱ)的浓度,mg/L;V为吸附液体积,L;m为吸附剂用量,g。
2 结果与讨论
2.1 材料的表征
Fe3O4和Fe3O4@CMC粒子的TEM形貌如图2所示。从图中可以看出,磁性 Fe3O4粒子经 CMC接枝包覆后,其分散性良好,基本为单分散,其平均粒径约为17 nm,比Fe3O4纳米粒子的粒径(约为14 nm)略微增大。这主要是由于CMC仅在Fe3O4纳米粒子表面接枝的缘故。

图2 典型的Fe3O4和Fe3O4@CMC粒子TEM图
图3给出了样品的FT-IR图,在图3(a)中,580 cm-1归属为Fe—O的伸缩振动特征峰,1630 cm-1归属为Fe3O4粒子表面结合水的羟基(—OH)弯曲振动特征峰;在图3(c)中580 cm-1出现了Fe—O伸缩振动特征峰;约1080 cm-1出现了CMC骨架C—O—C的伸缩振动特征峰,在1400 cm-1出现了CMC分子—CH2(C—H)的对称变形振动特征峰;在1620 cm-1处出现了CMC中C=O的伸缩振动和—NH2(N—H)变形振动特征峰,以上结果表明CMC已成功接枝于Fe3O4纳米粒子表面。
图4(a)和4(b)为纯Fe3O4和Fe3O4@CMC纳米粒子的XRD图谱,在Fe3O4@CMC的XRD图谱中出现了Fe3O4的6个典型特征峰(30.1°,35.5°,43.1°,53.4°,57.0°和62.6°),分别对应于Fe3O4不同的晶面[(220),(311),(400),(422),(511),(440)],表明磁性物质为纯Fe3O4,并且CMC的接枝包覆不会引起Fe3O4晶相的变化。

图3 Fe3O4(a)纳米粒子、CMC(b)以及Fe3O4@CMC(c)纳米粒子的FT-IR谱图
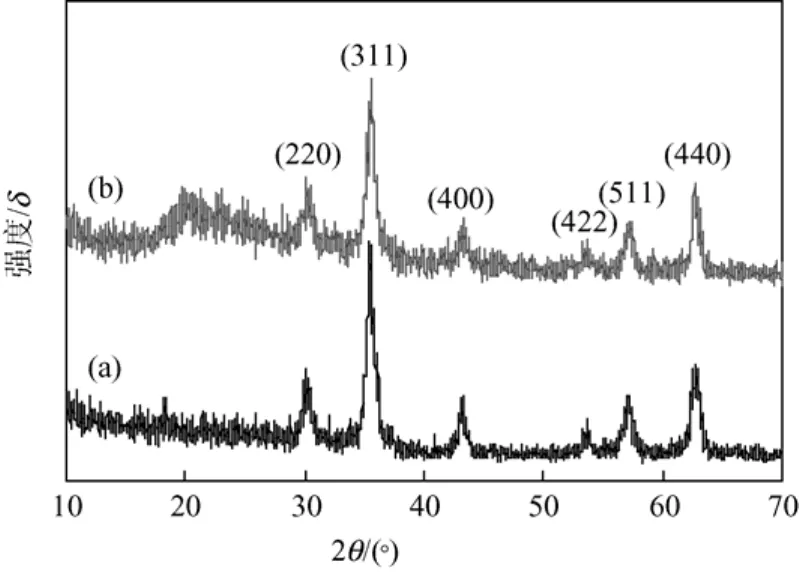
图4 Fe3O4(a)和Fe3O4@CMC(b)纳米粒子的XRD谱图

图5 298 K下Fe3O4@Lys纳米粒子的VSM图

图6 Fe3O4@Lys纳米粒子在磁场作用下分散和富集
Fe3O4@CMC纳米粒子的磁性能是其作为吸附剂使用时的一重要因素。图 5及图 6给出了Fe3O4@CMC样品的磁性能。从样品的磁滞回线(图5)可以看出,Fe3O4@CMC纳米粒子的饱和磁化强度为23.10 emu/g,与纯Fe3O4纳米粒子相比有所降低(纯 Fe3O4纳米粒子的饱和磁化强度为 73.8 emu/g),这主要是由于Fe3O4粒子表面CMC壳层不具有磁性的缘故。但接枝包覆后的 Fe3O4@CMC纳米粒子仍具有良好的磁性能,在磁场作用下很容易实现富集分离(图6)。
2.2 吸附性能
2.2.1 溶液pH值对吸附容量的影响
在298 K、吸附剂量一定的条件下,溶液的pH值对吸附性能的影响如图7所示。从图中可看出,溶液的pH值对吸附剂的吸附作用有显著影响。吸附容量随溶液pH值的递增而逐渐增大,当溶液的pH值在 3.0~5.0范围内几乎不再变化,吸附剂和Cu(Ⅱ)之间已达到了吸附平衡。当溶液pH>5.0后,由于溶液中的Cu(Ⅱ)发生了沉淀形成了Cu(OH)2,所以pH值大于5.0后的吸附实验没有开展。当溶液的pH <1.0,吸附剂表面壳层上的—NH2由于发生了质子化生成了—NH3+,故对Cu(Ⅱ)不发生吸附,因此可应用该条件对吸附的Cu(Ⅱ)进行洗脱。

图7 溶液pH值对Fe3O4@CMC纳米粒子吸附Cu(Ⅱ)作用的影响

图8 Fe3O4@CMC纳米粒子对Cu(Ⅱ)的等温吸附线和等温吸附方程(见插入图)
2.2.2 等温吸附线
在 pH值为 5、298 K时,吸附剂用量为 21 mg/mL时,吸附剂对Cu(Ⅱ)的吸附等温线如图8所示,为L型,吸附等温线用Langmuir等温吸附模型拟合,如式(2)。

式中,q为吸附容量,mg/g;C0为Cu(Ⅱ)初始浓度,mg/L;Ce为吸附平衡时溶液中Cu(Ⅱ)的浓度,mg/L;V为吸附液体积,L;m为吸附剂用量,g;qm为饱和吸附容量,mg/g;K为吸附平衡常数,L/mg。从图中可以看出,Ce/q-Ce呈线性,直线的拟合方程为Ce/q= 0.014Ce+ 0.2579(R2= 0.999),由此可计算出:qm=71.43 mg/g;K=0.0543 L/mg。
2.2.3 吸附性能的比较
表1中比较了本工作所制备的吸附剂与文献已报道的几种吸附剂对Cu(Ⅱ)的吸附效果。由比较结果可知,本文作者所研制的磁性Fe3O4@CMC纳米吸附剂具有比文献所述材料较高的饱和吸附量,是一种潜在的能有效吸附和去除废水中 Cu(Ⅱ)的吸附剂。

表1 不同吸附剂对Cu(Ⅱ)吸附容量的比较
3 结 论
本研究成功制备了高脱乙酰度羧甲基化壳聚糖包覆的磁性Fe3O4@CMC纳米吸附剂,其平均粒径约为 17 nm;羧甲基化壳聚糖的包覆并未改变Fe3O4纳米粒子的晶相;制备的磁性 Fe3O4@CMC纳米吸附剂对 Cu(Ⅱ)具有良好的吸附性能;T=298 K,pH=5,V=5 mL,吸附剂的饱和吸附容量qm=71.43 mg/g;该吸附剂对Cu(Ⅱ)的等温吸附线符合Langmuir模型。
[1]Camp R T,Water and Its Impurities[M]. 2nd ed. New York:Reinhold,1964.
[2]Hu J,Chen G H,Lo I M C. Selective removal of heavy metals from industrial wastewater using maghemite nanoparticle:Performance and mechanisms[J].Journal of Environmental Engineering,2006,132(7):709-715.
[3]Tuutijärvi T,Lu J,Sillanpää M,Chen G. As(V)adsorption on maghemite nanoparticles[J].Journal of Hazardous Materials,2009,166(2-3):1415-1420.
[4]Guibal E. Interactions of metal ions with chitosan-based sorbents:A review[J].Separation and Purification Technology,2004,38:43-74.
[5]Chang Y C,Chen D H. Preparation and adsorption properties of monodisperse chitosan-bound Fe3O4magnetic nanoparticles for removal of Cu(Ⅱ) ions[J].Journal of Colloid Interface Science,2005,283(2):446-451.
[6]周利民,王一平,刘峙嵘,等. 羧甲基化壳聚糖-Fe3O4纳米粒子的制备及对Zn2+的吸附行为[J]. 物理化学学报,2006,22(11):1342-1346.
[7]周利民,王一平,刘峙嵘,等. 磁性羧甲基化壳聚糖纳米粒子吸附铂和钯[J]. 北京科技大学学报,2009,31(1):88-92.
[8]Huang S H,Chen D H. Rapid removal of heavy metal cations and anions from aqueous solutions by an amino-functionalized magnetic nano-adsorbent[J].Journal of Hazardous Materials,2009,163(1):174-179.
[9]Wang H J,Kang J,Liu H J,et al. Preparation of organically functionalized silica gel as adsorbent for copper ion adsorption[J].Journal of Environmental Science,2009,21:1473-1479.
[10]Wang J H,Zheng S R,Shao Y,et al. Amino-functionalized Fe3O4@SiO2core-shell magnetic nanomaterial as a novel adsorbent for aqueous heavy metals removal[J].Journal of Colloid and Interface Science,2010,349:293-299.
Removal of Cu(Ⅱ) ions by carboxymethylated-chitosan modified magnetic Fe3O4nanoparticles
CHENG Changjing,ZUO Fang,WU Lili
( School of Chemistry and Environment Protection Engineering,Southwest University for Nationalities,Chengdu 610041,Sichuan,China)
A novel magnetic nano-adsorbent was prepared by covalent binding of high-deacetylated-degree carboxymethylated chitosan onto the surface of magnetic Fe3O4nanoparticles,which were fabricated by a chemical coprecipitation method. The adsorbent was characterized by transmission electron microscopy(TEM),Fourier transform infrared spectroscopy(FT-IR),X-ray diffraction patterns(XRD),and vibrating sample magnetometer(VSM). Moreover,the adsorption property of the magnetic nano-adsorbent for Cu(Ⅱ) ions was also investigated. The results showed that the adsorption capability was significantly affected by pH,and the adsorption capacity was the best at pH=5. The adsorption data obeyed the Langmuir equation with a maximum adsorption capacity of 71.43 mg/g and a Langmuir adsorption equilibrium constant of 0.0543 L/mg.
functionalized nanoparticles;chitosan;copper(Ⅱ) ions;adsorption;Langmuir isotherm
TQ 319
A
1000–6613(2011)11–2549–05
2011-04-11;修改稿日期2011-05-05。
中央高校基本科研业务费专项资金(10NZYZJ09)、西南民族大学引进人才资助(2009RC008)及西南民族大学化学一级学科硕士点建设资金项目。
及联系人:程昌敬(1980—),男,博士,讲师,主要从事功能高分子微纳米材料的研究。Email changjing_cheng@163.com。

