胶束电动毛细管色谱法测定水中的毒死蜱含量*
陶玉贵 王其进 黄晓东 谷 浩 倪 正
(安徽工程大学生物与化学工程学院/安徽省微生物发酵工程技术研究中心,芜湖,241000)
胶束电动毛细管色谱法测定水中的毒死蜱含量*
陶玉贵**王其进 黄晓东 谷 浩 倪 正
(安徽工程大学生物与化学工程学院/安徽省微生物发酵工程技术研究中心,芜湖,241000)
利用胶束电动毛细管色谱(MEKC)建立了测定水中毒死蜱含量的方法,研究了检测波长、运行缓冲液的种类、浓度以及pH、有机添加剂、脱氧胆酸钠(NaDCh)的浓度和分离电压等实验条件对毒死蜱测定的影响.实验结果表明,以 25 mmol·L-1硼砂(pH 9.0,含 20%(V/V)乙腈和 50 mmol·L-1NaDCh)作为缓冲溶液,毒死蜱能在15 min内实现很好的基线分离,线性范围为15.63—500 mg·L-1,线性相关系数为0.9998,检出限(以信噪比(S/N=3)计)为0.135 mg·L-1,加标回收率为98.91%—100.9%.精密度和稳定性实验中,峰面积和迁移时间的相对标准偏差均小于3%,表明重复性良好.
毛细管电泳,胶束电动毛细管色谱,毒死蜱,水,测定.
O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯是一种广泛应用于谷物、水果、蔬菜、茶等农作物的中等毒性内吸性有机磷杀虫剂[1],商品名称为毒死蜱(chlorpyrifos).毒死蜱能通过抑制体内神经病靶酯酶,并使之“老化”,从而引起迟发性神经病、新生婴儿免疫功能缺陷[2]和癌症[3];此外,毒死蜱在土壤中的降解半衰期高达278 d[4],毒死蜱在环境中的残留会污染土壤、地表水和地下水,最终对环境生物和人体健康产生影响.
目前,国内外报道的检测毒死蜱的方法主要有气相色谱法(GC)、高效液相色谱法(HPLC)等[5-8].而近几年,高效毛细管电泳(HPCE)以其高效、快速、低消耗的特点而越来越被人们关注,并广泛地用于农药残留的检测.胶束电动毛细管色谱法(MEKC)是在缓冲溶液中加入表面活性剂,当其浓度达到或超过临界胶束浓度时就会产生胶束(准固定相),利用溶质不同的疏水性,在水相和胶束相间的分配行为不同,使混合组分得以分离,胶束电动毛细管色谱法既可分析带电物质又可分析中性物质,独特的优势使其在农药和天然产物分析中得到了广泛的应用[9-11].胆酸盐是一类生物表面活性剂,有研究表明胆酸盐可以形成螺旋状的胶束,疏水端水溶液紧密接触,与十二烷基硫酸钠(SDS)胶束相比较,它更能适应高浓度的有机溶剂,而且形成的聚集体相比烷基链表面活性剂更具有极性[12].
本文利用毛细管电泳技术,在检测样品中通过添加脱氧胆酸钠(NaDCh)进行增溶,使毒死蜱在水相和胶束相之间因分配系数不同而得到分离,从而达到检测水中毒死蜱的含量.
1 实验部分
1.1 仪器与试剂
Beckman P/ACE MDQ毛细管电泳仪,配备二极管阵列检测器;未涂层石英毛细管:36 cm×75 μm(美国 Beckman Coulter).实验中所有数据采集和计算用32Karat softwareV4.0软件(美国 Beckman Coulter).PH-510型精密酸度计(上海雷磁仪器厂).Sartorius公司万分之一天平;ELGA公司超纯水仪;湖南省凯达实业发展有限公司TD5Z台式离心机.
毒死蜱标准品(北京上立方联合化工技术研究院);硼砂、脱氧胆酸钠(NaDCh)、甲醇、乙腈等均为分析纯;实验所用水均为二次蒸馏水.
1.2 标准品溶液和样品溶液的制备
标准品溶液:精确称取毒死蜱标准品10 mg,用10 mL乙腈溶解,即得质量浓度为1000 μg·mL-1的标准品溶液,置于4℃冰箱中保存,使用时稀释成各种浓度的标准溶液.
样品溶液的制备:将水样离心,取20 mL的离心上清液,倒入250 mL的分液漏斗中,加入2—3 g氯化钠,分别用40、30、30 mL二氯甲烷萃取,待静止分层后,将下层有机相经无水硫酸钠脱水,合并萃取液.吸取20 mL二氯甲烷溶液于150 mL烧杯中,加入0.5 mL乙酸乙酯,将烧杯放在65℃水浴锅上加热,杯内缓缓通入氮气流,浓缩萃取物至近干,用乙腈定容至5 mL[13].经0.45 μm有机膜过滤,滤液备用.
1.3 电泳条件
电泳运行缓冲液为25 mmol·L-1硼砂溶液,含 20%(V/V,下同)乙腈和 50 mmol·L-1脱氧胆酸钠,pH值为9.0;紫外检测波长为293 nm;分离电压为25 kV;压力:0.5 psi;进样时间:5 s;温度:25℃.毛细管柱在每次使用前依次用二次蒸馏水、0.1 mol·L-1NaOH、二次蒸馏水分别预洗2 min,再用缓冲液洗5 min.样品采用压力进样,紫外检测.所有溶液在进入毛细管分离柱前,均用0.45 μm微孔滤膜过滤.重复进样时只用缓冲溶液冲洗2 min,更换不同缓冲溶液时按上述步骤重新处理.
2 结果与讨论
2.1 电泳条件的选择
2.1.1 检测波长的选择
利用二极管阵列检测器对毒死蜱标样进行全波长扫描(190—300 nm).确定293 nm作为检测波长,此时有较大的吸收峰,且基线平稳.
2.1.2 缓冲液种类、浓度和pH值的选择
采用了不同 pH 值(6.0、7.0、8.0、9.0、10.0)的 NaH2PO4-Na2HPO4缓冲体系进行电泳,结果表明在 pH值为9.0时,电泳效果最好.考察了几种pH值范围在9.0不同的缓冲体系(硼砂缓冲体系、Tris-HCl缓冲体系),结果表明Tris-HCl体系背景噪音较大,硼砂缓冲体系峰形较好,噪音小,因此选用硼砂缓冲体系.
进一步考察了硼砂的浓度为10—35 mmol·L-1时对分离度和分离电流的影响.结果表明,随着硼砂浓度的提高,在其它条件保持不变的情况下,毒死蜱的迁移时间延迟,如图1所示.出现这种现象可能的原因是MEKC胶束毛细管电泳的分离原理可以看作是以电渗流作驱动力的液-液分配色谱,随着缓冲溶液中离子强度的增加,溶液的导电性增强,电流增加,同时由于缓冲溶液中阳离子浓度的增加,导致zeta电势降低,双电子层变薄,电渗流下降.由图1可以看出,当缓冲溶液的浓度达到25 mmol·L-1时,峰高值最大,且峰形窄,分离效果较好.考虑到检测时间和峰分离度,选择25 mmol·L-1作为实验浓度.
缓冲体系pH值是影响分离度的重要因素之一.在硼砂缓冲液浓度为25 mmol·L-1时,对pH值从8.6至9.6每隔0.2个单位进行考察,结果如图2所示.图2可见,随着pH值的增高,出峰时间逐渐提前.一定程度上,峰高值越大,分离效果越好,当缓冲体系pH为9.0时,峰高值最大,而且峰形最好且基线稳定.综合以上因素,本文选择pH为9.0的硼砂缓冲体系.
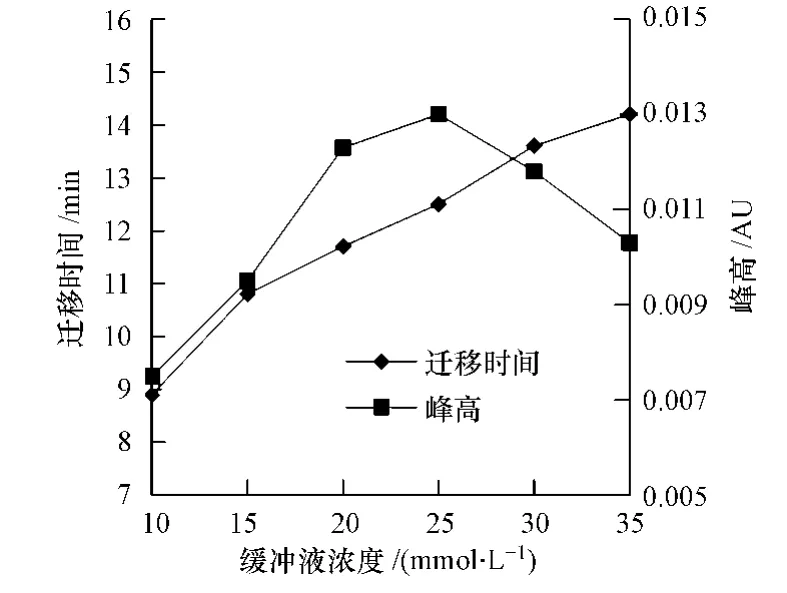
图1 缓冲液浓度对毒死蜱峰高和迁移时间的影响Fig.1 Effect of buffer concentration on migration time and peak height of chlorpyrifos
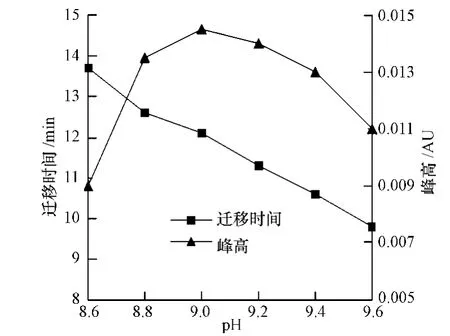
图2 硼砂缓冲体系pH对毒死蜱迁移时间和峰高的影响Fig.2 Effect of borax buffer pH on migration time and peak height of chlorpyrifos
2.1.3 有机添加剂对分离检测的影响
在使用MEKC进行电泳分离的过程中,在缓冲溶液中添加有机改性剂,通过改变缓冲体系中水相的特性,从而影响了胶束的结构,同时也增加了流动相对分析物的溶解度,以达到调节选择性、改进分离度的目的.但高浓度的有机添加剂又会造成缓冲液中盐的析出以及阻碍胶束的形成.实验中考察了甲醇、乙腈及其不同含量时对分离效果的影响.结果表明,以乙腈为有机添加剂时的目标峰较高(图3),有利于分析检测的灵敏度,所以本文选择乙腈作为有机添加剂.进一步考察了乙腈含量对分离的影响.随着乙腈添加比例的增加,目标物的迁移时间逐渐延长;乙腈含量为20%(V/V)时,目标峰的检测灵敏度达到最大,故本文选择20%的乙腈作为有机添加剂进行下一步条件的优化.
2.1.4 NaDCh 浓度的选择
在MEKC中,采用脱氧胆酸钠(NaDCh)胶束体系常常是一种有效的方法.当缓冲溶液中的NaDCh浓度超过其临界胶束浓度时,则分子缔合形成胶束.考察在25 mmol·L-1硼砂缓冲液(pH值为9.0)中,添加不同浓度 NaDCh(10、15、20、20、30、35、40、45、50、55、60 mmol·L-1)对分离效果的影响(图4).结果表明,随着NaDCh浓度的增加,胶束作用增强,目标峰迁移时间逐渐延长,峰高在NaDCh浓度为20 mmol·L-1时出现拐点后先增大后降低.当NaDCh浓度为50 mmol·L-1时,目标物的峰高达到最大,峰形最好.综合分析,本文选择NaDCh浓度为50 mmol·L-1.

图3 有机添加剂对毒死蜱峰高和迁移时间的影响Fig.3 Effect of organic additives on peak height and migration time of chlorpyrifos
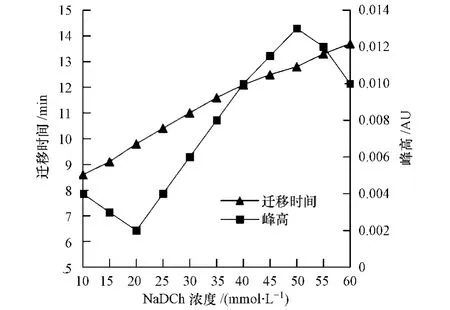
图4 NaDCh浓度对毒死蜱迁移时间和峰高的影响Fig.4 Effect of NaDCh concentration on migration time and peak height of chlorpyrifos
2.1.5 分离电压的选择
在 pH 为9.5,20 mmol·L-1的硼砂缓冲液,NaDCh 浓度为50 mmol·L-1的电泳条件下,考察了外加分离电压(13、16、19、22、25、28 kV)对溶质分离效果的影响.结果表明,随着分离电压的增大,焦耳热逐渐增大,进而使背景噪声增加;同时分离电压的增加又会导致迁移时间也逐渐减小,这又有利于样品的快速分析.综合考虑,本文选定25 kV作为电泳分离电压.
2.1.6 分离温度的选择
电泳温度的选择,主要是指毛细管外表温度的选择和控制.温度变化不仅影响分离的重现性,而且影响分离效率.本实验考察了18℃—30℃的影响,结果表明,温度越高,样品的分离效率越高,但重现性随之变差,综合考虑,选择电泳温度为25℃.
2.2 线性关系与检测限
吸取毒死蜱标准品溶液并用乙腈分别稀释至 500、250、125、62.5、31.25、15.625 mg·L-1的系列质量浓度,经1.3电泳条件测定后,以毒死蜱浓度(x)为横坐标,峰面积(y)为纵坐标,作标准曲线,得到线性回归方程为 y=467.25x+4691,标准曲线在15.625—500 mg·L-1浓度范围内线性关系良好,r=0.9998.以信噪比为3时,确定该毛细管电泳条件下的检测限为0.135 mg·L-1.
2.3 精密度试验
取样品溶液1份,在优化的电泳条件下测定,重复进样5次.峰面积的相对标准偏差(RSD)为1.9%,迁移时间的RSD为0.06%,表明在此条件下,进样精密度良好.
2.4 加标回收率试验
准确量取一定量已知毒死蜱含量的样品溶液,将样品溶液分成3组,每组3份,分别加入3种不同量的毒死蜱标准品,按照最优化条件进行测定,结果如表1所示.样品的添加平均回收率为98.91%—100.9%,表明该方法正确可靠.

表1 水样中毒死蜱的添加回收率Table 1 Fortified recovery rate of chlorpyrifos in water
2.5 样品测定
用本方法对污染严重的10块农田地表水进行测定,均检出毒死蜱,含量范围1.50—20.36 mg·L-1.在优化的电泳条件下毒死蜱标准品和水样的电泳图谱见图5.

图5 毒死蜱标准品(200 mg·L-1)和水样的胶束电动毛细管色谱图Fig.5 MEKC electropherograms of chlorpyrifos standard solution(200 mg·L -1)and water sample
3 结论
通过优化测定条件,建立了一种基于胶束电动毛细管色谱法检测水中毒死蜱的方法.该方法通过向缓冲液中加入脱氧胆酸钠和乙腈,解决了毒死蜱易吸附于毛细管管壁而无法检测的问题,适用于水中毒死蜱的定量分析.
[1]Jack D Thrashere,Gunnar Heuser,Alan B.Immunological abnormalities in human chronically exposed to chlorpyrifos[J].Archives of Environmental Health,2002,57(3):181-187
[2]Galloway T,Handy R.Immunotoxicity of organophosphorous pesticides[J].Ecotoxicology,2003,12:345-363
[3]Won J L,Aaron B,Jane A H,et al.Cancer incidence among pesticide applicators exposed to chlorpyrifos in the agricultural health study[J].Journal of the National Cancer Institute,2004,96(23):1781-1789
[4]Yucel U,Ylim M,Gozek K,et al.Chlorpyrifos degradation in Turkish soil[J].J Environ Sci and Health,1999,34(1):75-95
[5]凌云,王菡,雍炜,等.气相色谱-质谱/质谱法检测蔬菜中的毒死蜱及其代谢物[J].色谱,2009,27(1):78-81
[6]张超,杨红.水、土壤和蔬菜中毒死蜱、甲基毒死蜱残留检测前处理方法[J].农药,2010,49(5):367-370
[7]韩畅,朱鲁生,王军,等.HPLC测定水体中毒死蜱及其有毒降解产物TCP[J].农业环境科学学报,2009,28(7):1552-1556
[8]管宏云,黄晓璐.高效液相色谱法测定废水中的辛硫磷、毒死蜱[J].污染防治技术,2009,22(4):87-88
[9]张良,许杨,李燕萍.胶束电动毛细管色谱法检测红曲米中的莫纳可林K[J].色谱,2010,28(4):393-396
[10]靳淑萍,李萍,董树清,等.毛细管电泳-电化学检测法测定黄芪及其制剂中的活性成分[J].色谱,2009,27(2):229-232
[11]陶玉贵,汪耀明,叶连斌,等.水中甲胺磷的毛细管胶束电动色谱测定法[J].环境与健康杂志,2008,25(3):250-252
[12]Agmlar M,Farran A,Serra C,et al.Use of different surfactants(sodium dodecyl sulfate,bile salts and ionic polymers)in micellar electrokinetic capillary chromatography application to the separation of organophosphorus pesticides[J].Journal of Chromatography A,1997,778:201-205
[13]Song S L,Ma X D,Li C J.Multi-residue determination method of pesticides in leek by gel permeation chromatography and solid phase extraction followed by gas chromatography with mass spectrometric detector[J].Food Control,2007,18(5):448-453
DETERMINATION OF CHLORPYRIFOS IN WATER BY MICELLAR ELECTROKINETIC CAPILLARY CHROMATOGRAPHY
TAO Yugui WANG Qijin HUANG Xiaodong GU Hao NI Zheng
(Department of Biochemical Engineering,Anhui Polytechnic University/Engineering Technology Research Center of Microbial Fermentation,Wuhu,241000,China)
A method for chlorpyrifos determination in water based on micellar electrokinetic capillary chromatography had been developed.The assay conditions including detection wavelength,pH and the concentrations of running buffer,organic additive,the concentrations of sodium deoxycholate(NaDCh),and the separation voltage were optimized.Under the optimized conditions(25 mmol·L-1borate buffer(pH 9,containing 20%(V/V)acetonitrile,50 mmol·L-1NaDCh),chlorpyrifos was separated within 15 min,with a linear range of 15.63—500 mg·L-1(r2=0.9998)and a limit of detection(S/N=3)of 0.135 mg·L-1.It had good recoveries(98.91%—100.9%)and low relative standard deviations(below 3%).
capillary electrophoresis(CE),micellar electrokinetic capillary chromatography(MEKC),chlorpyrifos,water,determination.
2010年12月19日收稿.
*安徽省科技攻关计划面上项目(08010302169)资助.
**通讯联系人,Tel:0553-2871254;E-mail:taoyugui888@yahoo.com.cn

