新型C-异戊烯基香豆素的合成*1
尹 强, 许 泽, 张雅琴, 章维华
(南京农业大学 理学院,江苏 南京 210095)
异戊烯类取代基是天然产物中常见的取代基,广泛存在天然化合物如黄酮类,异黄酮类,香豆素类,色原酮类及生物碱分子结构中。一般认为,异戊烯类取代基的前体异戊烯基是在化合物骨架形成之后,在异戊烯基转移酶的作用下,连接到化合物的骨架上。此后,异戊烯基再经过一系列的修饰过程(包括氧化,环合等),便形成了各种各样的异戊烯类取代基[1~4]。
异戊烯基香豆素类化合物在植物界分布广泛,在一些高等植物,特别是药用植物中含量较高,结构多样、生物活性多样而受到广泛重视[5]。香豆素类化合物中异戊烯基的存在,可使相关生物活性(如抗菌、降血压、抗癌、抗HIV等)显著提高[6~8]。因此,开展对天然异戊烯基香豆素类化合物的合成及结构修饰、创新设计合成的探索性研究具重大意义,目前也是天然化学研究和新医药创制研究领域的热点课题[9]。
香豆素苯环上异戊烯基的引入有两种方式:关环前引入和关环后引入。目前公开报道的这两种向苯环上直接引入异戊烯基的方法的收率及效率均很不如人意[10,11]。
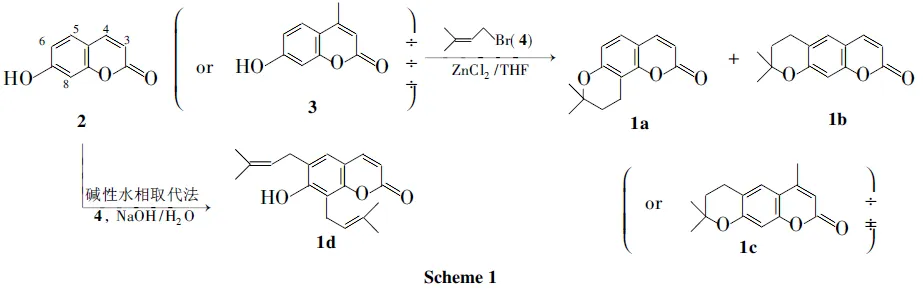
本文报道采用直接催化取代法和碱性水相取代法合成新型C-异戊烯基香豆素(1a~1d, Scheme 1),其结构经1H NMR, IR和MS表征。ZnCl2催化7-羟基香豆素(2)与4-溴异戊烯-2(4)在THF中完成异戊烯基化反应制得1a[7,8-(11,11-二甲基吡喃)香豆素]和1b[6,7-(11,11-二甲基吡喃)香豆素]的混合物,依次经硅胶柱层析和薄层硅胶制备板分离出纯品1a和1b; 用类似方法7-羟基-4-甲基香豆素(3)与4反应制得1c(7-羟基-6,8-二异戊烯基香豆素)。改用碱性水相取代法,2与4反应合成1d[4-甲基-6,7-(11,11-二甲基吡喃)香豆素]。
1 实验部分
1.1 仪器与试剂
WRS21B型数字熔点仪(温度未校正); Bruker DRX 300 MHz型核磁共振仪(CD3OD为溶剂, TMS为内标);Bruker Tensor-7型傅立叶变换红外光谱仪(KBr压片);Shimdz-QC 2010型气质联用仪(GC-MS);美国菲尼根公司Surveyor-LCQ DecaXp Plus液质联用仪(LC-MS)。
所用试剂均为市售分析纯。
1.2 合成
(1)1a~1c的合成(ZnCl2催化取代法)
在圆底烧瓶中加入2 1.62 g(10 mmol)的THF(40 mL)溶液,氮气保护,搅拌下加入ZnCl2(融熔除水)2.7 g,缓慢滴加42.3 g(15 mmol)的THF(10 mL)溶液,于80 ℃反应72 h(TLC跟踪,原料始终不能转化完全)。冷却至室温,过滤,滤液浓缩至干(淡黄色固体),经硅胶柱层析[硅胶200目~300目,梯度洗脱剂A:V(石油醚) ∶V(乙酸乙酯)=10 ∶1~5 ∶1]分离得7-异戊烯氧基香豆素[1e, 0.96 g,产率41.2%, CG-MSm/z(%): 很弱(M+), 162(M-68, 100), 69(O-prenyl)]和1a和1b的混合物(1.15 g)。混合物经自制薄层硅胶制备板(0.3 mm×200 mm×200 mm)分离得1a(0.45 g,产率19.6%)和1b(0.31 g,产率13.5%)。
以3代替2,用类似方法合成1c。硅胶柱层析分离得4-甲基-7-异戊烯氧基香豆素(1f, 1.1 g,产率45.5%)和1c(0.54 g,产率22.1%)。
1a: 白色柱状晶体,m.p.101 ℃~103 ℃;1H NMRδ: 1.37(s, 6H, CH3), 1.90(t,J=6.80 Hz, 2H, CH2), 2.86(t,J=6.80 Hz, 2H, CH2), 6.22(d,J=9.47 Hz, 1H, 3-H), 6.75(d,J=8.58 Hz, 1H, 5-H), 7.43(d,J=8.59 Hz, 1H, 6-H), 7.92(d,J=9.48 Hz, 1H, 4-H); IRν: 1 711, 1 621, 1 398, 1 271, 1 201, 1 120, 874 cm-1; GC-MSm/z(%): 230(M+, 70), 215(M+-15), 201(M+-29), 187(M+-43), 175(M+-55, 100)。
1b: 淡黄色晶体,m.p.125 ℃~127 ℃;1H NMRδ: 1.36(s, 6H, CH3), 1.88(t,J=6.74 Hz, 2H, CH2), 2.87(t,J=6.56 Hz, 2H, CH2), 6.20(d,J=9.46 Hz, 1H, 3-H), 6.64(s, 1H, 5-H), 7.41(s, 1H, 8-H) , 7.88(d,J=9.50 Hz, 1H, 4-H); IRν: 1 705, 1 614, 1 395, 1 268, 1 196, 1 120, 869 cm-1; GC-MSm/z(%): 230(M+, 35), 215(M+-15), 201(M+-29), 187(M+-43), 175((M+-55, 100)。
1c: 淡黄色柱状晶体,m.p.172 ℃~173 ℃;1H NMRδ: 1.38(s, 6H, CH3), 1.87(t,J=6.73 Hz, 2H, CH2), 2.39(s, 3H, 4-CH3), 2.86 (t,J=6.73 Hz, 2H, CH2), 6.11(s, 1H, 3-H), 6.74(s, 1H, 5-H), 7.28(s, 1H, 8-H); IRν: 1 705, 1 610, 1 396, 1 266, 1 196, 1 120, 869, 614 cm-1; GC-MSm/z(%): 244(M+, 48), 229(M+-15, 13), 189(100), 161。
(2)1d的合成(碱性水相取代法)
在圆底烧瓶中加入2 1.62 g(10 mmol), NaOH 1.5 g和水40 mL,搅拌使其完全溶解,缓慢滴加41.2 mL(10 mmol),滴毕,于室温反应6 h。用10%硫酸调至酸性,静置过夜,用乙酸乙酯(3×40 mL)萃取,合并萃取液,用无水硫酸镁干燥,浓缩至干(黄色固体),经硅胶柱层析(硅胶300目~400目,梯度洗脱剂A)分离,混合溶剂[V(丙酮) ∶V(水)=3 ∶7]重结晶得无色柱状晶体1d1.54 g,产率51.6%, m.p.138 ℃~139 ℃;1H NMRδ: 1.69(s, 3H, CH3), 1.74(s, 3H, CH3), 1.80(s, 3H, CH3), 1.87(s, 3H, CH3), 3.37(d,J=7.0 Hz, 2H, CH2), 3.56(d,J=6.5 Hz, 2H, CH2), 5.23(q,J=4.3 Hz, 1H, =CH), 5.36(q,J=4.3 Hz, 1H, CH), 6.18(d,J=8.7 Hz, 1H, 3-H) , 7.17(s, 1H, 5-H), 7.82(d,J=8.7 Hz, 1H, 4-H); IRν: 3 310, 1 701, 1 619, 1 394, 1 262, 1 189, 1 121, 870 cm-1; GC-MSm/z(%): 298(M+, 50), 283(M+-15, 10), 255(M+-43, 5), 243(M+-55, 30), 227(100), 199(35), 187(80); LC-MSm/z(%): 619(2M++Na, 100), 321(M++Na)。
2 结果与讨论
2.1 C-异戊烯基单取代产物
1a和1b的GC-MS分析结果表明其应为C-异戊烯基单取代产物,C-异戊烯基的侧链系列峰非常明显,且无69(O-prenyl)峰,与1e的MS数据特点明显不同。
由1a的1H NMR分析结果可见,两甲基峰完全一致[1.37(s, 6H)],而未环合异戊烯基侧链中两甲基处双键两端,受另一双键氢(β位)影响,化学位移一般略有差异而呈两个单峰(各3个氢),环合后,两甲基分处吡喃环两边,但化学环境完全一致,故只出现一个单峰。1H NMR中两组三重峰双氢,也验证了侧链与羟基环合(若不环合,应出现1个单氢三重峰和1个双氢二重峰)。苯环上的两个单氢之间相互偶合,符合8-取代特征(8-位取代后,5,6-位相互偶合,均为二重峰),故1a为8-取代产物。
实验的初衷是要合成8-异戊烯基香豆素(M1, Scheme 2),但最终得到的是吡喃环型香豆素产物1a,可能是M1在柱层析分离过程中硅胶作用下环合所致。此推测有待进一步考证。
与1a的分析类似,1b和1c应为6-位取代物的吡喃环型香豆素产物。
2.2 C-异戊烯基双取代产物
在1d的MS数据中,C-异戊烯基的侧链系列峰非常明显,且无69(O-prenyl)峰,再加上IR显示有羟基峰(3 310 cm-1),这些数据均反映两个异戊烯基直接连在苯环上,且异戊烯基侧链没有与邻位羟基环合。

表 1 2与4碱性水相取代反应的GC-MS分析结果*Table 1 GC-MS analysis results of the substitution reaction of 2 with 4 in aqueous slkali
*反应时间3 h,其余反应条件同1.2
1d的1H NMR分析结果表明,四个甲基峰均为单峰且化学位移分别为1.69, 1.74, 1.80和1.87,说明两个异戊烯基均为没有与羟基环合,而3.37和3.56处各出现两个氢的二重峰,5.23和5.36均出现一个氢的三重峰,也证实了两个异戊烯基的自由状态。6.18和7.82分别为相互偶合的3-位与4-位氢(均为二重峰),7.17为苯环上的孤立氢的单峰。分析结果充分证明1d为C-异戊烯基双取代产物。
2.3 反应条件讨论
(1) 催化取代法
研究2与4的催化取代反应,先后考察了催化剂(ZnCl2, AlCl3, Li2CO3, LiOH,活性锌等)和溶剂(THF, DMF,苯、甲苯、硝基苯、氯苯、二氧六环等)对取代反应的影响。实验结果表明,ZnCl2/THF,活性锌/THF和LiOH/THF体系可催化2与4的取代反应,其它组合效果不佳。
以ZnCl2/THF和活性锌/THF为催化体系时,可得到C-异戊烯基取代产物,但原料转化很不充分、反应复杂,TLC检测有多种产物生成,GC-MS追踪显示有多种单取代物出现,还存在少量二取代物。
2与4在ZnCl2/THF催化下,反应进行12 h和24 h时的GC-MS同步分析结果表明,2仍有大部分未参与反应,且随着单取代物(两种)的不断生成,二取代物开始出现。说明反应极其缓慢,2的转化率很低;而且单取代物由于异戊烯基的活化作用,其进行烃基化反应的能力稍大于2,故随着单取代物的缓慢生成,二取代物伴随增加。
(2) 碱性水相取代法
在用碱性水相取代法改进2与4的取代反应时,反应3 h的GC-MS同步分析结果表明,在合适的反应条件下,2有可能完全转化,但产物复杂。产物主成分是二取代物(50%~70%),同时,还有另一种二取代物和两种单取代物以及一种三取代物,共有6种化合物,以保留时间长短依次标记为Ⅰ~Ⅵ(见表1)。以此推测1d的反应途径如Scheme 2所示。
[1] Roland W, Hans G. Properties and solubilization of the prenyltransferase of isoflavonoid phytoalexin biosynthesis in soybean[J].Phytochemistry,1991,30(2):479-484.
[2] Satoshi T, Masaaki M, John L I,etal. Isoflavone atropisomers from Piscidia erythrina[J].Phytochemistry,1993,34(2):545-552.
[3] Satoshi T, John L I, Shiro N,etal. Fungitoxic dihydrofuranoisoflavones and related compounds in white lupin,lupinus albus[J].Phytochemistry,1984,23(9):1889-1900.
[4] Satoshi T, John L I, Junya M. Identification of an epoxy-intermediate resulting from the fungal metabolism of a prenylated isoflavone[J].Phytochemistry,1989,28(8):2079-2084.
[5] 于德泉,吴 林.天然产物化学进展[M].北京:化学工业出版社,2005.
[6] William R P, Nina J B, Leslie G,etal.C-geranyl compounds from Mimulus clevelandii[J].J Nat Prod,1996,59(5):495-497.
[7] Li H, Fekadu F, Robert J M,etal. A new prenylated flavonol from the root of Petalostemon purpureus[J].J Nat Prod,1996,59(3)290-292.
[8] Nikaido T, Ohmoto T. Inhibition of adenosine 3,5-cyclic monophosphate phosphodiesterase by flavonoids[J].Chem Pharm Bull,1989,37:1392.
[9] Koteswara R, Venkata R, Hari K,etal. Total synthesis of heliannone a and (R,S)-heliannone B,two bioactive flavonoids from helianthus annuus cultivars[J].J Nat Prod,2001,64(3):368-369.
[10] Laura P, Marcus K, Klaus P,etal. Synthesis of compounds with antiproliferative activity as analogues of prenylated natural products existing in Brazilian propolis[J].Eu J Med Chem,2006,41(3):401-407.
[11] 杨永刚,张宇,曹小平. (±)-Cudraflavanone B 及(±)-5-O-methyl cudraflavanone B的全合成研究[J].化学学报,2005,63(20):1901-1905.

