利用不对称催化的环丙烷化反应构建四氢吡咯并吲哚啉骨架*
吴 琼, 杜 宇, 宋 颢
(四川大学 华西药学院 天然药物化学系,四川 成都 610041)
以手性四氢吡咯并吲哚啉骨架(A, Chart 1)为特征的天然吲哚生物碱具有抗老年痴呆疾病、抗肿瘤多药耐药、血管舒张、抗癌、抗菌等活性[1]。A的合成常常通过不对称催化Heck反应[2]、烷基化反应和烯丙基化反应[3]、不对称加成-环合反应[4]、烷基化重排反应[5]、3,3-重排反应[7]、脱硫-环合反应[6]等方法实现。
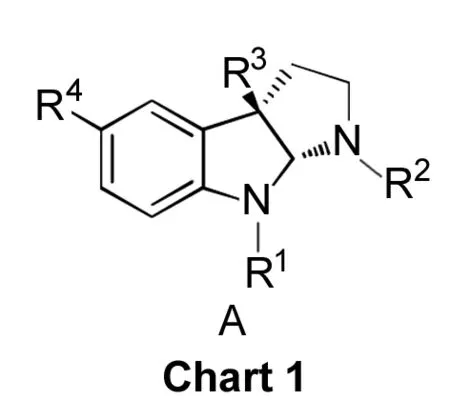
不对称环丙烷化反应一直是不对称催化领域的一个重要研究课题,并取得了长足进展[8],但目前由重氮化合物生成的金属卡宾与双键发生的不对称环丙烷化反应通常仅局限于简单的双键底物,尚未见在吲哚2,3-位双键成功实现不对称环丙烷化反应的报道[9]。
本课题组[10]曾以色氨酸衍生物(1)为原料,通过重氮环丙烷化反应完成了光学纯A的构建。为了进一步拓展环丙烷化反应的应用范围,本文以CuOTf/L3(手性配体二苯基双噁唑, Chart 2)为催化体系,1与重氮乙酸乙酯(2)于-50 ℃反应36 h,首次实现了吲哚2,3-位双键的不对称催化环丙烷化反应,构建了四氢吡咯并吲哚啉骨架(3, Scheme 1),收率42%, 50%ee,其结构经1H NMR表征。
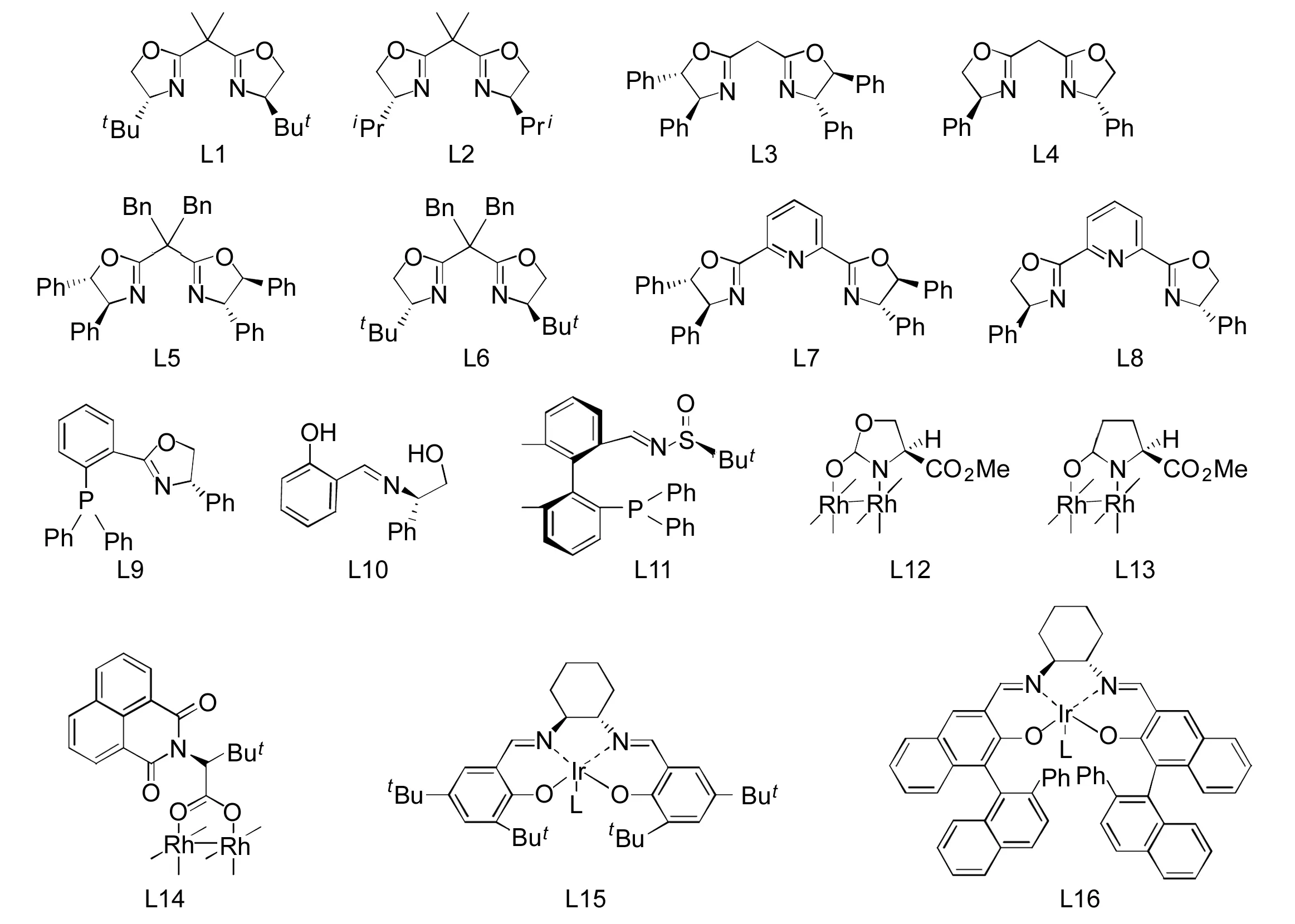
Chart 2

Scheme 1
1 实验部分
1.1 仪器与试剂
Varian Unit INOVA 400型高分辨超导核磁共振仪(CDCl3为溶剂,TMS为内标)。Varian 210型高效液相色谱仪(HPLC, Daicel OJ-H手性柱4.6 mm × 250 mm, 5 μm;柱温25 ℃;流动相为5%正己烷的异丙醇溶液,流速1.0 mL·min-1;检测波长254 nm;保留时间8.79 min和12.50 min)。
所用试剂均为市售化学纯或分析纯。反应容器和溶剂经干燥处理。
1.2 3的合成通法
氮气保护下,将手性配体Ln(25.9 mmol)和催化剂CuOTf(18.5 mmol)置于反应试管中,加入CH2Cl22.0 mL,室温下搅拌1 h制得CuOTf/Ln(n=1~16, Chart 2)溶液。加入1 100 mg(370 mmol)的CH2Cl2(2 mL)溶液,搅拌下于室温反应30 min;降温至-30 ℃,缓慢滴加2 142.4 mg(1.1 mol)的CH2Cl2溶液2 mL,滴毕,反应36 h。浓缩后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=12 ∶1]分离得淡黄色油状液体3。1H NMRδ: 1.54(t,J=7.2 Hz, 3H, 14-H), 2.22~2.30(m, 1H, 9-H), 2.35~2.40(m, 1H, 9-H), 2.77(s, 2H, 11-H), 3.03(s, 3H, 15-H), 3.19~3.26(m, 1H, 10-H), 3.91~3.95(m, 1H, 10-H), 4.04~4.10(m, 2H, 13-H), 5.85(s, 1H, 6-H), 6.41(d,J=8.0 Hz, 1H, ArH), 6.71(d,J=7.6 Hz, 1H, ArH), 7.07(d,J=7.2 Hz, 1H, ArH), 7.15(t,J=8.0 Hz, 1H, ArH)。
2 结果与讨论
2.1 Ln对合成3的影响
金属催化剂CuOTf,其余反应条件同1.2,考察手性配体Ln(n=1~11)对合成3的影响,结果见表1。由表1可见,L3具有较好的催化效果(收率45%, 33%ee)。
不加金属催化剂,直接使用L12~L16(L15在室温下反应),其余反应条件同1.2,考察其催化性能,结果显示L13和L16不能得到3; L12, L14和L15的催化效果也不理想。

表 1 Ln对合成3的影响*
*L1~L11: 金属催化剂CuOTf; L12~L16(L15在室温反应): 未加金属催化剂,其余反应条件同1.2;ee由HPLC测定

表 2 金属催化剂对合成3的影响*
*配体L3,金属催化剂5 mol%,其余反应条件同1.2;ee由HPLC测定
2.2 金属催化剂对合成3的影响
配体L3,金属催化剂5 mol%,其余反应条件同1.2,考察金属催化剂对合成3的影响。结果显示,大量典型的过渡金属催化剂,如Cu(PPh3)Cl, Ru(PPh3)CO·Cl, Cu(acac)2, AgSbF6, AgBF4, AgOTf, Rh(PPh3)3Cl, Co(PPh3)Cl2, Rh(PPh3)4, Ni(acac)2, Rh(COD)CN·BF4, Fe(acac)3, Zn(OTf)2, Ru(PPh3)Cl, Pd2(dba)3等均未得到预期的3,只有CuBF4, Cu(OTf)2, Rh(OAc)4和CuOTf能有效地催化环丙烷化反应合成3(表2)。从表2可以看出,催效果最好的是CuOTf。
2.3 CuOTf用量对合成3的影响
以CuOTf/L3为催化体系,其余反应条件同1.2,考察CuOTf用量对合成3的影响,结果见表3。由表3可见,增加CuOTf用量并不能提高收率,过量的CuOTf反而促进重氮化合物自身的分解导致收率下降。CuOTf用量选择5 mol%较为合适。

表 3 CuOTf用量对合成3的影响*
*以CuOTf/L3为催化体系,其余反应条件同1.2;ee由HPLC测定
2.4 反应温度对合成3的影响
以CuOTf/L3为催化体系,其余反应条件同1.2,考察反应温度对合成3的影响,结果见表4。由表4可见,将反应温度由-30 ℃降至-50 ℃时,虽然收率略有减少,但ee值明显提高;进一步降低反应温度,不仅收率减少,ee值也有下降;反应温度高于-30 ℃时,收率和ee值都随之减少。综合考虑较适宜的反应温度为-50 ℃。

表 4 反应温度对合成3的影响*
*以CuOTf/L3为催化体系,其余反应条件同1.2;ee由HPLC测定
3 结论
以CuOTf(5 mol%)/L3(7 mol%)为催化体系,CH2Cl2为溶剂,色氨酸衍生物(1)与重氮乙酸乙酯(2)于-50 ℃反应36 h,首次实现了吲哚2,3-位双键的不对称催化环丙烷化反应,选择性地合成了与天然产物构型相同的四氢吡咯并吲哚啉骨架(3),收率42%, 50%ee。
本工作为具有该骨架天然产物的合成研究提供了有益借鉴。
[1] Alvarez M, Pau R S, Svetlana A S,etal. Structure, Bioactivity and Synthesis of Natural Products with Hexahydropyrro[2,3-b]indole[J].Chem Eur J,2011,17:1388-1408.
[2] Matsuura T, Overman L E, Poon D J. Catalytic asymmetric synthesis of either enantiomer of the calabar alkaloids physostigmine and physovenine[J].J Am Chem Soc 1998,120:6500-6503.
[3] Trost B M, Zhang Y. Molybdenum-catalyzed asymmetric allylation of 3-alkyloxindoles:Application to the formal total synthesis of (-)-physostigmine[J].J Am Chem Soc,2006,128:4590-4591.
[4] Depew K M, Marsden S P, Danishefsky S J,etal. Total Synthesis of 5-N-acetylardeemin and amauromine:Practical routes to potential MDR reversal agents[J].J Am Chem Soc,1999,121:11953-11963.
[5] Huang A, Kodanko J J, Overman L E. Asymmetric synthesis of pyrrolidinoindolines.Application for the practical total synthesis of (-)-phenserine[J].J Am Chem Soc,2004,126:14043-14053.
[6] Bhat B, Harrison D M. The synthesis of (-)-dihydroaszonalenin from L-tryptophan;the relative and absolute configuration of aszonalenin[J].Tetrahedron,1993,49:10655-10662.
[7] Kawasaki T, Ogawa A, Takashima Y,etal. Enantioselective total synthesis of (-)-pseudophrynaminol through tandem olefination,isomerization and asymmetric Claisen rearrangement[J].Tetrahedron,2003,44:1591- 1593.
[8] 郑海林,王颖,蔡卓,等. 环丙烷/Cope 重排反应的研究进展[J].合成化学,1996,4:358-365.
[9] Song H, Yang J, Qin Y. Org synthesis of chiral 3-substituted hexahydropyrroloindoline via intermolecular cyclopropanation[J].Org Lett,2006,8:6011-6014.

