高温变性豆粕酶改性过程中蛋白质结构的变化*
任为聪,程建军,张智宇,赵伟华,江连洲,2
1(东北农业大学食品学院,黑龙江哈尔滨,150030)2(国家大豆工程技术研究中心,黑龙江哈尔滨,150030)
高温变性豆粕酶改性过程中蛋白质结构的变化*
任为聪1,程建军1,张智宇1,赵伟华1,江连洲1,2
1(东北农业大学食品学院,黑龙江哈尔滨,150030)2(国家大豆工程技术研究中心,黑龙江哈尔滨,150030)
研究了高温变性豆粕(HDDSF)酶改性过程中蛋白质的结构变化,分析了高温变性豆粕蛋白质溶解性提高与结构的关系。在不同水解度(DH)下,检测酶改性处理前后的可溶性蛋白质的的表面巯基(SSH)、自由巯基(FSH)、总巯基(TSH)、二硫键(-S-S-)和表面疏水性(H0),通过SDS-PAGE图谱分析蛋白亚基变化。随着DH的提高,高温变性豆粕蛋白质溶解性增加,自由巯基和表面疏水性下降,总巯基和二硫键先上升后下降。经酶改性后蛋白质溶解性明显提高,酶解促使高温变性豆粕的不溶性蛋白质生成了以二硫键为主要化学键连接的可溶性聚合物,在酶继续作用下,生成的聚合物被最终酶解。
高温变性豆粕,酶改性,二硫键,表面疏水性
高温变性豆粕是大豆炼油后的副产物,炼油工艺中高温脱溶步骤会造成蛋白质的热变性,导致溶解性较差。蛋白质许多重要的功能特性依赖于蛋白质的溶解性得以体现[1]。通过酶法改性可以提高蛋白质的溶解性。对酶改性过程中蛋白质结构变化进行分析比较,有助于了解此过程中的反应机理,具有一定的理论指导意义。酶解技术已广泛应用于食品加工领域,Jens[2]依据 Linderstrom-Lang 的理论提出了酶解蛋白质的模型,并指出在此过程中蛋白质的溶解性受到蛋白质变性程度和酶的影响。此后国内外研究者利用植物性蛋白酶[3-4]、动物性蛋白酶[5-8]和微生物蛋白酶[9-11]改性不同来源的蛋白质,以提高蛋白质的溶解性。酶改性起始阶段由于加热导致蛋白质产生聚合物[5],随着反应的进行,聚合物消失,蛋白质可电离氨基酸和羧基基团大量暴露,增强了与水的结合作用[4,6]。巯基和二硫键作为维持蛋白质高级结构重要的组成部分[12],一直是检测蛋白质结构变化的一种方法。Hsu和 Wang[13-14]通过对高压处理后的罗非鱼和大豆分离蛋白的巯基进行检测,发现含量明显减少,证明蛋白质结构变的松散。对热处理[15]等其他处理后的蛋白质结构变化,同样可以通过对巯基的检测进行分析。Groleau[16]通过对酶解后的乳蛋白聚合物进行分析发现,二硫键是形成聚合物的主要因素。Wagner[17]认为,蛋白质的溶解性受到多种因素影响,可通过检测表面疏水性来完成。酶解产物的浊度能反映出在其溶液中的聚集程度,Doucet[18]发现经Alcalase蛋白酶酶解后的乳清蛋白,随酶解时间的延长,酶解产物在pH 3.0~5.0范围内的浊度减小,聚集物减少。考虑到酶解是一个复杂的反应过程,因此结合前人的研究结论和方法,对酶解过程中蛋白质结构的变化进行详细的分析。将酶解技术引入到改性高温变性豆粕中,通过酶解过程中蛋白质结构中巯基和二硫键的检测,试讨论酶改性提高高温变性豆粕溶解性的机理性问题。
1 材料与方法
1.1 试验材料
高温变性豆粕:黑龙江省双鸭山市杨霖油脂厂。
1.2 试验仪器及试剂
HYP-2型消化炉,上海纤检仪器有限公司;恒温水浴锅,余姚市东方电工仪器厂;电动搅拌桨,金坛市中大仪器厂;飞鸽TDL-40B离心机,上海安亭科学仪器厂;PHS-3C酸度计,上海雷磁仪器厂;TDW马弗炉,温州市双屿仪器厂;722型可见分光光度计,上海光谱仪器有限公司;4500型荧光分光光度计,日本日立公司;B-290型喷雾干燥机,瑞士Buchi公司。
Alaclase蛋白酶(实测酶活力198 638.3 U/mL),丹麦Novo公司;Tris、SDS、丙烯酰胺、甲叉双丙烯酰胺、尿素、1-苯胺基-8-萘磺酸(ANS),Sigma 公司;甘氨酸、β-巯基乙醇、5,5'-二巯基二硝基苯甲酸(DTNB)、EDTA,Amresco公司;14.4~97.4 ku蛋白Marker,中国科学院上海生物化学研究所;3,5-二硝基水杨酸(DNS),为国产化学纯;其他试剂均为国产分析纯。
1.3 试验方法
1.3.1 高温变性豆粕成分及可溶性蛋白质测定方法
蛋白质溶解性=上清液蛋白质含量/样品总蛋白含量;蛋白质含量测定(GB 5009.5-2003);粗脂肪测定(GB 5009.6-2003);灰分测定(GB 5009.4-2003);水分测定(GB 5009.6-2003);粗纤维测定(GB 5009.10 -2003);总糖含量测定参考文献[19];酶活力测定:按照福林-酚法(SB/T 10317-1999);DH测定:pH-stat方法参照文献[20]。
1.3.2 碱性蛋白酶改性过程
粉碎过80目筛的原料→加水调节适当浓度→调节适当pH值→加碱性蛋白酶→用2 mol/L的NaOH调pH值进行水解→酶解液→沸水浴灭酶活10 min→离心分离(5 000 g,10 min)→测定上清液蛋白质含量→上清液喷雾干燥。
1.3.3 电泳检测
参照 Laemmli[21]提出的方法,具体方法如下:选取12%分离胶和5%的浓缩胶进行还原和非还原电泳(上样缓冲液中不添加β-巯基乙醇)。电泳前样品沸水浴处理5 min,吸取10 μL样品上样,选取Marker范围为14.4~97.4 ku。起始电压70 V,待样品进入分离胶,调整电压为120 V。染色剂为2.5 g/L考马斯亮蓝R-250(甲醇∶水∶冰乙酸体积比为23∶23∶4)的混合溶液,脱色剂为(甲醇∶水∶冰乙酸体积比为9∶9∶2)混合溶液。
1.3.4 表面巯基与自由巯基含量的测定
表面巯基与自由巯基含量的测定依据Ellman[22]提出的理论,参照Tang[23]的方法进行测定的,具体方法如下:取不同DH的喷雾干燥样品溶于4 mL Tris-甘氨酸缓冲溶液中(Tris 0.086 mmol/L,甘氨酸0.09 mol/L,EDTA 4 mmol/L,pH8.0),样品浓度达到 5 mg/mL,再加入50 μL Ellman显色剂(4 mg DTNB 溶于1 mL的缓冲溶液中),在室温下(25℃)反应1 h,反应结束后在13600 g条件下高速离心10 min,在412 nm下测定吸光值,不添加样品的溶液作为空白。测定自由巯基含量时,在Tris-甘氨酸缓冲溶液中再加入8 mol/L的尿素和5 g/L的SDS,测定方法如同表面巯基。巯基含量依据Beveridge[24]提出的公式进行计算。
1.3.5 总巯基和二硫键的测定
测定 ss键的方法依据 Tannhauser[25]提出的理论,参照Tang[23]的方法进行测定。NTSB溶液合成方法:DTNB(0.1 g)溶于1 mol/L Na2SO3中,调节pH为7.5。加入50 μL 0.1 mol/L的硫酸铜铵溶液,在38℃水浴下搅拌直至溶液颜色成浅黄色,20℃贮藏。NTSB与二硫键反应生成的NTB在412nm下可测其吸光值。NTSB溶液与pH 9.5的0.2 mol/L tris缓冲溶液(Tris 0.2 mol/L甘氨酸 0.09 mol/L,EDTA,10 mmol/L,尿素 8 mol/L,SDS 5 g/L 和 Na2SO30.1 mol/L)以1∶100的比例混合,备用。将不同DH的喷雾干燥样品溶于0.2mol/L tris缓冲溶液中,浓度为25 mg/mL。取0.1 mL样品溶液与3 mL的NTSB混合缓冲液相混合,室温下(25℃)反应25 min,在412 nm下测其吸光值,二硫键含量=(总巯基-自由巯基)/2。
1.3.6 表面疏水性测定
参照Wagner[17]的方法利用 ANS作为荧光探针测定不同DH样品的表面疏水性H0,具体方法如下:样品溶于0.01 mol/L的磷酸缓冲溶液(pH 7.0)中,制成0.0125% ~0.1%(w/v)的溶液。25 μL的ANS溶液(溶于相同缓冲溶液制成8.0 mmol/L的溶液)添加到5 mL的样品溶液中,避光反应15 min。在360 nm(激发波长),490 nm(发射波长)的条件下进行测定样品荧光强度。以样品浓度和荧光强度作图,斜率即为表面疏水性H0。
1.3.7 浊度分析
依据 Groleau[16]的方法。选取 pH3.0~10.0的不同缓冲溶液(0.1 mol/L的柠檬酸溶液与0.2 mol/L的Na2HPO4溶液配制pH 3.0,4.0,5.0的缓冲液;0.2 mol/L的Na2HPO4溶液与0.2 mol/L的NaH2PO4溶液配制 pH 6.0,7.0,8.0的缓冲液;0.1 mol/L的Na2CO3溶液与0.1 mol/L的NaHCO3溶液配制pH 9.0,10.0的缓冲液)将不同DH样品配制成1%的溶液,室温下(25℃)下平衡1 h后,在500 nm条件下测定吸光值。
1.4 数据处理及分析
采用Microsoft Excel 2003进行数据处理;采用SPSS 13.0进行相关分析;采用origin 8.0进行作图处理。
2 结果
2.1 高温变性豆粕部分指标测定
由表1可知,高温变性豆粕的蛋白质含量(干基)可达到49%左右,蛋白质资源丰富,但其可溶性蛋白质含量仅占蛋白质总量的21%左右,由于热变性的原因,蛋白质高级结构变化,肽链松散,大部分疏水基团大量暴露在蛋白质肽链外部,这是导致蛋白质溶解性下降的根本原因[1]。

表1 原料主要成分指标分析结果
2.2 不同DH对高温变性豆粕溶解性的影响
由图1可知,随着酶解的开始,与原料溶解性相比,在DH1%时高温变性豆粕的溶解性急剧上升,溶解性从21.24%提高到72.65%,提高了51.41%,随后溶解性缓慢地提高;当DH达到12%时,溶解性达到88.33%,随后变化不再显著(P<0.05),与原料相比溶解性提高了67.09%。酶解过程中,高度变性的高温变性豆粕蛋白质在酶的作用下,被酶解成较长肽链溶于水中,随着肽链继续被酶解,长肽链被进一步酶解为分子量更小的短肽[6],因此,通过控制DH值可以达到控制高温变性豆粕的溶解性。

图1 DH对高温变性豆粕溶解性的影响
2.3 不同DH的高温变性豆粕可溶性蛋白质SDSPAGE电泳分析
利用SDS-PAGE电泳对酶解过程中蛋白质的结构变化进行进一步的分析。由图2(a)还原型电泳图谱可知,β-半球蛋白的 α和 α'亚基首先被酶解,DH为1%时便被酶解消失,在分子量为20.1~31.0 ku之间形成新条带;β-半球蛋白的β亚基和球蛋白的A亚基条带在图谱上随DH的提高而减弱,当DH为10%时条带在图谱上消失;球蛋白的B亚基条带也呈减弱趋势,但在DH为14%时,仍可见部分未酶解的B亚基条带。
由于非还原电泳样品缓冲液中不含有β-巯基乙醇,因此蛋白质的共价键未被破坏,见图2(b)。随酶解的进行,在43.0~66.2 ku形成了新条带,此条带为通过二硫键连接的AB亚基聚合物[26-27],在DH为10%时被酶解消失。其他亚基条带随DH的提高均呈现减弱趋势,形成了分子量更小的肽而聚集在谱图的最下端。
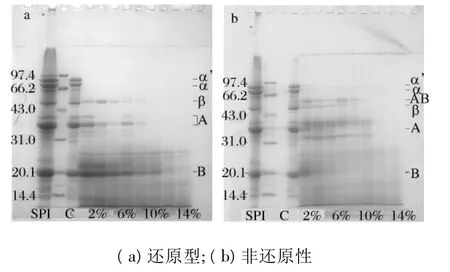
图2 不同DH的高温变性豆粕可溶性蛋白质还原型(a)与非还原型(b)SDS-PAGE电泳分析
2.4 不同DH对高温变性豆粕可溶性蛋白质巯基与二硫键的影响
由图3可知,随着DH的提高,表面巯基(SSH)先由对照样的3.70 μmol/g下降到8%时的1.99 μmol/g随后再次上升到2.39 μmol/g,而自由巯基(FSH)一直呈现下降的趋势,从5.92 μmol/g下降到DH为 6%时的 4.04 μmol/g,并趋于平缓(P<0.05)。总巯基(TSH)和二硫键(-S-S-)随着酶解的开始,在DH为1%时急剧上升,分别从15.79 μmol/g 和 6.71 μmol/g 上 升到 25.29 μmol/g 和20.67 μmol/g,随后随DH的提高而下降,最终下降到 13.91 μmol/g 和 9.81 μmol/g,证明先形成了依靠二硫键连接的蛋白质结构,随后逐渐被破坏。巯基和二硫键的变化,可以反映蛋白质在此酶解过程中的结构变化,随着酶解的进行,形成巯基和二硫键的半胱氨酸残基被酶破坏,使得在整体呈现下降趋势。
2.5 不同DH对高温变性豆粕可溶性蛋白质表面疏水性的影响
由图4可知,酶解对高温变性豆粕蛋白质的表面疏水性产生影响。随着酶解的开始,与原料相比,在DH为1%时表面疏水性急剧下降,从596.6下降到341.67,证明酶解对其破坏显著,随后在DH为6%时下降到255.94并趋于平缓(P<0.05),而后在DH为14%时再次下降,这可能由于酶解使得疏水性氨基酸残基含量减少并达到短时的平衡,随DH的再次提高,破坏了这种平衡,使得疏水性氨基酸残基的含量再次下降。

图3 不同DH对高温变性豆粕巯基与二硫键的影响

图4 不同DH对高温变性豆粕表面疏水性的影响
2.6 pH值对高温变性豆粕各水解产物浊度的影响
由图5可知,随DH的提高,样品在各pH值条件下浊度的吸光度均下降。所有样品在pH值3.0~5.0时的浊度,高于pH值6.0~10.0时的浊度,对照样与DH为1%、2%、4%、6%的样品在pH值4.0时浊度到达最高,随后下降,而浊度为8%、10%、12%和14%的样品随pH值上升,浊度一直下降;当pH值6.0后,所有样品浊度下降均趋于平缓(P<0.05)。由于大豆蛋白质的等电点在4.5左右,在此pH区间蛋白质发生聚集,浊度较大,随DH的提高,酶对蛋白质结构破坏加深,使得酶解产物在大豆蛋白等电点附近的浊度下降。

图5 不同pH对各水解产物浊度的影响
3 讨论
不同DH的高温变性豆粕酶解产物在蛋白结构上有明显的差异,因此直接影响其溶解性。在酶解的开始阶段,β-半球蛋白的各亚基最先被破坏(见图2),表面巯基、自由巯基的下降,总巯基的上升,说明外部巯基没有转移至内部,而是蛋白质之间的表面巯基转化为二硫键,使蛋白质相互结合,形成可溶性聚集物(见图2b)。Groleau[16]认为,乳蛋白的酶解物通过非共价键(疏水作用力)和共价键(二硫键)共同作用形成了聚合物,但聚合物的形成受到离子强度、pH和温度等多方面因素的共同影响。Doucet[18]则认为酶解形成聚合物的反应与类蛋白反应十分相似,二硫键不是形成聚合物的重要因素,疏水作用力、氢键和静电相互作用是形成重要因素。
每个大豆球蛋白中存在6对由A和B亚基通过二硫键相互连接形成的亚基对[28],因此天然大豆蛋白的二硫键主要集中在大豆球蛋白中。随着酶解的继续进行,大豆球蛋白A、B两亚基(见图2a)和AB聚合物(见图2b)开始被酶解,自由巯基、总巯基和二硫键下降(见图3),说明在酶的作用下,形成巯基和二硫键的半胱氨酸残基被酶破坏,当聚合物和A、B两亚基结构破坏,内部的半胱氨酸残基被暴露在外部,造成表面巯基的再次上升。不同DH的高温豆粕酶解产物在大豆蛋白等电点附近浊度的下降,进一步说明了酶解产物结构的变化,它们之间的相互作用在酶的作用下在减弱。
本研究中,表面疏水性一直呈现下降趋势,形成的聚合物表面疏水性氨基酸残基较少,说明整个过程中疏水性氨基酸残基一直被破坏,蛋白质分子量变小(见图2)。这与 Guan[6]的结论一致,Guan认为破坏致密的蛋白质结构,蛋白质分子量的减少,以及带电荷的亲水基团的大量暴露,疏水基团的减少是酶解提高蛋白质溶解性的重要过程。其他研究者同样认为亲水基团的大量暴露是酶解提高蛋白质溶解性的原因[3,5]。
4 结论
(1)随DH的提高,酶改性后的高温变性豆粕蛋白质溶解性明显提高。
(2)酶解过程中,高温变性豆粕的表面疏水性不断下降;浊度随pH的上升呈下降趋势;不溶性蛋白质形成了以二硫键为主要化学键连接的可溶性聚合物;随着酶解的进一步进行,可溶性聚合物结构被酶破坏,蛋白质分子量减小,二硫键含量下降。
[1] 赵新淮,徐红华,姜毓君.食品蛋白质—结构、性质与功能[M].北京:科学出版社,2009.
[2] Jens A N.Enzymatic Hydrolysis of Proteins for Increased Solubility[J].Journal of Agricultural and Food Chemistry,1976,24(6):1090-1093.
[3] Tsumuraa K,Saitoa T,Tsuge K,et al.Functional properties of soy protein hydrolysates obtained by selective proteolysis[J].LWT - Food Science and Technology,2005,38:255-261.
[4] Lamsal B P,Jung S,Johnson L A.Rheological properties of soy protein hydrolysates obtained from limited enzymatic hydrolysis[J].LWT-Food Science and Technology,2007,40:1 215-1 223.
[5] Yin S W,Tang C H,Cao J S,et al.Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp(Cannabis sativa L.)protein isolate[J].Food Chemistry,2008,106:1 004-1 013.
[6] Guan X,Yao H Y,Chen Z X,et al.Some functional properties of oat bran protein concentrate modified by trypsin[J].Food Chemistry,2007,101:163 -170.
[7] Kim S Y,Park P S W,Rhee K C.Funetional properties of proteolytic emzyme modified soy protein isolate[J].Journal of Agricultural and Food Chemistry,1990,38:651-656.
[8] Arcan I,Yemenicioglu A.Effects of controlled pepsin hydrolysis on antioxidant potential and fractional changes of chickpea proteins[J].Food Research International,2010,43:140-147.
[9] Lee J Y,Lee H D,Lee C H.Characteriztion of hydrolysates produced by mild-acid treatment and enzymatic hydrolysis of defatted soybean flour[J].Food Research Intemational,2001,34:217 -222.
[10] Aspmo S I,Horn S J,Eijsink V G H.Enzymatic hydrolysis of Atlantic cod(Gadus morhua L.)viscera[J].Process Biochemistry,2005,40:1 957-1 966.
[11] Walsh D J,Cleary D,MeCarthy E.Modifieation of the nitrogen solubility properties of soy protein isolate following proteolysis and transglutalninase cross - linking[J].Food Research International,2003,36:677 -683.
[12] Theodore W T,Yasuo K,Harold A S.Analysis for Disulfide Bonds in Peptides and proteins[J].Methods in Enzymology,1987,143:115-119.
[13] Hsu K C,Hwang J H,Yu C C.Changes in conformation and in sulfhydryl groups of actomyosin of tilapia(Orechromis niloticus)on hydrostatic pressure treatment[J].Food Chemistry,2007,103:560-564.
[14] Wang X S,Tang C H,Li B S,et al.Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J].Food Hydrocolloids,2008,22:560-567.
[15] Ko W C,Yu C C,Hsu K C.Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J].LWT-Food Science and Technology,2007,40:1 316-1 320.
[16] Groleau P E,Morin P,Gauthier S F,et al.Effect of physicochemical conditions on peptide-peptide interactions in a tryptic hydrolysate of β-lactoglobulin and identification of aggregating peptides[J].Journal of Agricultural and Food Chemistry,2003,51:4 370-4 375.
[17] Wagner J R,Sorgentini D A,Anon M C.Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratory-prepares soy protein isolates[J].Journal of Agricultural and Food Chemistry,2000,48:3 159-3 165.
[18] Doucet D,Gauthier S F,Otter D E,et al.Enzyme-induced gelation of extensively hydrolyzed whey proteins by Alcalase:Comparison with the plastein reaction and characterization of interactions[J].Journal of Agricultural and Food Chemistry,2003,51,6 036-6 042.
[19] 孙伟伟,曹维强,王静.DNS法测定玉米秸秆中总糖[J].食品研究与开发,2006,26(6):120-123.
[20] Spellman D,McEvoy E,O'Cuinn G,et al.Proteinase and exopeptidase hydrolysis of whey protein:Comparison of the TNBS,OPA and pH stat methods for quantification of degree of hydrolysis[J].International Dairy Journal,2003,13:447-453.
[21] Laem mLi.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[22] Ellman G L.Tissue sulfhydryl groups[J].Archives of Biochemistry and Biophysics,1959,82(1):70-77.
[23] Tang C H.Thermal denaturation and gelation of vicilinrich protein isolates from three Phaseolus legumes:A comparative study[J].LWT-Food Science and Technology,2008,41:1 380- 1 388.
[24] Beveridge T,Toma S J,Nakai S.Determination of SH and SS groups in some food proteins using Ellman's reagent[J].Journal of Food Science,1974,39:49 –51.
[25] Theodore W T,Yasuo K,Harold A S.Sensitive quantitative analysis of disulfide bonds in polypeptides and proteins[J].Analytical Biochemistry,1984,138:181 -188.
[26] Arrese E L,Sorgentini D A,Wagner J R,Anon M C.Electrophoretic,solubility,and functional properties of commercial soy protein isolartes[J].Journal of Agricultural and Food Chemistry,1991,39:1 029-1 032.
[27] Petruccelli S,Anon M C.Thermal aggregation of soy protein isolates[J].Journal of Agricultural and Food Chemistry,1995,43:3 035-3 041.
[28] 田琨,管娟,邵正中,等.大豆分离蛋白结构与性能.化学进展,2008,20(4):566-573.
Effect of Enzymic Modification Treatment on Structural Characteristics of Commercial Highly Denatured Defatted Soy Flakes
Ren Wei-cong1,Cheng Jian-jun1,Zhang Zhi-yu1,Zhao Wei-hua1,Jiang Lian-zhou1,2
1(College of Food Science,Northeast Agricultural University,Harbin 150030,China)2(National Soybean Engineering and Technique Research Center,Harbin 150030,China)
The effects of enzymatic modification(EM)treatment on structural characteristics of highly denatured defatted commercial soy flakes(HDDSF)were investigated in order to analyze the relationship between its solubility and structure.Protein solubility,surface hydrophobicity(Ho),surface sulfhydryl(SSH)content,free sulfhydryl(FSH)content,total sulfhydryl(TSH)content and disulfide bond(-S-S-)content were evaluated.Protein subunits profiles for the hydrolysate were altered by the EM treatment and major changes were observed for the hydrolysate.With DH increasing,the solubility of HDDSF was increased significantly.The SSH content,FSH content and the TSH content were showed different changes,above all the -S-S- content of HDDSF was significantly increased after EM treatment at DH1%,but was gradually decreased with further increase in DH.Analysis showed that the soluble aggregates were formed during EM treatment.Covalent interactions(i.e.disulfide bonds)was involved in the formation of soluble aggregates.The formation of soluble aggregates significantly improved the solubility of HDDSF,and the soluble aggregates were hydrolyzed by Alaclase thereafter.
highly denatured defatted soy flakes,enzymic modification treatment,disulfide bond content,surface hydrophobicity(Ho)
硕士研究生(程建军副教授为通讯作者)。
*黑龙江省科技计划项目任务书(GB08B401-02)
2010-12-28,改回日期:2011-02-10

