D-对羟基苯甘氨酸生物合成研究进展
王燕妮
D-对羟基苯甘氨酸生物合成研究进展
王燕妮
D-对羟基苯甘氨酸是β-内酰胺类半合成抗生素药物中间体,广泛应用在医药领域。传统的D-对羟基苯甘氨酸的合成主要是化学合成和生物酶催化法。研究人员在天蓝色链霉菌中发现羟基扁桃氧化酶基因(hmo)、羟基扁桃酸合酶基因(hmas)和对羟基苯甘氨酸转移酶基因(hpgt)的基因簇。人们将来自不同菌种的hmo,hmas,hpgt基因整合到大肠杆菌中,实现了D-对羟基苯甘氨酸的生物全合成。
D-对羟基苯甘氨酸;生物全合成;基因改造;构型反转
1 前言
D-对羟基苯甘氨酸(D-4-hydroxyphenylglycine),即D-HPG,是一种白色片状固体, 微溶于水和甲醇,易溶于酸或碱溶液生成盐。随着科学技术的深入发展,D-HPG作为一种重要的化学、化工、医药等中间体,无论在用途上还是在用量上都发生了很大变化,在国民经济中占有重要的地位,尤其在合成青霉素、头孢菌素等β-内酰胺类半合成抗生素的生产中有着重要的应用。[1]但是化学合成D-HPG的方法污染较大,会产生氰化物,而生物全合成的方法可以有效地避免氰化物污染,同时利用生物全合成可以提高原料的利用率,简化生产过程,提高转化效率,减低生产成本。所以研究D-HPG生物全合成具有重要的现实意义。
2 D-HPG传统合成方法
国内从八十年代开始着手研究,到九十年代中期开始小规模生产。生产初期主要是化学合成方法, 对羟基苯甲醛法(Strecker 氨基酸合成法):[2]
图一 Strecker 氨基酸合成法
这种方法的工艺成熟,收率较高,但由于对羟基苯甲酸的成本很高,生产过程中还有氰化物产生,毒性高,污染严重,污水处理复杂,这种方法现在已经很少使用。
相比与化学合成,生物催化法的污染较小,反应条件相对温和,而且选择性和转化效率都有一定的优势。所以人们渐渐重视生物催化法的研究,主要集中在利用D, L-对羟基苯海因( D, L-HPH ) 为原料经酶催化合成D-HPG 的方法上。首先,人们开始使用单酶法,单酶法的优点是可以使底物的利用率达到100%,但还是有使用化学方法的步骤,污染严重问题仍是单酶法的首要限制。单酶法之后,人们相继地研究出两酶两菌法,两酶一菌法等,但都存在着生物菌种筛选困难、生物酶易失活、无法大规模生产等问题。
3 D-对羟基苯甘氨酸生物全合成
3.1 D-对羟基苯甘氨酸生物全合成的可能性。
2002年,Hojati等在天蓝色链霉菌发现了羟基扁桃合酶基因(hmas)、羟基扁桃氧化酶基因(hmo)和对羟基苯甘氨酸转移酶基因(hpgt)的基因簇。[3]通过研究,发现这三个基因转录得到的酶可以将对羟基苯丙酮酸转化成L-对羟基苯甘氨酸。

图二 L-对羟基苯甘氨酸生物合成路径
通过上述途径,我们可以推断出hmas,hmo,hpgt这三个基因很可能组成了一个独立的操纵子。这是人们首次在生物体发现对羟基苯甘氨酸的合成途径,虽然构型是左旋的,与目标产物构型相反,但这也为实现其生物全合成奠定基础。在Hojati研究的基础上,越来越多的人着手对hmas,hmo,hpgt这三个基因的组合进行研究了。
3.2 羟基扁桃合酶基因(hmas)。
人们在研究生物合成万古霉素类抗生素(Vancomycin Group of Antibiotics)的途径时曾经用到过羟基扁桃酸合酶(HMAS),发现HMAS能将对羟基苯丙酮酸氧化成对羟基扁桃酸。研究发现HMAS与对羟基苯丙酮酸双加氧酶(4-HPPD)在构型和功能上有很大联系。[4]HMAS与HPPD有43%的氨基酸碱基序列是相同的,而且还有相同的底物。当对HPPD进行突变时,可以得到与HMAS相同活性的酶。
2004年,Borowski等人在对HMAS进行的研究时发现HMAS具有与4-HPPD相同的铁离子结合位点,[5]所以应用4-HPPD的催化循环反应模式对HMAS进行苯羟基化活性的实验,结果显示,靠近铁结合位点的单个氨基酸突变点是会影响4-HPPD产物特异性的,因为HMAS就是由4-HPPD点突变得到的。
3.3 羟基扁桃氧化酶基因(hmo)。
1976年,Santhoor等人在研究凸形假单胞菌(Pseudomonasconvexa)时发现,[6]在扁桃酸代谢途径上与其他微生物不同。在凸形假单胞菌中,芳香族扁桃酸在氧化降解的第一步是在对位上进行羟基化,得到对羟基扁桃酸,对羟基扁桃酸又经氧化最终得到对羟基苯甲醛。进而发现了L-对羟基扁桃酸氧化酶(L-4-Hydroxymandelate Oxidase)。
Santhoor等人还将L-4-HMO从凸形假单胞菌中提纯增溶,并对其反应的最优条件进行测定:在pH是6.6,温度为55℃时,L-4-HMO活性最大。
L-4-HMO在催化作用时需要消耗FAD,如果用FMN代替FAD,L-4-HMO只能发挥75%的活性。阿的平(对黄素依赖酶有特异性抑制作用)对上述反应有强烈抑制作用。在反应中,L-4-HMO需要二价锰离子增加酶活性。锰离子在很多反应中都有提高酶活性的作用,大部分这样的反应对阳离子的选择都是没有特异性的,锰离子可以被其他的二价金属离子取代。但是在L-4-HMO的反应中,没有任何金属离子可以代替二价锰离子。
3.4 对羟基苯甘氨酸转移酶基因(hpgt)。
氨基酸在经过氨基转移酶的作用之后得出的产物是具有立体构型保留性的,即左旋氨基酸转氨基作用后还是左旋的。这种氨基转移酶在植物和细菌中广泛存在着。对于左旋与右旋氨基酸之间的相互转化研究甚少。但是人们在施氏假单胞菌中发现对羟基苯甘氨酸转移酶(4-Hydroxyphenylglycine aminotransferase),[7]它可以完成L-谷氨酸到D-苯甘氨酸或D-对羟基苯甘氨酸的转化。
从施氏假单胞菌中提纯的HPGT与普通的转氨酶一样,在典型吡哆醛依赖酶抑制剂的环境下被抑制,在碱性环境中活性增强。它跟普通转氨酶也有不同之处:左旋转氨酶以左旋氨基酸为底物,产物为左旋氨基酸,右旋转氨酶以右旋氨基酸为底物,产物为右旋氨基酸;而HPGT只将L-谷氨酸作为氨基供体,将苯乙醛酸或对羟基苯乙醛酸作为氨基受体,最后得到D-苯甘氨酸或D-对羟基苯甘氨酸。在逆反应中,HPGT只将D-苯甘氨酸或D-对羟基苯甘氨酸作为氨基供体,将α-酮戊二酸作为氨基受体,最后得到L-谷氨酸。这就是HPGT的特别之处,只有这三种底物。
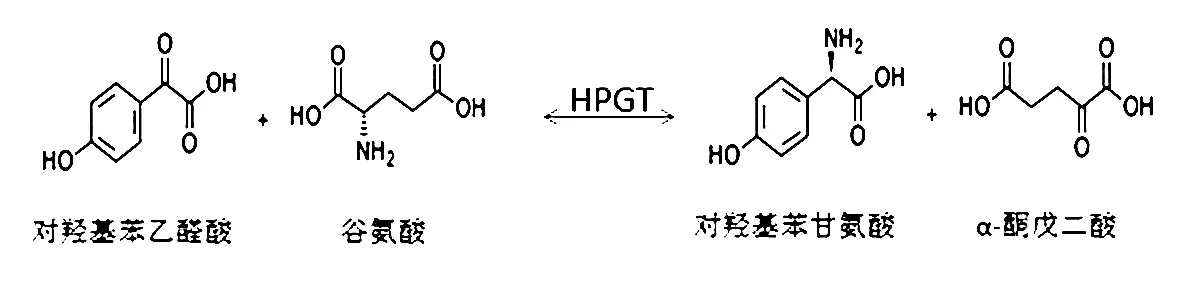
图三 HPGT的催化路径
HPGT在反应过程中会受到酸碱度和温度的影响,有研究表明:[8]pH小于6时,酶活性很低,随着碱性增强,酶活性越来越好,在pH为9-10之间,活性达到最大,当pH大于10.5时,酶活性迅速下降,pH大于12时,酶失活;温度在35到50之间,酶都具有较高的活性,温度过高会导致酶失活,如果将其0度冷冻2个月,并不会对活性有太大的影响。
3.5 在大肠杆菌中实现D-对羟基苯甘氨酸生物合成。
天然的大肠杆菌是没有hmas、hmo、hpgt这三个基因的,为了在大肠杆菌中实现D-对羟基苯甘氨酸的合成,人们把hmas,hmo,hpgt这三个不属于大肠杆菌的基因整合到一个质粒上,并转到大肠里,实现了其合成。[9]这三个基因分类来自三个不同菌种:hpgt来自恶臭假单胞菌;hmo来自天蓝色链霉菌;hmas来自东方拟无枝酸菌。

图四 在大肠杆菌中构建D-HPG的生物合成路径
hmas、hmo两个基因在东方拟无枝酸菌和天蓝色链霉菌中都存在,Muller等人将两个菌种的目标片段进行PCR扩增,然后连接到阿拉伯糖诱导表达质粒上,分别导入大肠杆菌中,对其粗提物进行高效色谱分析,通过对比,天蓝色链霉菌中的HMO,东方拟无枝酸菌HMAS的活性较高,所以在构建反应的前两步的基因分别来自东方拟无枝酸菌和天蓝色链霉菌。
选定好所用的基因后,将它们一次连接到载体上,导入大肠杆菌中。把苯乙醛酸和L-谷氨酸作为底物,对大肠杆菌的粗提物进行高相色谱分析发现,L-苯甘氨酸是不存在的。同样,用对羟基苯乙醛酸做底物会得到D-对羟基苯甘氨酸。这说明改造后基因序列是可以表达的。
4 展望
D-对羟基苯甘氨酸作为重要的抗生素药物中间体在医药领域需求量与日俱增,传统的化学合成和生物酶催化方法不能有效平衡生产效率和环境污染,人们的研究方向逐渐向生物全合成转变。Muller已经成功构建了合成D-HPG的基因,并在大肠杆菌中能够表达。
生物全合成D-对羟基苯甘氨酸中用到的三个基因(hmas,hmo,hpgt)都可以在进一步的研究中进行优化。在上文中提到,HMAS和HPPD的碱基序列相似度很高,甚至可以通过突变HPPD得到与HMAS相同活性的酶。我们可以将上述途径中第一步HMAS催化过程用HPPD点突变产物来代替。同时,对比两段基因在大肠杆菌中表达情况、两个酶的活性、转化效率、需要底物浓度等,可以更好地了解HMAS和HPPD的异同,以便进一步优化生物全合成D-对羟基苯甘氨酸途径。
HPGT的发现无疑是整条生物全合成路径中最关键的一步,HPGT不仅使合成路径缩短,而且将其简单化,D-对羟基苯甘氨酸生物全合成的可能性大大增强。不过HPGT对于底物的要求较高,只有三种物质可以与其结合,这也多多少少限制一些需要构型反转的反应。对于HPGT可以尝试定点突变,尝试改变底物结合位点,扩大底物的接受能力。如果能得到底物限制较少的HPGT,在生物全合成中实现构型反转将不再是难事。
在合成D-对羟基苯甘氨酸的路径中有许多副产品。副产品比较多可能是受大肠杆菌中自身的氨基转移酶和底物的影响,研究应该尝试敲出一些无用基因或干扰基因,提高D-苯甘氨酸的纯度,这样也可以简化D-苯甘氨酸的提纯步骤,这些也同样可以应用到研究开发D-对羟基苯甘氨酸的生物全合成中。
[1] 骈岩杰,赵继全.D-对羟基苯甘氨酸合成的研究进展[J],精细石油化工,2010,27:66—71.
[2] Degner Dieter, Pander Hans Joachim, Siegel Hardo. 4-tert- Butoxyphenylglycinnitril and methods for D-(-)-and L-(+)-4-hydroxyphenylglycine [P]. DE 3002543. 1981.
[3] Zohreh Hojati, Claire Milne, Barbara Harvey, Lyndsey Gordon, Matthew Borg, Fiona Flett, Barrie Wilkinson, Philip J. Sidebottom, Brian A.M. Rudd, Martin A. Hayes, Colin P. Smith, and Jason Micklefield. Structure, Biosynthetic Origin, and Engineered Biosynthesis of Calcium-Dependent Antibiotics from Streptomyces coelicolor. Chemistry & Biology, Vol. 9, 1175-1187, November, 2002.
[4] Gunsior, M., Ravel, J., Challis, G. L., and Townsend, C. A. (2004) Engineering p-hydroxyphenylpyruvate dioxygenase to a p-hydroxymandelate synthase and evidence for the proposed benzene oxide intermediate in homogentisate formation, Biochemistry 43, 663-674
[5] Tomasz Borowski, Arianna Bassan, and Per E. M. Siegbahn.(2004) 4-Hydroxyphenylpyruvate Dioxygenase: A Hybrid Density Functional Study of the Catalytic Reaction Mechanism. Biochemistry 2004, 43, 12331-12342.
[6] Santhoor G. BHAT and Chelakara S. VAIDYANATHAN.(1976) Purification and Properties of L-4-Hydroxymandelate Oxidase from Pseudomonas convexa. Eur. J. Biochem. 68, 323-331 (1976).
[7] Beggs, J.D., Fewson, C.A., 1977. Regulation of synthesis of benzyl alcolhol dehydrogenase in Acinetobacter calcoaceticus NCIB8250. J. Gen. Microbiol. 103, 127-140.
[8] Suthep Wiyakrutta, Vithaya Meevootisom.1997. A stereo-inverting D-phenylglycine aminotransferase from Pseudomonas stutzeri ST-201: purification, characterization and application for D-phenylglycine synthesis. Journal of Biotechnology 55 (1997) 193-203
[9] Ulrike Muller,Friso van Assema, Michele Gunsior, Sonja Orf, Susanne Kremer, Dick Schipper, Anja Wagemans, Craig A. Townsend,Theo Sonke, Roel Bovenberg, Marcel Wubbolts. Metabolic engineering of the E. coli L-phenylalanine pathway for the production of D-phenylglycine (D-Phg). Metabolic Engineering 8 (2006) 196-208
ClassNo.:O625DocumentMark:A
(责任编辑:郑英玲)
ProceedingsofD-4-hydroxyphenylglycineBiosynthesis
Wang Yanni
D-4-hydroxyphenylglycine is an important medicine intermediate of β-lactam semi-synthetic antibiotics such as penicillin and cephalosporin, and is widely used in the disease treatment. The traditional methods of D-4-hydroxyphenylglycine synthesis are chemical synthesis and enzyme catalysis. Previous researches proved that there is a gene cluster that contains hydroxymandelate synthase (hmas), hydroxymandelate oxidase (hmo), and the hydroxyphenylglycine aminotransferase(hpgt) in Streptomyces coelicolor. To produce D-HPG, these three genes were combined together in E. coli strains, which resulted in the first completely fermentative production of D-HPG.
D-4-hydroxyphenylglycine; synthetic biology; genetic modification; stereo invert
王燕妮,学生,天津大学化工学院制药工程系,天津。邮政编码:300072
1672-6758(2011)11-0061-2
O625
A

