姜黄素类似物B67 诱导细胞凋亡和G2 /M 期阻滞增强对鼻咽癌辐射抗拒细胞的抑制作用*
原玉芬, 王杜娟, 潘运宝, 梁 广, 肖 健, 王苏美, 杨惠玲△
(1 中山大学中山医学院病理生理学教研室,广东 广州510080;2 温州医学院药学院,浙江 温州325085)
鼻咽癌(nasopharyngeal carcinoma,NPC)以“广东癌”著称,放疗仍是鼻咽癌的首选疗法。尽管放疗技术几经改良或与化疗联用,但由于辐射抗拒所致的放疗后局部复发和远处转移等,严重制约了NPC患者5 年生存率的提高,因此寻找逆转辐射抗拒的药物是关键。姜黄素(curcumin)是一种人工提取的天然化合物,其具有广谱抗癌作用[1,2],同时也有研究表明姜黄素可抑制癌细胞增殖和促进凋亡,特别是其可诱导某些肿瘤细胞G2/M 期停滞[3,4],推测其有助放疗增敏。但其结构不稳定且代谢速度快,大大限制其临床运用;我们采用单羰基基团替换姜黄素结构中不稳定的β-二酮基团,设计合成多种单羰基姜黄素类似物;初步实验结果表明姜黄素类似物可不同程度抑制多种肿瘤细胞[5,6],而姜黄素类似物B67 对鼻咽癌特别是鼻咽癌辐射抗拒细胞作用及其机制尚未见报道。本研究拟通过观测B67 对不同辐射抗拒鼻咽癌细胞CNE-2R 与CNE-2 作用的差异,以阐明B67 对辐射抗拒鼻咽癌细胞CNE-2R 的特异性及其逆转辐射抗拒的机制,为逆转辐射抗拒药物的开发提供实验依据。
材 料 和 方 法
1 材料
RPMI-1640 培养基为Gibco 产品。四甲基偶氮唑盐[3-(4,5-dimethylthiazo-2-yl)-2,5-diphenyl-tetrazolium bromide,MTT]、二甲基亚砜(dimethyl sulphoxide,DMSO)和罗丹明123(Rhodamine 123,Rh123)为Sigma 产品。单羰基姜黄素类似物B67 和姜黄素粉剂由温州医学院合成或提供。小牛血清购自PAA 公司。膜联蛋白(Annexin-V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒购自凯基生物科技发展有限公司。低分化鼻咽癌细胞株CNE-2 购自中山大学实验动物中心。鼻咽癌辐射抗拒细胞株CNE-2R 为本实验室构建。Sunrise 全自动酶标仪购自Tecan。IX71倒置荧光显微镜购自Olympus。流式细胞仪(BD)。BALB/c 裸鼠,5 周龄,雄性,购自北京维通利华实验动物技术有限公司。
2 方法
2.1 MTT 法测定药物对细胞活性的影响 用胰蛋白酶(2.5 g/L)消化对数生长期细胞,根据实验时间(24 h、48 h、72 h)调整细胞悬液浓度分别为1 ×108cells/L、6 ×107cells/L、4 ×107cells/L 并加入96 孔板中,每孔加细胞悬液100 μL,培养24 h,于各实验组再加相应浓度药物,实验对照组和空白组再加入培养基,以上总液体均为每孔200 μL,每组设6 个孔,重复3 次。分别孵育24、48、72 h,此后加入20 μL MTT(5 g/L)溶液,继续在5% CO2、37 ℃下孵育4 h。轻轻甩出板内液体,每孔加入150 μL DMSO,此后96 孔板避光置摇床上低速振荡10 min 并用排枪轻轻吹打均匀,使结晶物充分溶解。在酶联免疫检测仪波长490 nm 处测量各孔的吸光度(A)值。按以下公式计算肿瘤细胞活性抑制率:

2.2 集落形成实验检测细胞增殖能力 收集对数生长期细胞,调整细胞悬液浓度为1 ×105cells/L,每孔滴加2 mL,悬液接种于6 孔板,24 h 后吸去孔内残余培养基,并在相应组加入不同浓度药液或培养液。药物作用48 h 时弃上清,加全培养基2 mL/well 继续培养7 d。弃上清,甲醇固定和姬姆萨染色后显微镜下计算集落数,以≥50 个细胞作1 个集落,按下列公式计算肿瘤细胞增殖抑制率:

2.3 Hoechst 染色法观察凋亡形态学变化 调整B67 作用终浓度为5 μmol/L,对细胞作用48 h 时甲醇固定后Hoechst 33342 染色,倒置荧光显微镜下观察并拍照。
2.4 流式细胞仪测细胞凋亡率 调整B67 作用终浓度为5 μmol/L,对细胞作用48 h 时无EDTA 酶消化收集细胞,各待检标本保证细胞总数不少于106个,离心弃上清以PBS 洗2 遍,并用Annexin-V/碘化丙啶(propidium iodide,PI)(Annexin V/PI)双染色标记法进行流式细胞仪检测细胞凋亡百分率。
2.5 流式细胞仪测细胞周期分布 调整B67 作用终浓度为5 μmol/L,对细胞作用24 h 时胰酶消化收集细胞,各待检标本保证细胞总数不少于106个离心弃上清以75%乙醇固定4 ℃过夜,第2 d 离心弃上清,PBS 洗2 遍,加入终浓度为50 mg/L RNAase 及50 mg/L PI,终体积为500 μL;以流式细胞仪检测。
2.6 流式细胞仪测线粒体膜电位 调整B67 作用终浓度为5 μmol/L,对细胞作用48 h 时胰酶消化收集细胞,各待检标本保证细胞总数不少于106个离心弃上清以PBS 洗2 遍,将细胞重悬于100 μg/L Rh123 的2 mL 染液中,37 ℃避光染色30 min,结束后以流式细胞仪检测细胞线粒体膜电位。
2.7 裸鼠皮下成瘤实验 调整B67 作用终浓度为5 μmol/L,对细胞作用48 h 时胰酶消化收集细胞,各待检标本保证细胞总数不少于106个,离心弃上清,以PBS 洗2 遍,用PBS 调整对照组细胞浓度为7.5 ×109cells/L,其余组细胞以等体积PBS 制备细胞悬液。在每只裸鼠背部的左上和右下分别注射0.2 mL 细胞悬液,每组3 只裸鼠,观察裸鼠皮下成瘤情况。成瘤后定期测量肿瘤的三维空间尺度,根据公式:V(mm3)=Length×Width2/2 分别计算出各组每个肿瘤的近似体积。当裸鼠皮下肿瘤的体积约1 000 mm3(接种CNE-2 及CNE-2R 后分别生长17 d 和26 d)时处死,取出肿瘤进行检测。
3 统计学处理
采用SPSS 16.0 进行统计处理,数据以均数±标准误(±sE)表示,连续型数据的组间比较采用方差分析(One-way ANOVE),离散型数据的组间比较采用χ2检验。
结 果
1 B67 对NPC 细胞活性影响的比较
B67 作用24、48、72 h 后,NPC 细胞活性的抑制率见表1。采用IC50软件统计得到B67 作用于NPC细胞24、48、72 h 后,其IC50分别为(3.96 ±0.14)、(2.59 ±0.15)和(0.89 ±0.08)μmol/L(CNE-2R)及(8.84 ±0.57)、(3.55 ±0.04)和(1.10 ±0.01)μmol/L(CNE-2)。
表1 B67 对CNE-2 和CNE-2R 细胞活性的影响Table 1. Comparison of the viability of CNE- 2 and CNE-2R cell lines after treatment with B67(±sE.n=3)
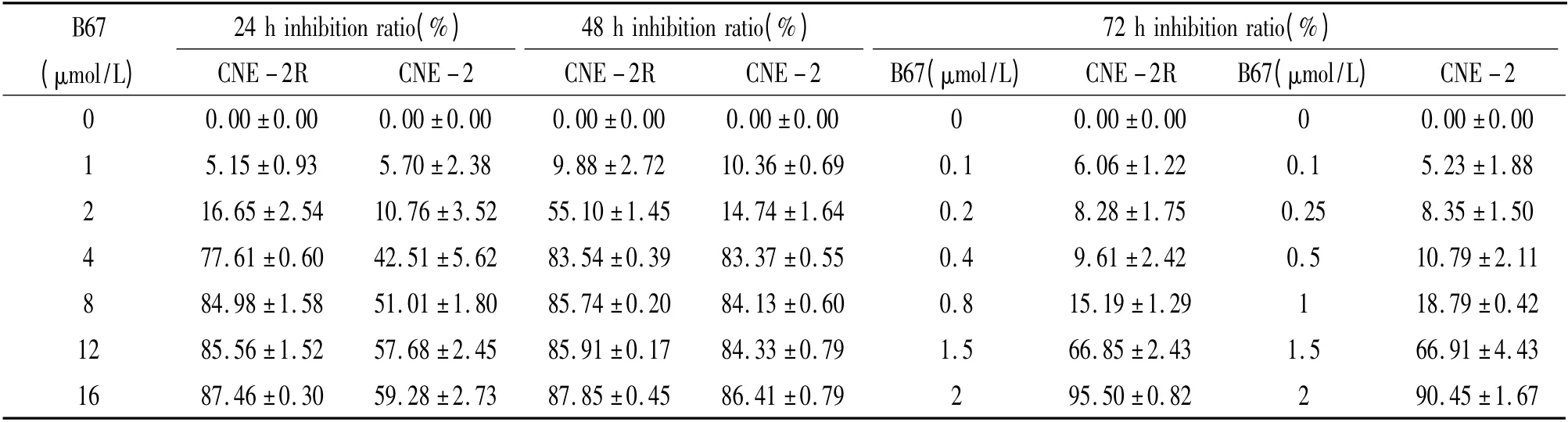
表1 B67 对CNE-2 和CNE-2R 细胞活性的影响Table 1. Comparison of the viability of CNE- 2 and CNE-2R cell lines after treatment with B67(±sE.n=3)
B67(μmol/L)24 h inhibition ratio(%)48 h inhibition ratio(%)72 h inhibition ratio(%)CNE-2R CNE-2 CNE-2R CNE-2 B67(μmol/L) CNE-2R B67(μmol/L) CNE-2 0 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0 0.00±0.00 0 0.00±0.00 1 5.15±0.93 5.70±2.38 9.88±2.72 10.36±0.69 0.1 6.06±1.22 0.1 5.23±1.88 2 16.65±2.54 10.76±3.52 55.10±1.45 14.74±1.64 0.2 8.28±1.75 0.25 8.35±1.50 4 77.61±0.60 42.51±5.62 83.54±0.39 83.37±0.55 0.4 9.61±2.42 0.5 10.79±2.11 8 84.98±1.58 51.01±1.80 85.74±0.20 84.13±0.60 0.8 15.19±1.29 1 18.79±0.42 12 85.56±1.52 57.68±2.45 85.91±0.17 84.33±0.79 1.5 66.85±2.43 1.5 66.91±4.43 16 87.46±0.30 59.28±2.73 87.85±0.45 86.41±0.79 2 95.50±0.82 2 90.45±1.67
2 B67 对NPC 细胞增殖影响的比较
B67 作用48 h 后,NPC 细胞增殖的抑制率见表2。采用IC50软件统计得到B67 作用于NPC 细胞48 h 后,其IC50分别为(0.55 ±0.00)μmol/L(CNE-2R)和(0.73±0.03)μmol/L(CNE-2)。
表2 B67 对CNE-2 和CNE-2R 细胞增殖的影响Table 2. Comparison of the proliferation of CNE- 2 and CNE-2R cell lines after treatment with B67(±sE.n=3)

表2 B67 对CNE-2 和CNE-2R 细胞增殖的影响Table 2. Comparison of the proliferation of CNE- 2 and CNE-2R cell lines after treatment with B67(±sE.n=3)
# P <0.05 vs curcumin 1μmol/L group.
B67(μmol/L)Inhibition ratio(%)CNE-2R CNE-2 Curcumin(μmol/L)Inhibition ratio(%)CNE-2R CNE-2 0 0.00 ±0.00 0.00 ±0.00 0 0.00 ±0.00 0.00 ±0.00 0.1 17.48 ±1.44# 12.33 ±0.68# 1 13.86 ±1.08 7.15 ±1.76 0.25 26.14 ±0.92 18.40 ±1.46 2.5 18.80 ±2.51 15.21 ±1.23 0.5 37.87 ±1.78 30.26 ±3.09 5 29.98 ±1.85 24.31 ±2.35 1.0 72.92 ±0.65 67.86 ±3.09 10 40.39 ±0.50 34.15 ±2.13 1.5 98.79 ±1.21 96.05 ±0.82 15 79.37 ±2.05 77.3 2 ±3.84
3 B67 对NPC 细胞凋亡形态影响的比较
Hoechst 33342 染色结果见图1,B67 作用48 h后可引起NPC 细胞凋亡,主要是细胞核形态发生改变,表现为细胞核数量显著下降,大量鼻咽癌细胞胞核体积明显减小,有些细胞核形状不规则,其中一些有染色质浓缩、边缘化和核固缩现象等。而空白对照组细胞核光滑,形态较均匀一致,未见核固缩或者核碎裂。同时采用姜黄素处理2 种细胞后所引起的形态改变与空白对照组相比,除了少量细胞核体积稍小外,无其它明显变化。上述结果提示B67 可使CNE-2R 和CNE-2 细胞出现凋亡的形态改变。

Figure 1. Comparison of the morphology of CNE- 2 and CNE-2R cell lines after treatment with B67(Hoechst 33342 staining,×100).图1 B67 对CNE-2 和CNE-2R 细胞形态的影响
4 B67 对NPC 细胞周期影响的比较
流式细胞仪检测结果见表3,与CNE-2 相比,5 μmol/L B67 作用48 h 时较特异地诱导CNE-2R细胞G2/M 期阻滞。
表3 B67 对CNE-2 和CNE-2R 细胞周期影响的比较Table 3. Comparison of the cell cycle of CNE- 2 and CNE-2R cell lines after treatment with B67(5 μmol/L)or curcumin(5 μmol/L)(±sE.n=3)

表3 B67 对CNE-2 和CNE-2R 细胞周期影响的比较Table 3. Comparison of the cell cycle of CNE- 2 and CNE-2R cell lines after treatment with B67(5 μmol/L)or curcumin(5 μmol/L)(±sE.n=3)
* P <0.05 vs control group;#P <0.05 vs curcumin group;△P <0.05 vs CNE-2 group.
Group G0/G1(%)S(%)G2/M(%)CNE-2R CNE-2 CNE-2R CNE-2 CNE-2R CNE-2 Control 42.66 ±1.54△ 53.47 ±0.52 52.02 ±1.44△37.47 ±0.59 5.32 ±0.50 9.07 ±0.55 Curcumin 39.10 ±6.70△ 51.33 ±0.33 49.54 ±6.72 39.50 ±0.46 11.35 ±0.02 9.17 ±0.72 B67 24.90 ±0.73*△ 57.57 ±0.97* # 35.09 ±3.53* # 26.71 ±0.95* # 40.01 ±4.25*△ 15.73 ±1.04*#
5 B67 对NPC 细胞凋亡影响的比较
流式细胞仪检测结果见表4,5 μmol/L B67 作用48 h 可诱导CNE-2R 和CNE-2 细胞凋亡,但2种细胞间差异不显著;同等条件下姜黄素则未能诱导2 种细胞的凋亡。
表4 B67 对CNE-2 和CNE-2R 细胞凋亡影响的比较Table 4. Comparison of the apoptosis of CNE- 2 and CNE-2R cell lines after treatment with B67(5 μmol/L)or curcumin(5 μmol/L)(±sE.n=3)

表4 B67 对CNE-2 和CNE-2R 细胞凋亡影响的比较Table 4. Comparison of the apoptosis of CNE- 2 and CNE-2R cell lines after treatment with B67(5 μmol/L)or curcumin(5 μmol/L)(±sE.n=3)
* P <0.05 vs control group;# P <0.05 vs curcumin group.
Group Viable(%)Apoptosis(%)CNE-2R CNE-2 CNE-2R CNE-2 Control 92.06±0.40 90.92±1.18 5.49±1.00 4.9 9±0.46 Curcumin 88.53±1.35 91.63±1.02 5.95±0.64 4.76±0.53 B67 52.94±3.96* # 45.53±1.46* # 38.06±1.25* # 35.74±1.39*#
6 B67 对NPC 细胞线粒体膜电位影响的比较
流式细胞仪检测结果见表5,5 μmol/L B67 作用48 h 可使CNE-2R 和CNE-2 细胞线粒体膜电位显著下降,其下降率分别为66.76%和72.09%,P<0.05,2 种细胞间差异不显著;其作用明显优于等浓度姜黄素。
表5 B67 对CNE-2 和CNE-2R 细胞线粒体膜电位影响的比较Table 5. Comparison of the change of mitochondrial membrane potential of CNE- 2 and CNE-2R cell lines after treatment with B67(5 μmol/L)or curcumin(5 μmol/L)(±sE.n=3)

表5 B67 对CNE-2 和CNE-2R 细胞线粒体膜电位影响的比较Table 5. Comparison of the change of mitochondrial membrane potential of CNE- 2 and CNE-2R cell lines after treatment with B67(5 μmol/L)or curcumin(5 μmol/L)(±sE.n=3)
* P <0.05 vs control group;# P <0.05 vs curcumin group;△P <0.05 vs CNE-2 group.
Group CNE-2R CNE-2 Control 0.00 ±0.00 0.00 ±0.00 Curcumin 16.08 ±1.22*△ 31.50 ±1.90*B67 66.76 ±10.88* # 72.09 ±1.20*#
7 姜黄素类似物B67 作用于NPC 细胞后成瘤性的比较
在接种细胞17 d 后,空白对照组和10 μmol/L姜黄素组均长出肿瘤;5 μmol/L B67 作用于CNE-2组亦长出肿瘤,但CNE-2R 组未长出肿瘤;而10 μmol/L B67 组均未长出肿瘤,见表6。未成瘤组继续观察9 d 后仍未出现肿瘤。这提示B67 作用明显优于等浓度姜黄素,且对CNE-2R 作用更强。
表6 B67 对CNE-2 和CNE-2R 细胞成瘤性作用的比较Table 6. Comparison of tumor volume of CNE- 2 and CNE-2R cell lines after treatment with B67 or curcumin (±sE.n=3)
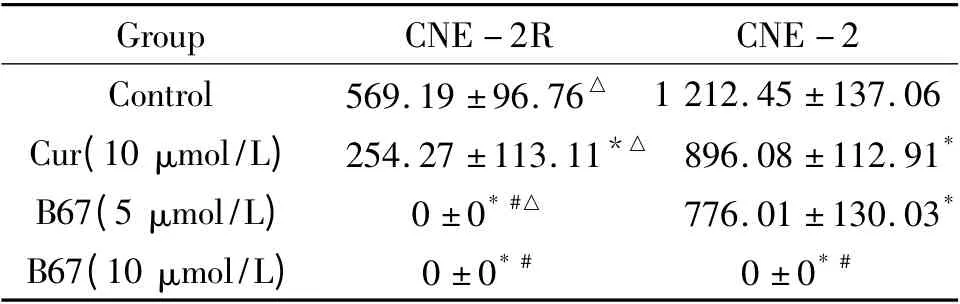
表6 B67 对CNE-2 和CNE-2R 细胞成瘤性作用的比较Table 6. Comparison of tumor volume of CNE- 2 and CNE-2R cell lines after treatment with B67 or curcumin (±sE.n=3)
* P <0.05 vs control group;#P <0.05 vs Cur group;△P <0.05 vs CNE-2 group Cur:curcumin.
Group CNE-2R CNE-2 Control 569.19 ±96.76△1 212.45 ±137.06 Cur(10 μmol/L) 254.27 ±113.11*△ 896.08 ±112.91*B67(5 μmol/L) 0 ±0* #△ 776.01 ±130.03*B67(10 μmol/L) 0 ±0* # 0 ±0*#
讨 论
鼻咽癌细胞系CNE-2R 细胞是本室对鼻咽癌细胞系CNE-2 采用爬坡式间歇性大剂量X 线诱导构建的,与CNE-2 细胞比,CNE-2R 细胞G2期细胞减少且出现线粒体和内质网的异常改变[7]。CNE-2R 和CNE-2 是具有同来源不同辐射抗拒的鼻咽癌细胞,且因其与临床长期放疗后的残存细胞具有相似性,故为寻找逆转辐射药物的理想细胞模型[8]。同时,我们的前期研究表明,鼻咽癌细胞的辐射抗拒与其差异表达的miRNA 密切相关[9]。
我们的实验结果显示B67 可较特异地抑制鼻咽癌辐射抗拒CNE-2R 细胞的活性和增殖。同时通过荧光显微镜及流式细胞仪检测发现B67 不仅能诱导鼻咽癌辐射敏感细胞CNE-2 凋亡,且对鼻咽癌辐射抗拒细胞CNE-2R 具有相同的效应,推测辐射抗拒并不促进B67 对鼻咽癌细胞凋亡的诱导效应。
值得一提的是通过流式细胞仪检测结果显示,与CNE-2 细胞比,B67 可更特异地诱导CNE-2R细胞G2/M 期的阻滞,同时G1期细胞减少。一般认为G2/M 期对辐射或化疗最敏感,G1期最不敏感[10],这些提示B67 主要通过影响细胞周期百分率的分布,而具有逆转鼻咽癌细胞辐射抗拒的作用。已有研究表明Wingless/Wnt 及STAT3 信号通路与细胞黏附通路参与了姜黄素对结肠癌细胞的诱导凋亡效应[1,11]。尽管B67 仍具有其前体姜黄素的诱导凋亡效应,但具体通路可能与姜黄素存在差异。本实验结果显示B67 可引起线粒体膜电位降低,由此推测其诱导鼻咽癌凋亡的具体通路,可能与线粒体凋亡通路有关,其具体机制有待进一步研究。
[1] Lin L,Deangelis S,Foust E,et al. A novel small molecule inhibits STAT3 phosphorylation and DNA binding activity and exhibits potent growth suppressive activity in human cancer cells[J]. Mol Cancer,2010,9:217.
[2] Sarkar FH,Li Y,Wang Z,et al. The role of nutraceuticals in the regulation of Wnt and Hedgehog signaling in cancer[J]. Cancer Metastasis Rev,2010,29(3):383-394.
[3] Ohori H,Yamakoshi H,Tomizawa M,et al. Synthesis and biological analysis of new curcumin analogues bearing an enhanced potential for the medicinal treatment of cancer[J]. Mol Cancer Ther,2006,5(10):2563-2571.
[4] Wu SH,Hang LW,Yang JS,et al. Curcumin induces apoptosis in human non-small cell lung cancer NCI-H460 cells through ER stress and caspase cascade-and mitochondria-dependent pathways[J]. Anticancer Res,2010,30(6):2125-2133.
[5] Xiao J,Tan Y,Pan YB,et al. A new cyclooxygenase-2 inhibitor,(1E,4E)-1,5-Bis(2-bromophenyl)penta-1,4-dien-3-one (GL63)suppresses cyclooxygenase-2 gene expression in human lung epithelial cancer cells:coupled mRNA stabilization and posttranscriptional inhibition[J]. Biol Phar Bull,2010,33(7):1170-1175.
[6] 梁 广,田吉来,邵丽丽,等. 姜黄素的构效关系及以其为先导物的抗肿瘤化合物研究进展[J]. 化学通报,2008,71(2):110-117.
[7] 潘运宝,曲昌菊,杨惠玲,等. 不同辐射抗拒鼻咽癌细胞细胞周期和形态学差异比较[J]. 中山大学学报(医学科学版),2009,30(3S):38-41.
[8] 王旭丹,杨惠玲,郭禹标,等. 不同辐射抗拒鼻咽癌细胞微小RNA 差异表达的研究[J]. 中国病理生理杂志,2007,23(6):1045-1048.
[9] 曲昌菊,王旭丹,杨惠玲,等. 相同遗传背景不同辐射抗拒鼻咽癌细胞miRNA 差异表达的研究[J]. 中国病理生理杂志,2009,25(3):484-488.
[10] Chhavi,Saxena M,Singh S,et al. Expression profiling of G2/M phase regulatory proteins in normal,premalignant and malignant uterine cervix and their correlation with survival of patients[J]. J Cancer Res Ther,2010,6(2):167-171.
[11] Jaiswal AS,Marlow BP,Gupta N,et al. β-Catenin-mediated transactivation and cell-cell adhesion pathways are important in curcumin(diferuylmethane)- induced growth arrest and apoptosis in colon cancer cells[J]. Oncogene,2002,21(55):8414-8427.

