CX3 CL1/fractalkine 在肺动脉高压过程中的表达变化及葛根素的干预作用*
狄 枫, 王良兴, 沈巨信, 高伟红
(1 绍兴市人民医院呼吸内科,浙江 绍兴312000;2温州医学院附属第一医院肺科中心,浙江 温州325000)
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是一种具有气流受限特征的疾病,气流受限不完全可逆、呈进行性发展,与肺部对有害气体或有害颗粒的异常炎症反应有关[1],肺动脉高压是其终末阶段。肺动脉高压的动物模型已经证实促炎因子和一些趋化因子与肺动脉高压的发生有关[2,3]。CX3CL1(fractalkine,FKN)是趋化因子CX3C 亚族里的唯一成员,也是唯一的一种既有可溶形式也有膜结合形式的趋化因子,既有趋化性蛋白的功能也有细胞黏附分子的功能。本实验在野百合碱诱导的肺动脉高压大鼠模型上,观察FKN 的表达情况,探讨FKN 在肺动脉高压形成过程中的作用和可能的机制,以及观察葛根素的治疗效果。
材 料 和 方 法
1 材料
1.1 动物 清洁级标准健康雄性Sprague-Dawley(SD)大鼠30 只(温州医学院实验动物中心提供),体重(body weight,BW)270-310g,在恒温26℃,相对湿度50%-60%清洁环境中饲养。
1.2 试剂和药品 野百合碱(monocrotaline)购于日本和光纯药工业株式会社,葛根素(puerarin)由浙江康恩贝制药股份有限公司出品(批号为090103;规格:2 mL∶0.1 g),大鼠fractalkine ELISA 试剂盒购于晶美生物工程有限公司。RT-PCR试剂盒购于宝生物工程(大连)有限公司。免疫组化试剂购于北京中衫金桥生物技术有限公司。Fractalkine 兔抗大鼠多克隆抗体购自BioVision。其余试剂均为市售分析纯试剂。
2 方法
2.1 动物模型制备及分组 将30 只大鼠,按随机数字表法分为3 组:(1)溶剂对照组(C 组,10 只),采用无水乙醇与生理盐水2∶8 比例混合单次腹腔注射;(2)野百合碱模型组(M组,10 只),采用上述溶剂配成的1. 0% 野百合碱溶液以50 mg/kgBW 的剂量单次腹腔注射后饲养3 周;(3)葛根素干预组(M+ P 组,10 只),在注射野百合碱溶液后每晨以40 mg/kgBW 剂量腹腔注射饲养3 周。余饲养条件各组相同。动物饲养到规定时间后,称量体重,以5%水合氯醛400 mg/kg 剂量腹腔注射麻醉,将聚乙烯导管(OD 1.1 mm,ID 0.8 mm)从右颈外静脉插入右心室,记录右心室压力波形后插入肺动脉固定记录肺动脉压力波形,另一聚乙烯导管从左颈总动脉插入固定记录颈总动脉压力波形,ML870PowerLab 8/30数据记录分析系统及MLS023Chart 软件计算肺动脉平均压(mean pulmonary arterial pressure,mPAP)、右心室平均压(mean right ventricle pressure,mRVP)和颈动脉平均压(mean carotid arterial pressure,mCAP)。放血处死动物后,分离心脏,PBS 冲洗,10%中性甲醛液中固定后,把心脏剪开成右心室壁(right ventricle,RV)和左心室(left ventricle,LV)加室间隔(septum,S)两部分,滤纸吸干液体后分别用电子天平称重,计算两者的比值RV/(LV+S)来反映右心室重量的变化。
2.2 光镜标本制作及观察 分离左肺组织,10%中性福尔马林液中固定充分,左肺门水平横切,制备石蜡包埋组织切片,厚度4μm,分别行HE 染色、醛品红法弹力纤维染色,每只大鼠选1 张肺组织切片,每张切片随机选取直径(50-200)μm肺细小动脉各6 支(50-100 μm 2 只,100-150 μm 2 只,150-200 μm 2 只),用Image-Pro Plus 6.0 软件测定平均血管总面积(外弹力板以内)、血管腔面积(内膜表面以内),计算肺细小动脉管壁面积(vessel wall area,WA)/管总面积(total area,TA)(WT/TA),并测定肺细小动脉内外弹力板之间的中膜厚度(thickness of pulmonary artery media,PAMT)。
2.3 血浆可溶性fractalkine(sFKN)测定 应用ELISA 试剂盒检测大鼠血浆sFKN 水平,实验步骤按试剂盒说明书进行。根据标准品吸光度值用SPSS 11.5 软件拟合绘制标准曲线,通过标本吸光度值计算出浓度。
2.4 RT-PCR 法检测肺组织FKN mRNA 的表达 动物放血处死后,迅速取右下肺新鲜组织,无菌去酶1 ×PBS 水洗去血污,即刻置液氮中保存。Trizol 一步法提取组织RNA 并纯度鉴定及定量,使其终浓度为1 g/L。反应在200 μL PCR 薄壁管(RNase free)中进行。FKN 上游引物5'-CCCTGAGACACCCGTTTC-3',下游引物5'-AGTGACTATTCATGTTGATAAGGG-3,目标片段524 bp;GAPDH 上游引物5'-TTCCAGGAGCGAGATCCC-3',下 游 引 物5'-CAGGGGGGCTAAGCAGTT-3',目标片段252 bp。扩增条件为94 ℃30 s→54 ℃30 s→72 ℃1 min,热循环30 次,72 ℃5 min。扩增产物经琼脂糖凝胶电泳后Gel-Pro Analyzer 软件分析,FKN mRNA/GAPDH mRNA 的比值即为FKN mRNA 的相对含量,每个样本重复3 次实验,取其平均值。
2.5 FKN 免疫组织化学检测 肺组织经10%中性甲醛液充分固定后。常规脱水、石蜡包埋、切片、脱蜡、水化后抗原修复,Ⅰ抗为FKN 兔抗大鼠多克隆抗体,Ⅱ抗为山羊抗兔的IgG抗体-HRP 多聚体,0.05%DAB-H2O2显色,苏木素淡染细胞核,脱水透明后中性树胶封片。不滴加Ⅰ抗的片子作为阴性对照,阳性结果呈棕黄色,每只大鼠选1 张肺组织切片,每张切片随机选取直径为50-200 μm 的肺细小动脉5 支,用Image-Pro Plus 6.0 软件测定管壁平均吸光度(A)反映肺动脉壁上FKN 的相对含量。
3 统计学处理
结 果
1 形态学检查
光镜下示C 组肺细小动脉内皮细胞扁平连续,内弹力板自然弯曲,平滑肌层未见明显增厚,管壁均匀一致。M 组肺细小动脉内皮部分脱落,血管肌化明显,内弹力板进一步扭曲甚至断裂,管壁明显增厚,部分小动脉闭塞,血管周围以淋巴细胞为主的炎性细胞浸润明显,部分成团。M +P 组肺细小动脉较M 组血管肌化减轻,内弹力板扭曲减少,管壁增厚好转,管腔狭窄不明显,血管周围炎性细胞减少,见图1。
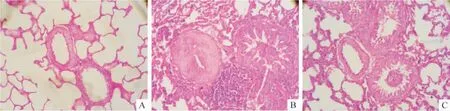
Figure 1. Pulmonary arteriole of rats in each group. A:control group;B:monocrotaline model group;C:monocrotaline +puerarin group (HE staining,×400)图1 各组肺细小动脉HE 染色
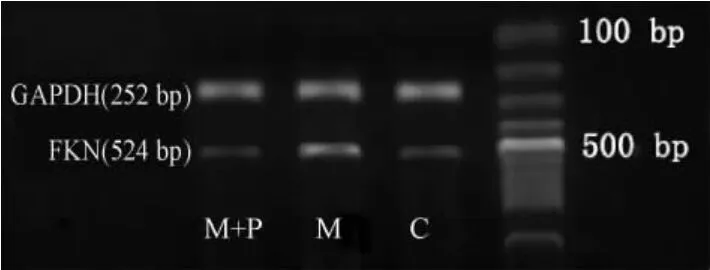
Figure 2. RT-PCR electrophoresis strip of FKN in lung tissues图2 各组大鼠肺组织FKN m RNA 表达
2 各组大鼠mPAP、mRVP 、mCAP、RV/(LV +S)%、WA/TA 和PAMT 的比较
M 组mPAP、mRVP 、RV/(LV+S)、WA/TA 和PAMT 均显著高于C 组,说明大鼠肺动脉压力增高,右心室肥大,血管壁增厚,证实模型制造成功。M + P 组RV/(LV + S)、WA/TA、PAMT 较M 组显著降低。M+P 组mPAP 和mRVP 与M 组比较有降低趋势,但无显著差异。反映体循环的颈动脉平均压(mCAP)在各组之间无显著差异(F=0.633,P >0.05),见表1。
3 各组大鼠血浆sFKN 浓度、肺组织FKN mRNA 相对含量及肺动脉壁膜结合型FKN 表达比较
M 组血浆sFKN 浓度、肺组织FKN mRNA 含量和肺动脉壁FKN 蛋白含量大于C 组,M+P 组的这些指标均小于M 组,差异显著,见表2。
表1 各组大鼠mPAP、mRVP 、mCAP、RV/(LV+S)、WA/TA 和PAMT 比较Table 1. Comparison of mPAP,mRVP,mCAP,RV/(LV+S),WA/TA and PAMT in the three groups(±s.n=8)
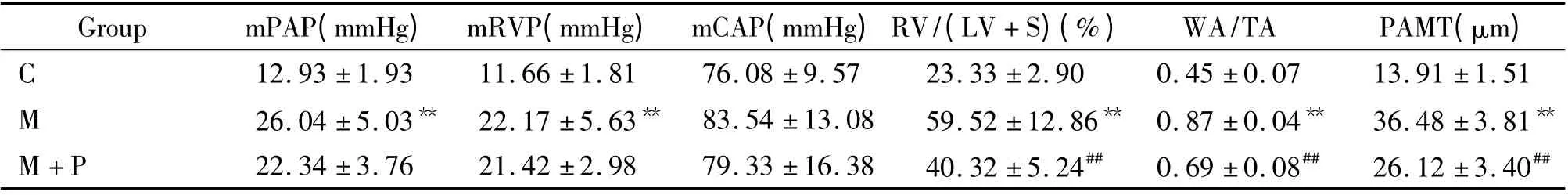
表1 各组大鼠mPAP、mRVP 、mCAP、RV/(LV+S)、WA/TA 和PAMT 比较Table 1. Comparison of mPAP,mRVP,mCAP,RV/(LV+S),WA/TA and PAMT in the three groups(±s.n=8)
1 mmHg=0.133 kPa;**P <0.01 vs C group;##P <0.01 vs M group.C:control:M:monocrotaline model;M+P:monocrotaline+puerarin.
Group mPAP(mmHg) mRVP(mmHg) mCAP(mmHg)RV/(LV+S)(%) WA/TA PAMT(μm)C 90 0.45 ±0.07 13.91 ±1.51 M 26.04 ±5.03** 22.17 ±5.63** 83.54 ±13.08 59.52 ±12.86** 0.87 ±0.04** 36.48 ±3.81**M+P 22.34 ±3.76 21.42 ±2.98 79.33 ±16.38 40.32 ±5.24## 0.69 ±0.08## 26.12 ±3.40 12.93 ±1.93 11.66 ±1.81 76.08 ±9.57 23.33 ±2.##
表2 各组大鼠血浆sFKN 浓度、肺组织FKN mRNA 相对含量和肺动脉壁膜结合型FKN 的变化Table 2. Changes of sFKN in plasma,FKN mRNA in lung tissue and FKN protein in pulmonary artery wall in each group(±s.n=8)

表2 各组大鼠血浆sFKN 浓度、肺组织FKN mRNA 相对含量和肺动脉壁膜结合型FKN 的变化Table 2. Changes of sFKN in plasma,FKN mRNA in lung tissue and FKN protein in pulmonary artery wall in each group(±s.n=8)
**P <0.01 vs C group;#P <0.05,##P <0.01 vs M group.
Group sFKN(ng/L)FKN mRNA/ GAPDH mRNA FKN protein C 412.09±57.38 0.11±0.06 0.171±0.010 M 1 078.02±254.05** 0.64±0.04** 0.198±0.019**M+P 465.17±188.80## 0.28±0.08## 0.181±0.016#
4 血浆sFKN、肺组织FKN mRNA、肺动脉壁膜结合型FKN蛋白与PAMT、RV/(LV+S)相关性分析
sFKN 与PAMT 呈正相关(r =0.719,P <0.01),与RV/(LV+S)呈正相关(r=0.685,P <0.01),FKN mRNA 与PAMT呈正相关(r=0.882,P <0.01),与RV/(LV+S)呈正相关(r=0.830,P <0. 01),FKN 与PAMT 呈正相关(r =0. 599,P <0.01),与RV/(LV+S)呈正相关(r=0.664,P <0.01)。
讨 论
COPD 与肺部对有害气体或有害颗粒的异常炎症反应有关,具有气流受限的特征[1]。其发病的终末环节为肺动脉高压的形成,而继发的肺动脉高压是COPD 发展至肺心病的关键病理环节,死亡率大幅度上升。肺动脉高压的形成机制很复杂,目前观点认为是各种内外环境的刺激因素作用于有遗传易感性的个体,最终导致肺小动脉异常收缩和血管重建,使肺动脉压力增高。近年来对炎症与血管炎、血管硬化的研究方兴未艾,近期研究认为动脉粥样硬化是一种由各种原因损伤内皮细胞导致的特殊形式的动脉壁慢性炎症[4],很多实验也都已经观察到在肺动脉高压的患者和动物模型肺血管的复合性损伤中,血管周围炎性细胞如淋巴细胞和巨噬细胞的浸润,说明炎症细胞参与了肺动脉高压中的血管损伤[5]。临床上无明显缺氧的轻度COPD 患者,甚至肺功能正常的吸烟者都已出现肺动脉内膜增厚和以淋巴细胞为主的炎症细胞浸润,说明炎症在COPD 引起的肺动脉高压过程中是初始因素,而这些白细胞的运输包括滚动、黏附、外渗等运动都是在趋化因子的趋化作用下完成的。FKN 是近年来发现的唯一一种可以以膜结合形式和可溶性形式2 种形式存在的趋化因子,膜结合的FKN 受炎症细胞因子(如TNF-α、IL-1、IFN-γ)的激活主要表达在内皮和上皮细胞表面,它本身具有整合蛋白的功能,介导的黏附可以是整合素非依赖途径,膜结合形式不仅能介导俘获快速血流中的CX3CR1 阳性白细胞并且还能激活它们[6-8]。但不同于其它的趋化因子,FKN在被溶蛋白性裂解后可以可溶性形式释放[9],在正常状态下,可溶性FKN 的功能还不确定,在多种慢性炎症疾病中可以观察到血清FKN 的升高[10,11],同时参与血管炎的病理过程[12],在类风湿关节炎的病人中,伴有血管炎的患者血清FKN 的含量明显高于不伴有血管炎的患者[13],在韦格纳肉芽肿病人血清中,FKN 含量明显高于健康对照者。同时血清中FKN 含量的增高能增加外周血单核细胞CX3CR1 的表达,从而加强这些受体阳性细胞的趋化和黏附,这些变化直接导致血管内皮损伤[14]。体外研究发现sFKN 对单核细胞和T细胞呈现很好的趋化活性,指引这些细胞游走到特定的血管部位。由于其结构和功能的独特性,FKN 越来越受到人们的关注,被认为在炎症反应中单核细胞、T 淋巴细胞募集到血管壁的过程中起到了关键性的作用。CX3CR1 在严重原发性肺动脉高压患者体内循环T 细胞上表达上调,特别在CD4 阳性的T 细胞亚群,血浆中可溶性的FKN 浓度较对照组增高,肺组织FKN mRNA 的表达较对照组有显著增高[15]。我们的实验在肺动脉高压的大鼠模型上也观察到肺组织和肺动脉壁上的FKN 表达增加,血浆中可溶FKN 增加。
葛根素系豆科植物野葛干燥根中的提取物,其主要成分为8-D-吡喃葡萄糖-4,7-二羟基异黄酮苷,具有扩张血管、抗凝、改善微循环、清除氧自由基、抑制平滑肌细胞增生等作用[16]。近年来发现葛根素还能抑制组织缺血再灌注损伤后炎症细胞聚集和炎症级联反应[17],另有研究证明葛根素能有效改善慢性低氧性肺动脉高压大鼠的肺血管重建、降低肺动脉高压及右心室肥大[18,19],但具体机制尚不完全清楚。本实验在野百合碱诱导的肺动脉高压模型中观察葛根素对肺动脉高压的干预效应,发现葛根素干预组RV/(LV +S)有明显下降,mCAP 无改变,提示葛根素可以抑制野百合碱诱导的右心室重构的发展,而对体循环无明显影响,同时光镜下发现葛根素可以抑制肺细小动脉WA/TA 和PAMT 的增加,血管周围炎症细胞减少,说明葛根素在野百合碱模型中具有抑制肺动脉高压形成过程中肺动脉重建和减轻肺血管周围炎症的作用。
总之,COPD 的病因复杂,且多因素相互影响,COPD 继发肺动脉高压的发病机制涉及功能性、解剖学因素以及血容量增多和血黏度增加等方面。炎症细胞和相关的细胞因子网络参与肺血管重建的机制日益受到重视,我们的实验首次采用更符合COPD 肺动脉高压炎性环境的野百合碱诱导肺动脉高压大鼠模型,发现肺动脉高压时FKN 在血浆、肺组织和肺细小动脉内皮上表达增强,并且与肺动脉壁厚度的变化密切相关,葛根素有明显的下调FKN 和缓解肺动脉高压的作用。这可能有助于进一步阐明COPD 继发肺动脉高压的形成机制,同时也为葛根素在治疗肺动脉高压患者上的推广应用提供实验研究依据。
[1] Viegi G,Scognamiglio A,Baldacci S,et al.Epidemiology of chronic obstructive pulmonary disease (COPD)[J].Respiration,2001,68(1):4-19.
[2] Voelkel NF,Tuder RM,Bridges J,et al. Interleukin-1 receptor antagonist treatment reduces pulmonary hypertension generated in rats by monocrotaline[J]. Am J Respir Cell Mol Biol,1994,11(6):664-675.
[3] Kimura H,Kasahara Y,Kurosu K,et al. Alleviation of monocrotaline-induced pulmonary hypertension by antibodies to monocyte chemotactic and activating factor/monocyte chemoattractant protein-1[J]. Lab Invest,1998,78(5):571-581.
[4] Libby P. Inflammation in atherosclerosis [J]. Nature,2002,420 (6917):868-874.
[5] Dorfmuller P,Zarka V,Durand-Gasselin I,et al. Chemokine RANTES in severe pulmonary arterial hypertension[J]. Am J Resp Crit Care Med,2002,165(4):534-539.
[6] Haskell CA,Cleary MD,Charo IF. Molecular uncoupling of fractalkine-mediated cell adhesion and signal transduction. Rapid flow arrest of CX3CR1-expressing cells is independent of G-protein activation [J]. J Biol Chem,1999,274(15):10053-10058.
[7] Fong AM,Robinson LA,Steeber DA,et al. Fractalkine and CX3CR1 mediate a novel mechanism of leukocyte capture,firm adhesion,and activation under physiologic flow[J]. J Exp Med,1998,188(8):1413-1419.
[8] Feng L,Chen S,Garcia GE,et al. Prevention of crescentic glomerulonephritis by immunoneutralization of the fractalkine receptor CX3CR1.Rapid communication[J]. Kidney Int,1999,56(2):612-620.
[9] Bazan JF,Bacon KB,Hardiman G,et al. A new class of membrane-bound chemokine with a CX3C motif [J].Nature,1997,385(6617):640-644.
[10] Hasegawa M,Sato S,Echigo T,et al. Up regulated expression of fractalkine/CX3CL1 and CX3CR1 in patients with systemic sclerosis [J]. Ann Rheum Dis,2005,64(1):21-28.
[11] Yajima N,Kasama T,Isozaki T,et al. Elevated levels of soluble fractalkine in active systemic lupus erythematosus:potential involvement in neuropsychiatric manifestations[J]. Arthritis Rheum,2005,52(6):1670-1675.
[12] Matsunawa M,Odai T,Wakabayashi K,et al. Elevated serum levels of soluble CX3CL1 in patients with microscopic polyangiitis [J]. Clin Exp Rheumatol,2009,27(1):72-78.
[13] Matsunawa M,Isozaki T,Odai T,et al. Increased serum levels of soluble fractalkine (CX3CL1)correlate with disease activity in rheumatoid vasculitis [J]. Arthritis Rheum,2006,54(11):3408-3416.
[14] Bjerkeli V,Damas JK,Fevang B,et al. Increased expression of fractalkine (CX3CL1) and its receptor,CX3CR1,in Wegener's granulomatosis possible role in vascular inflammation [J]. Rheumatology (Oxford),2007,46(9):1422-1427.
[15] Balabanian K,Foussat A,Dorfmuller P,et al. CX3C chemokine fractalkine in pulmonary arterial hypertension[J].Am J Resp Crit Care Med,2002,165(10):1419-1425.
[16] 陈秀芳,雷康福,董 敏,等.葛根素对糖尿病大鼠心肌损伤的影响[J].中国病理生理杂志,2010,26(4):650-655.
[17] 娄海燕,魏欣冰,王汝霞,等. 葛根素对大鼠局灶性脑缺血再灌注损伤后炎症反应的抑制作用[J]. 中国病理生理杂志,2007,23(2):366-369.
[18] 李继武,季亢挺,范小芳,等.葛根素对慢性低氧高二氧化碳大鼠肺动脉高压形成的预防作用[J]. 中国预防医学杂志,2008,9(2):113-118.
[19] 林 全,王良兴,黄晓颖,等.葛根素对缺氧性大鼠肺组织骨桥蛋白及其整合素β3 受体基因表达的影响[J].中国药理学通报,2009,25 (7):887-890.

