PGE2 受体EP2 和EP4 调节CIA 小鼠脾B 细胞表面分子和细胞因子表达*
张敬各, 陈海英, 秦 瑾,, 丛 斌△, 李巧霞, 贾娴娴, 马春玲, 于 峰
(1 河北医科大学基础医学院,河北省法医学实验室,河北 石家庄050017;2 河北医科大学第三医院,河北 石家庄050051)
类风湿关节炎(rheumatoid arthritis,RA)是以关节炎症细胞浸润,滑膜细胞增生,以及软骨和骨组织损害为特征的慢性自身免疫性疾病。其发病过程涉及多种因素,前列腺素E2(prostaglandin E2,PGE2)是人体内含量最多的一种前列腺素[1],且是一种重要的炎症介质。目前广泛用于治疗RA 的非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAID)正是通过抑制环氧合酶(cyclooxygenase,COX)从而抑制前列腺素(主要是PGE2)的产生而达到缓解症状的目的。PGE2通过与细胞膜上相应受体(E-prostanoid,EP)结合而发挥作用。已确定的EP 有4种亚型,即EP1、EP2、EP3 和EP4[2],它们广泛分布于机体各种组织和细胞中,通过与特定的G 蛋白偶联而介导不同的生物学效应。实验证明,单独敲除或抑制某一种EP 并不影响胶原诱导性关节炎(collagen-induced arthritis,CIA)小鼠的发病程度,而同时抑制EP2 和EP4 显著降低CIA 关节炎评分,提示PGE2的关节炎效应主要由EP2 和EP4 介导[3,4]。其它大量实验也证实了两者在RA 发病中的重要作用[5-8]。
目前认为,B 细胞在RA 的发生、发展中起着关键作用。Edwards 等[9]将治疗B 细胞淋巴瘤的药物rituximab(利妥昔单抗,一种清除B 细胞的抗体)用于RA 治疗的成功,进一步也证明了可以将B 细胞作为治疗自身免疫病的靶点。本实验采用CIA 小鼠模型,通过观察EP2 和EP4 阻断剂处理CIA 小鼠后,小鼠脾B 细胞表面分子和细胞因子表达的变化,探讨PGE2及其受体EP2/EP4 在RA 发病机制中的作用,为指导临床正确应用NSAID,寻找更精确的抗炎药物作用靶点提供理论依据。
材 料 和 方 法
1 材料
1.1 主要试剂 不完全弗氏佐剂和鸡Ⅱ型胶原(collagen type Ⅱ,col Ⅱ)购自Sigma,EP2 阻断剂AH6809 购自Cayman,EP4 阻断剂L161982 购自Tocris,卡介苗购自中国药品生物制品检定所,CD19+免疫磁珠购自美天旎公司,Trizol 购自Invitrogen,PrimeScriptTMRT reagent Kit 购自大连宝生物公司,Power SYBR Green PCR Master Mix 购自Applied Biosystems,流式抗体购自eBioscience。
1.2 动物 健康DBA/1 小鼠,6-8 周龄,由上海斯莱克实验动物中心提供,实验动物证书号为SCXK(沪)200720005。
2 方法
2.1 CIA 小鼠模型建立和分组 选用健康的DBA/1 小鼠36 只,随机分为空白对照组(6 只)和CIA 单纯造模组(12 只),AH6809(EP2 阻断剂)处理组(9只),L161982(EP4 阻断剂)处理组(9 只)。适应环境3 d 后给小鼠尾根部皮内注射鸡Col Ⅱ200 μg及完全弗氏佐剂的乳化剂(其内含有200 μg 结核分枝杆菌H37Ra)100 μL,第21 d 再次免疫增强。AH68095 和L161982 处理组分别给予相应的药物,剂量均为5 mg·kg-1·d-1,腹腔注射100 μL,从第2 次Col Ⅱ免疫后第2 d 开始,连续14 d。
2.2 小鼠脾B 细胞制备 脱颈处死小鼠,无菌摘取脾脏,置于200 目不锈钢筛网上,注射器针芯轻轻研磨,加入PBS 冲洗得到脾细胞悬液。取脾细胞用CD19+免疫磁珠分选B 细胞,流式细胞仪检测细胞纯度在95%以上。
2.3 B 细胞EPs 检测 根据Trizol 说明提取细胞总RNA,测定RNA 纯度和浓度。取0.5 μg 总RNA 经37 ℃15 min,85 ℃5 s 反转录成cDNA,以cDNA 为模板,在ABI 7500 real-time PCR 仪上进行实时荧光定量PCR 反应。反应条件:95 ℃10 min,95 ℃15 s,60 ℃1 min,40 个循环。引物由上海生物技术工程公司合成。EP1 上游引物5’- CCACTGGGGACGAGTACAGT-3’,下 游 引 物5’- AGGTCAAGATGGGAACATGC-3’;EP2 上游引物5’-CTGGTAACGGAATTGGTGCT-3’,下 游 引 物5’-CAGGGAACAGAAGAGCAAGG-3’;EP3 上游引物5’- CTCCAGCCTCAGAACCTTTG-3’,下游引物5’-GAAATGATGGCACGATTCCT-3’;EP4 上游引物5’-TCTCTGGTGGTGCTCATCTG-3’,下游引物5’-ACGTGCTGCTGATCTCCTTT’;β-actin 上游引物5’-TACCCAGGCATTGCTGACAGG-3’,下游引物5’-ACTTGCGGTGCACGATGGA-3’。PCR 扩增产物用2 %琼脂糖凝胶电泳进行验证。
2.4 小鼠B 细胞CD80、CD86 和MHC Ⅱ表达 分选小鼠脾B 细胞,调整细胞密度为1 ×106cells/100 μL,分别加入FITC-抗CD80、FITC-抗CD86 或FITC-抗MHCⅡ抗体,4 ℃避光孵育30 min,PBS 洗涤2 次,用流式细胞仪进行检测。每次实验用同型抗体作对照,用平均荧光强度(mean fluorescence intensity,MFI)表示CD80、CD86 和MHCⅡ蛋白表达量。
2.5 小鼠B 细胞内细胞因子mRNA 表达 取CIA小鼠脾B 细胞cDNA,用实时荧光定量PCR 技术检测细胞因子的表达。IFN-γ 上游引物5'-AGCAACAACATAAGCGTCAT-3',下 游 引 物5'-CCTCAAACTTGGCAATACTC-3';TNF-α 上游引物5'-CTGTGAAGGGAATGGGTGTT-3',下游引物5'-CAGGGAAGAATCTGGAAAGGTC-3';IL-10 上游引物5'-ACCAAAGCCACAAAGCAG-3',下游引物5'-GGAGTCGGTTAGCAGTATG-3';IL-6 上游引物5'-TTCTTGGGACTGATGCTG-3',下游引物5'-CTGGCTTTGTCTTTCTTGTT-3';IL-4 上 游 引 物5'-TC CTGCTCTTCTTTCTCG-3',下游引物5'-TTCTCCTGTGACCTCGTT-3';TGF-β 上游引物:5'-ATGGTGGACCGCAACAAC-3',下游引物5'-AGCCACTCAGGCGTATCAG-3'。以β-actin 为内参照,序列同2.3。
3 统计学处理
结 果
1 CIA 小鼠病变的形态学观察及关节炎评分
小鼠于第1 次免疫后第27 d 足趾关节开始出现肿胀,首先是两后足出现红肿,以后延伸到前足和尾部并日趋严重,第35 d 左右达到高峰,见图1、2,提示CIA 小鼠模型建立成功。
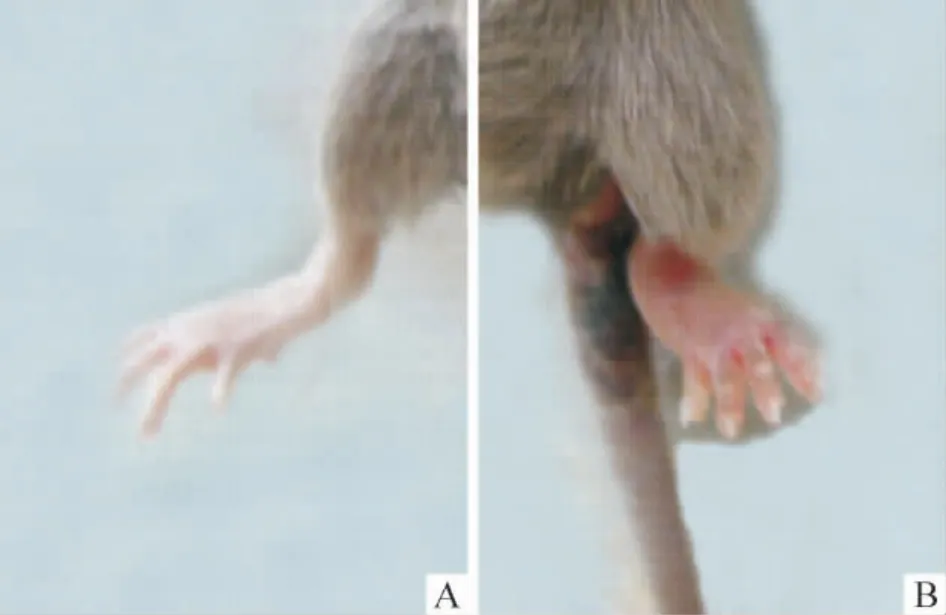
Figure 1. Typical pattern of CIA in DBA/1 mice with the change of paw. A:normal paw;B:CIA paw.图1 CIA 小鼠足爪

Figure 2. Typical pattern of CIA in DBA/1 mice with the change of arthritic scores.图2 CIA 小鼠关节炎评分
2 EPs 在B 细胞上的表达
实时荧光定量RT-PCR 技术检测到PGE2受体的4 个亚型EP1、EP2、EP3、EP4 mRNA 在DBA 小鼠脾B 细胞上均有不同程度的表达。其中,EP2 表达最强,然后依次是EP1 和EP3,EP4 表达最弱,见图3、4。

Figure 3. Gene expression of EP receptors in mouse B-cells.Total RNA was subjected to real-time PCR with primers specific for EP1,EP2,EP3 and EP4. Results are shown as an amplification plot for each EP receptor.图3 荧光定量PCR 检测的小鼠B 细胞上EPs 的熔解曲线

Figure 4. The mRNA expression of EPs in mouse B-cells detected by gel electrophoretogram. M:marker (100 bp ladder). The amplification products of EP1,EP2,EP3,EP4 and β-actin were approximately 329,303,319,343 and 218 bp,respectively.图4 EPs 在正常小鼠B 细胞上的表达
3 CIA 模型中EP2/EP4 表达的变化
实时荧光定量PCR 结果显示,CIA 模型小鼠脾B 细胞EP2/EP4 表达均明显增多,分别增多了9.72和4.87 倍,见图5。
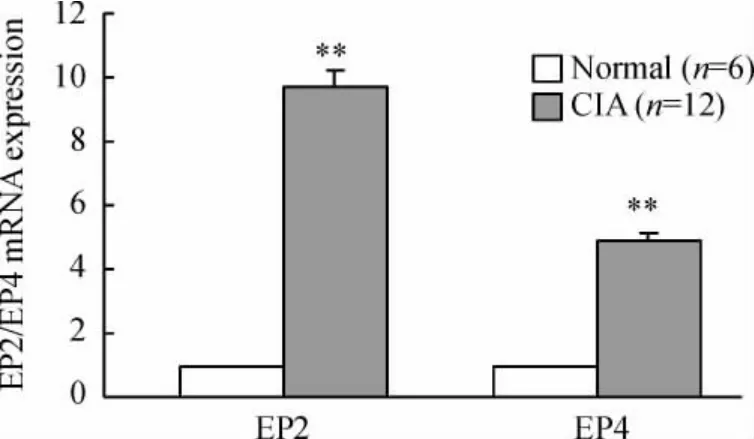
Figure 5. The mRNA expression of EP2/EP4 in B-cells in normal group and CIA group analyzed by real-time PCR. ±s. **P <0.01 vs normal group.图5 CIA 模型组小鼠B 细胞EP2/EP4 表达增加
4 小鼠脾B 细胞CD80、CD86 和MHCⅡ表达的变化
流式细胞仪检测结果显示,CIA 小鼠脾B 细胞CD80、CD86 和MHCⅡ表达均增加。与CIA 模型组相比,AH6809 处理组CD80、CD86 和MHCⅡ的表达均降低(P <0.05),L161982 处理组CD86 和MHCⅡ的表达减少(P <0.05)。这表明EP2 阻断剂能够不同程度地抑制CD80、CD86 和MHCⅡ的表达,而EP4阻断剂对CD86 和MHCⅡ的表达具有抑制作用,对CD80 的作用不明显,见图6。

Figure 6. FCM analysis of the expression of CD80,CD86 and MHC Ⅱin B-cells. ±s. #P <0.05,##P <0.01 vs normal group;* P<0.05 vs CIA group.图6 流式细胞仪检测小鼠B 细胞CD80、CD86 和MHC Ⅱ表达的变化
5 小鼠脾B 细胞内细胞因子表达的变化
结果显示,CIA 模型组小鼠IFN-γ 表达增加,IL-4 表达降低(P <0.05),TNF-α 和IL-6 表达明显增高(P <0.01),TGF-β 和IL-10 的表达与正常组相比没有明显差异;EP2 阻断剂AH6809 可以降低IFN-γ 的表达水平(P <0.05),促进IL-4 和IL-10 的表达(P <0.01),抑制TNF-α 和IL-6 表达的增加(P <0.01);EP4 阻断剂L161982 可以抑制IFN-γ、TNF-α 和IL-6 表达的增加(P <0.05 和P <0.01),提高TGF-β 和IL-10 的表达水平(P <0.01 和P <0.05),见图7。
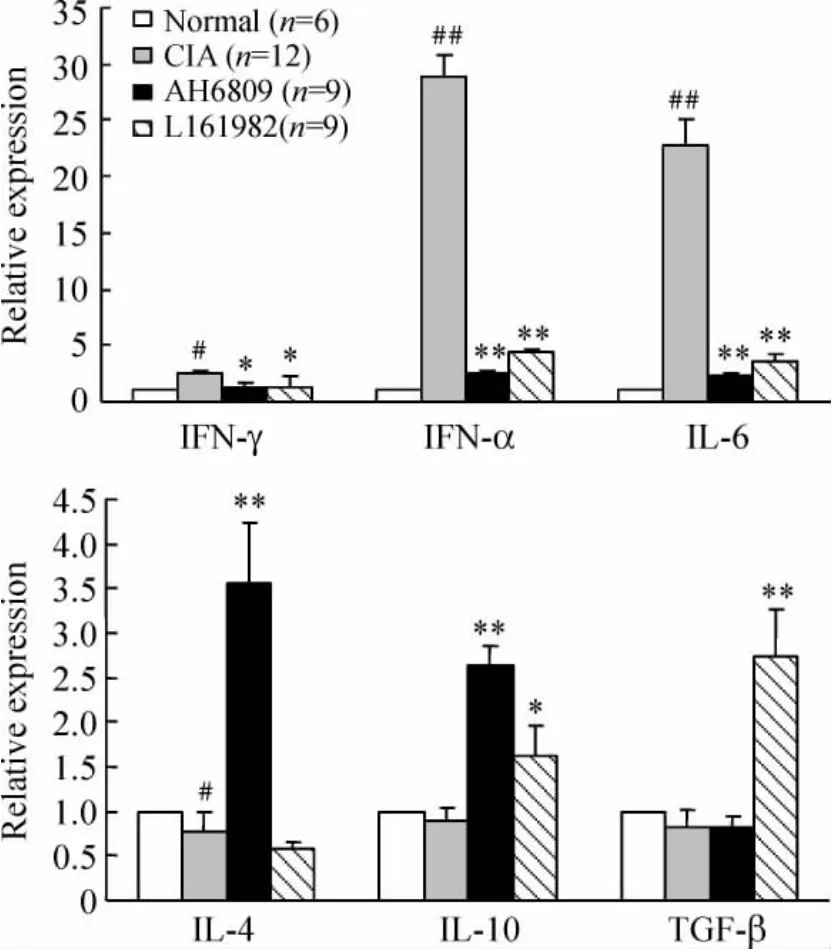
Figure 7. The expression of cytokines in B cells analyzed by real-time PCR. ± s. * P <0.05,**P <0.01 vs CIA group;#P <0.05,##P <0.01 vs normal group.图7 不同处理组B 细胞内细胞因子的表达变化
讨 论
大量临床研究发现,抗CD20 单克隆抗体(rituximab)通过选择性去除B 细胞,对难治性RA 患者具有很好的治疗作用,但同时也发现许多治疗患者血清自身抗体并未减低,使人们逐渐意识到B 细胞促进疾病发生可能并不完全依赖抗体形成,而其抗原提呈、细胞因子生成及激活T 细胞的功能在许多炎症性疾病的发生发展过程中起关键作用[10]。
PGE2作为重要的介质之一,在RA 发病过程中起着重要的病理生理作用。PGE2与受体结合是PGE2发挥作用的前提,因此,我们首先检测了小鼠B细胞上EPs 的表达情况,EPs 在B 细胞上的存在及在CIA 模型中EP2/EP4 表达的增加均为PGE2通过B 细胞发挥免疫调节作用提供了直接的结构基础,也为其受体阻断剂可以通过与B 细胞作用影响免疫调节功能提供了理论依据。
在免疫应答过程中,T 细胞的激活需双信号的刺激,第一信号为抗原提呈细胞(antigen presenting cell,APC)表面MHC-Ag 复合物分子与T 细胞特异性受体结合,第二信号为APC 表面共刺激分子与T细胞相应的配体结合。两种信号协调刺激作用后才可激活T 细胞,参与免疫杀伤效应以及细胞免疫过程。本实验检测了B 细胞表面抗原提呈相关分子MHCⅡ和共刺激分子CD80/CD86 的表达情况,结果显示,CIA 模型小鼠脾B 细胞MHCⅡ和CD80/CD86表达均明显增多,说明B 细胞的抗原提呈功能明显增强。EP2/EP4 阻断剂通过不同程度地抑制CIA 小鼠B 细胞MHCⅡ和CD80/CD86 的表达可以抑制B细胞与活化T 细胞的反应,从而可能达到改善RA 症状的目的。
细胞因子网络和细胞因子失衡在自身免疫性疾病中发挥着重要作用,在RA 的病程中,细胞因子对炎症的调控具有重要地位[11]。IFN-γ 有广泛的免疫调节作用,能活化NK 细胞,提高其杀伤能力;诱导巨噬细胞和B 细胞表达MHCⅡ类分子,提高其抗原提呈能力。而IL-4 能抑制IFN-γ 的分泌,维持Th2 的增殖,拮抗IFN-γ 的前炎症效应并抑制Th1细胞的增生[12],对软骨和骨的破坏具有保护作用。TNF-α 可上调单核巨噬细胞MMP-9 表达及活化,增强炎症细胞的侵蚀力,可能在RA 关节破坏机制中起着重要的作用[13];抑制TNF-α 可以阻止RA 的发生,用阻断TNF-α 活性的药物可以改善RA 临床症状[14]。IL-6 是B 细胞分化因子,与RA 患者的骨和软骨破坏及骨质疏松有关。干预IL-6 活性也是一种RA 治疗途径[15]。B 细胞分泌的IL-10 既可以通过调节Th1/Th2 平衡抑制免疫病理反应,又可以直接消弱免疫细胞介导的炎症反应[16]。临床上已经将IL-10 作为一种生物制剂用于RA 的治疗。而TGF-β 既可以诱导Treg 细胞分化,下调免疫应答,又可以抑制Th1 细胞功能,促进Th17 分化[17]。
研究表明,PGE2可通过EP2/EP4 信号和cAMP途径抑制CD4+T 细胞IL-10 生成[5],促进IFN-γ和IL-17 生成促进免疫炎症反应[5,6];又可抑制巨噬细胞TNF-α 表达,促进IL-6 生成发挥抗炎作用[7]。PGE2究竟发挥促炎作用还是抗炎作用依赖于不同的疾病和模型、不同的受体亚型、不同的细胞及其不同的微环境等而异。本实验中,CIA 模型组小鼠B 细胞IFN-γ 表达增加,IL-4 表达降低,TNF-α 和IL-6 表达明显增高。EP2 阻断剂可以降低IFN-γ、TNF-α 和IL-6 的表达水平,而促进IL-4和IL-10 的表达;EP4 阻断剂可以抑制IFN-γ、TNF-α 和IL-6 的表达水平,而促进TGF-β 和IL-10的表达。表明PGE2受体EP2 和EP4 介导了CIA 小鼠B 细胞内细胞因子的生成,发挥了促炎作用,推测PGE2通过调节EP2/EP4 受体途径有可能改善关节炎的症状。
[1] 刘美玲,张一娜,裴立春,等.前列腺素E 受体1 在缺氧性神经细胞死亡中的作用[J]. 中国病理生理杂志,2010,26(5):885-888.
[2] Tsuboi K,Sugimoto Y,Ichikawa A. Prostanoid receptor subtypes[J]. Prostaglandins Other Lipid Mediat,2002,68-69:535-556.
[3] McCoy JM,Wicks JR,Audoly LP. The role of prostaglandin E2 receptors in the pathogenesis of rheumatoid arthritis[J]. J Clin Invest,2002,110(5):651-658.
[4] Honda T,Segi-Nishida E,Miyachi Y,et al. Prostacyclin-IP signaling and prostaglandin E2-EP2/EP4 signaling both mediate joint inflammation in mouse collagen-induced arthritis[J]. J Exp Med,2006,203(2):325-335.
[5] Boniface K,Bak-Jensen KS,Li Y,et al. Prostaglandin E2 regulates Th17 cell differentiation and function through cyclic AMP and EP2/EP4 receptor signaling[J]. J Exp Med,2009,206(3):535-548.
[6] Yao C,Sakata D,Esaki Y,et al. Prostaglandin E2-EP4 signaling promotes immune inflammation through TH1 cell differentiation and TH17 cell expansion[J]. Nat Med,2009,15(6):633-640.
[7] Akaogi J,Yamada H,Kuroda Y,et al. Prostaglandin E2receptors EP2 and EP4 are up-regulated in peritoneal macrophages and joints of pristane-treated mice and modulate TNF-α and IL-6 production[J]. J Leukoc Biol,2004,76(1):227-236.
[8] Chen BC,Liao CC,Hsu MJ,et al. Peptidoglycan-induced IL-6 production in RAW 264.7 macrophages is mediated by cyclooxygenase-2,PGE2/PGE4receptors,protein kinase A,IκB kinase,and NF-κB[J]. J Immunol,2006,177(1):681-693.
[9] Edwards JC,Szczepanski L,Szechinski J,et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis[J]. N Engl J Med,2004,350(25):2572-2581.
[10] Lund FE. Cytokine-producing B lymphocytes-key regulators of immunity[J]. Curr Opin Immunol,2008,20(3):332-338.
[11] Cao Y,Doodes PD,Glant TT,et al. IL-27 induces a Th1 immune response and susceptibility to experimental arthritis[J]. J Immunol,2008,180(2):922-930.
[12] Skapenko A,Leipe J,Lipsky PE,et al. The role of the T cell in autoimmune inflammation[J]. Arthritis Res Ther,2005,7(Suppl 2):S4-S14.
[13] 谢建民,王好问,陆才生. TNF-α 上调单核巨噬细胞MMP-9 的活性与类风湿关节炎关节破坏的关系[J].中国病理生理杂志,2009,25(6):1181-1185.
[14] Llanos C,Soto L,Sabugo F,et al. The influence of-238 and-308 TNF α polymorphisms on the pathogenesis and response to treatment in rheumatoid arthritis[J]. Rev Med Chil,2005,133(9):1089-1095.
[15] Nishimoto N. Cytokine signal regulation and autoimmune disorders[J]. Autoimmunity,2005,38(5):359-367.
[16] Fillatreau S,Sweenie CH,Mcgeachy MJ,et al. B cells regulate autoimmunity by provision of IL-10[J]. Nat Immunol,2002,3(10):944-950.
[17] Santarlasci V,Maggi L,Capone M,et al. TGF-β indirectly favors the development of human Th17 cells by inhibiting Th1 cells[J]. Eur J Immunol,2009,39(1):207-215.

