荔枝核降血糖有效部位的研究(一)
姜振国,任 ,林 ,徐多多,潘 志,高其品
(长春中医药大学,吉林 长春 130117)
糖尿病是严重威胁人类健康的慢性病之一,其发病率仅次于心脑血管疾病、癌症而居第三位[1]。中药荔枝核为无患子科植物荔枝Litchi chinensis Sonn.的干燥成熟种子。研究[2]表明,荔枝核具有多种药理作用,临床治疗肝脏疾患、糖尿病、肿瘤等方面具有较好疗效。在前人工作的基础上,进一步研究荔枝核降血糖作用,并对其化学性质进行深入分析。为进一步研究构效关系和新药开发打下基础。
1 实验材料
1.1 实验动物 Wistar大鼠40只,雌雄各半,体质量(220±20)g,购于长春高新医学动物实验研究中心,合格证:SCXK(吉)2003-0004。
1.2 药材及试剂 荔枝核(市场购);0.1mol/L柠檬酸-柠檬酸钠缓冲液(北京北化精细化学品有限公司);盐酸二甲双胍片(河南兴源制药有限公司);STZ(上海蓝季科技发展有限公司);α-葡萄糖苷酶(α-glucosidase,EC3·2·1·20,Type)(Sigma公司);4-硝基苯-α-D-吡喃葡萄糖苷(4-Nitrophenyl-α-D-glucopyranoside,PNPG,EC223-189-3)(Sigma公司);拜糖平(拜耳公司)。
1.3 实验仪器 安妥超越Optium Xceed血糖仪(美国雅培公司);3型酶标仪(美国热电);PHS-25数显pH计(上海精密科学仪器有限公司)。
2 实验方法
2.1 荔枝核各部位的提取和分离 取荔枝核药材50kg,粉碎,加8倍量的95%乙醇加热回流提取4次,每次6h,滤过,合并提取液,滤液浓缩、干燥得95%乙醇提取浸膏(LCF)。将醇提浸膏用10倍量水溶解,加入95%的乙醇使其乙醇含量为80%,静置过夜,离心,上清液回收乙醇至无醇味,经氯仿脱脂后,用水饱和正丁醇萃取,合并萃取液,回收正丁醇至无醇味,浓缩后得水饱和正丁醇萃取部位(BF)。将BF加4倍量蒸馏水溶解5次,合并水溶液,浓缩后得水溶部位(BFWD),沉淀干燥后得水不溶部位(BFWI)。
2.2 荔枝核各部位对α-葡萄糖苷酶抑制作用
2.2.1 样品液的制备 取干燥至恒重的各提取物适量,精密称定,加0.067mol/L磷酸钾缓冲液(pH 6.8)制成每毫升含1mg的溶液,按所需样品浓度倍比稀释。
2.2.2 α-葡萄糖苷酶活性测定方法 根据Pierre等[3]方法反应体系以PNPG为底物,在96孔板中加入样品溶液40μL、0.007 1mg/mL a-D-葡萄糖苷酶溶液40μL,37℃保温5min后,加入0.150 8mg/mL PNPG溶液20μL,反应30min,用0.1mol/L Na2CO3溶液100μL终止反应,于波长405nm处测定吸光度。酶活性抑制率=A空白-(A样品-A背景)A空白×100%。A空白:不加样品反应后的吸收值;A样品:加入样品反应后的吸收值;A背景:只加样品的吸收值。
2.3 荔枝核95%乙醇提取物(LCF)对Ⅱ型糖尿病大鼠的降血糖作用
2.3.1 实验方法 40只SD大鼠,随机分笼饲养,饲养1周适应环境。喂高糖高脂饲料4周后,禁食,测空腹血糖,一次性腹腔注射1%链尿菌素(STZ),30mg/kg体质量(现配),分别测给药后24、72h断尾取血血糖,取血糖值>7.8mmol/L的大鼠重新分组[4-5]选取造模成功大鼠,随机分组,空白组正常饲料喂养,模型组及给药组高脂高糖饲料喂养,采用固定时间灌胃给药方式进行,二甲双胍(0.1g/kg体质量),荔枝核醇低剂量组(LCFL)(160mg/kg体质量),荔枝核醇高剂量组(LCFH,300mg/kg体质量),模型组、生理盐水组分别给等量蒸馏水。
2.3.2 检测指标 观察高脂高糖糖尿病模型大鼠体征变化,检测给药2周后血糖变化。
2.4 BF、BFWD和BFWI总糖、总皂苷、总酚的含量测定
2.4.1 BF、BFWD和BFWI的总糖含量测定
2.4.1.1 标准曲线的制备 取干燥至恒重的葡萄糖适量,精密称定,加水制成每毫升含0.1mg的对照品溶液。分别吸取对照品溶液0、20、40、60、80、100μL置具塞试管中,分别加水使体积均为1mL后,再加入5%苯酚试液1.0mL,摇匀,迅速滴加浓硫酸5.0mL摇匀,放至室温;以0管作为空白对照,用紫外-可见分光光度计于490nm处测定吸收度。
2.4.1.2 样品液的制备 分别取干燥至恒重的BF、BFWD和BFWI 25mg置500mL容量瓶中,精密称定,加水溶解至刻度,摇匀,按照上述方法测定吸收度。
2.4.2 BF、BFWD和BFWI的总皂苷的含量测定
2.4.2.1 标准曲线绘制 根据陈衍武等[6]的方法,取干燥至恒重的人参皂苷Re,精密称定,加水制成每毫升含0.1mg的对照品溶液。分别吸取对照品溶液10、20、40、80、120、160、180、240μL人参皂苷Re对照液于具塞试管中,水浴挥干溶剂,加入5%香草醛-冰醋酸溶液0.2mL和高氯酸0.8mL,60℃水浴加热15min,立即以冰水冷却5min,加入5mL冰醋酸,摇匀,静置10min后,于λ=550nm处,测定吸光度。
2.4.2.2 样品液的制备 取干燥至恒重的BF约25mg置500mL容量瓶中,精密称定,加甲醇溶解至刻度,摇匀,精确量取样品,按照上诉方法测定吸收度。
2.4.3 BF、BFWD和BFWI总酚的含量测定
2.4.3.1 没食子酸标准曲线的制备 根据杨光明等[7]的方法,配置Folin-Ciocalteu试剂,置于冰箱中可以长期保存。取干燥至恒重的没食子酸精密称定,加水制成每毫升含0.1mg的对照品溶液。分别吸取对照品溶液以没食子酸为对照品制作标准曲线分别精密吸取对照品溶液0、0.1、0.2、0.3、0.4mL置于25mL量瓶中,向量瓶中依次加入10.0mL蒸馏水,再各加入Folin-Ciocalteu显色剂2.0mL,充分振荡后静置6~8min,分别加入15%Na2CO3溶液2.0mL,摇匀,在室温下避光放置反应2h。用分光光度计在波长765nm处测定吸光度A。
2.4.3.2 样品液的制备 取干燥至恒重的BF 19.6mg置25mL容量瓶中,加甲醇稀释至刻度,摇匀,使其浓度相当于784μg/mL的样品液供分析用。按照上诉方法测定吸收度。
3 结果
3.1 荔枝核95%乙醇提取物(LCF)对α-葡萄糖苷酶抑制作用 见图1。
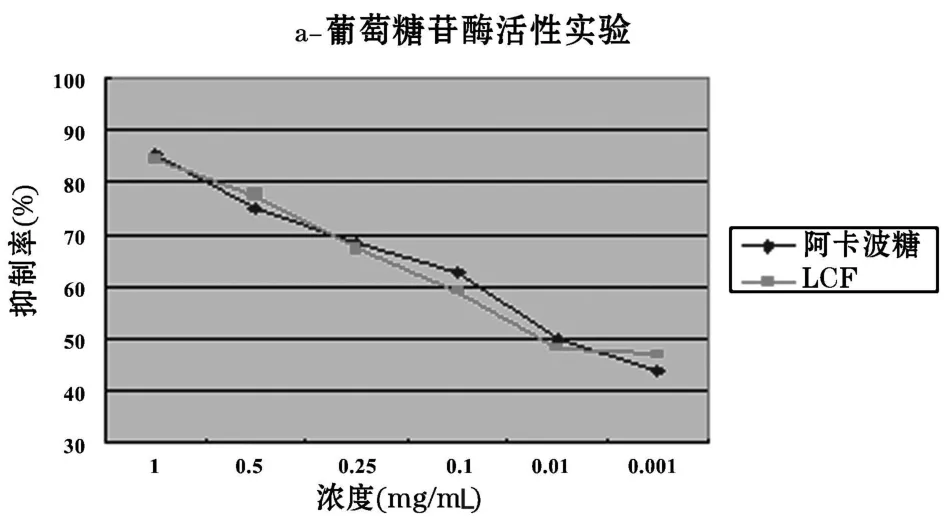
图1 LCF对α-葡萄糖苷酶抑制作用
图1表明:LCF的抑制率与阳性药(阿卡波糖)的抑制率在相同浓度下基本相同,LCF对酶的抑制活性呈剂量依赖关系。
3.2 LCF对高脂高糖糖尿病模型大鼠血糖的影响 见表1。
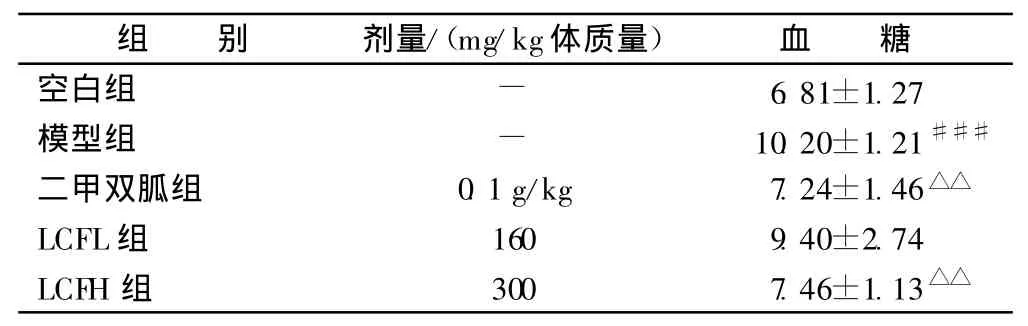
表1 对各组糖尿病大鼠血糖的影响 mmol/L
3.3 荔枝核各部位对α-葡萄糖苷酶抑制作用结果 取各提取物的浓度分别为0.001、0.01、0.1、0.25、0.5、1mg/mL时,测定酶抑制活性。结果见图2。
图2表明:LCF的抑制率与阳性药(阿卡波糖)的抑制率在相同浓度下基本相同,但随着对抑制组分的逐步纯化,在相同浓度下各纯化部位抑制率均高于阿卡波糖。其中在各浓度下BFWI的抑制率最高。
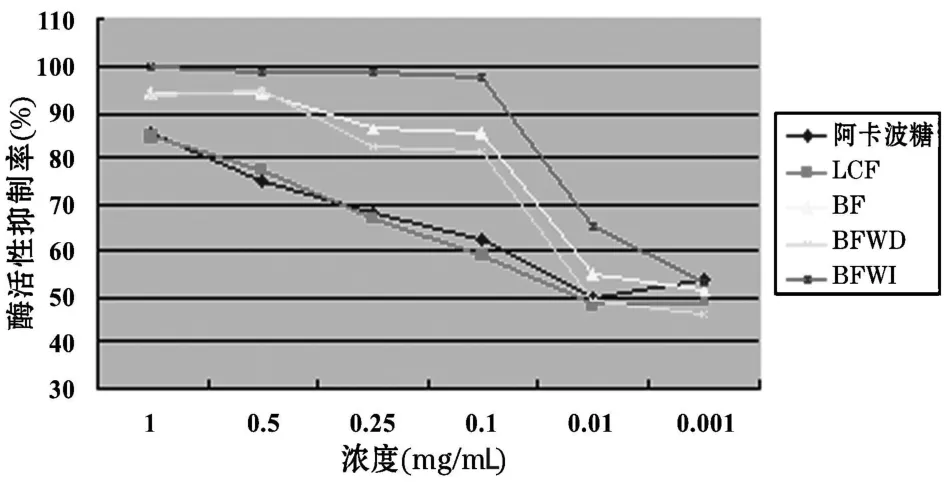
图2 各组分对α-葡萄糖苷酶抑制作用
3.4 BF、BFWD和BFWI的总糖、总皂苷、总酚的含量测定结果
3.4.1 总糖含量 葡萄糖标准曲线的绘制配制葡萄糖标准溶液,以浓度为横坐标,吸光值为纵坐标绘制葡萄糖标准曲线,建立回归方程:A=0.078C+0.011(r=0.995 4),根据回归方程,求得各部位的总糖含量见表2。

表2 各部位含量测定结果的比较 %
3.4.2 总皂苷含量 人参皂苷Re标准曲线的绘制配制人参皂苷Re标准溶液,以浓度为横坐标,吸光值为纵坐标绘制人参皂苷Re标准曲线,建立回归方程:A=0.004 2C-0.051 5(r=0.997 6),根据回归方程,求得各部位总皂苷含量见表2。
3.4.3 总酚含量 没食子酸标准曲线的绘制配制没食子酸标准溶液,以浓度为横坐标,吸光值为纵坐标绘制没食子酸标准曲线,建立回归方程:A=0.005 57C+0.005(r=0.999 0)。根据回归方程,求得各部位的总酚含量,见表2。
4 讨论
实验结果表明,LCF对α-葡萄糖苷酶有很强的抑制作用,对Ⅱ型糖尿病大鼠也有很强的降血糖作用,因此选择α-葡萄糖苷酶活性抑制实验作为活性跟踪的手段。本实验中,各提取物与阳性对照阿卡波糖的抑制率比较为BFWI>BF>BFWD>LCF,即随着对活性组分的逐步纯化,活性部位逐步集中,从而证明选用本实验的提取方法特别是对BF采用水溶解的分离方法是简单、有效的。通过对它们化学性质的研究,BF、BFWD和BFWI的总糖和总酚含量均无明显差别,而总皂苷的含量差别较大,分别为21.96%、6.54%、46.06%。综上可以推断皂苷类物质可能是抑制α-葡萄糖苷酶活性的有效组分。本项研究工作确定了荔枝核的降血糖有效部位和该部分的化学性质,对其化学成分的分离、鉴定工作正在进行。
[1]刘霞,冯长根.酶抑制剂在抗糖尿病药物中的应用研究[J].中国医学杂志,2003,38(2):89-91.
[2]肖培根.新编中药志:2卷[M].北京:化学工业出版社,2002:432.
[3]Pierre C,Roland R,Tremblay D.P-Nitrophenol-α-glucopyramosidas substrate for measurement of maltase activity in human seme[J].J Clin Chem,1978,24:208-211.
[4]倪红霞.高糖高脂饮食诱导的大鼠Ⅱ型糖尿病模型[J].北华大学学报:自然科学版,2006,7(5):40.
[5]沈亚非,徐焱成.高糖高脂膳食和链脲佐菌素诱导Ⅱ型糖尿病模型的建立[J].实用诊断与治疗杂志,2006,20(9):51.
[6]陈衍武,武可泗,陈建宗.荔枝核皂苷含量测定方法[J].陕西中医学院学报,2007,30(3):45-46.
[7]杨光明,王栋,张芳芳,等.镰形棘豆总黄酮和总酚的含量测定[J].药学与临床研究,2009,17(5):376-379.

