急性心肌梗死后快速延迟整流K+通道基因表达的变化
李秀娟,黄从新,丁家望,杨 俊,吴 辉,李 莉,李 松,李稳慧,姜玉蓉
(1.三峡大学第一临床学院/宜昌市中心人民医院心内科,湖北宜昌 443003;2.武汉大学人民医院心内科,武汉 430000)
K+通道对心肌细胞的电生理稳定性调控起着非常重要的作用[1-2]。人类ether--go-go相关基因HERG基因编码心脏快速延迟整流K+电流Ikr,Ikr是心肌细胞动作电位3期快速复极的主要电流,在心脏动作电位复极化过程中发挥重要作用。HERG/KCNH2及其调节亚基KCNE2基因突变可引起LQTs 综合征[3-4],心肌梗死(MI)并发的心律失常是导致病情恶化和死亡的主要原因之一。MI后心室肌膜多种K+通道基因表达的变化已成为近年研究热点,但是关于MI后HERGK+通道基因表达变化的研究有限,尤其是对大型动物如猪的研究尚属少见。本研究以开胸冠状动脉(冠脉)结扎法制备猪急性心肌缺血模型,用RT-PCR 方法观察MI后左心室梗死边缘区3层心肌快速延迟整流K+通道基因HERG/KCNH2及其调节亚基KCNE2基因的mRNA表达改变及其意义,旨在探讨急性心肌梗死(AMI)后早期室性心律失常发生的分子机制。
1 材料与方法
1.1材料 普通级小型猪,3~5 月龄,体质量10~15 kg(华中农业大学动物中心提供),雌雄不限。术前常规检查心电图,心电图异常者剔除,随机分为假手术组(SH组)和模型组(MI组),共16只动物。
1.2MI动物模型的建立 所有的实验动物均术前禁食、禁饮12 h。术前称质量,予以3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,在口腔明视下行气管插管,以呼吸机机械通气,潮气量10~15 mL/kg,给氧3~5 L/min,频率20~25次/分钟。常规消毒铺巾,于胸骨正中打开胸腔,纵行切开心包膜,充分暴露心脏,并将心包膜缝合于胸壁呈吊篮状。仔细分离冠状动脉,于冠状动脉左前降支(LAD)远端1/3~1/2处穿入4号缝合线,AMI组结扎2 h,再松解恢复前降支血流,建立AMI模型,其成功标志为:心电图ST段弓背向上抬高,直视下可见被结扎血管供血区心肌变为苍白色。SH组也重复上述步骤,但冠状动脉下只穿线,不结扎。逐层缝合心包、胸壁,并放置引流管.术后精心喂养动物至实验终点。取结扎后存活的猪,分入MI组,建立SH组,所有猪均接受相同的饲养条件。
1.3标本的采集与保存 MI组和SH组的每只猪于术后24 h,用3%的戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,迅速取出心脏置于4 ℃生理盐水漂洗除去血液,依照Gao等[5]的方法留取左心室梗死边缘区3层心肌(SH组取对应位置心肌),迅速置-70 ℃低温冰箱保存待测。
1.4心肌总RNA的提取和KCNH2及KCNE2 mRNA检测 取50~100 mg猪心肌,按照Trizol(Invitrogen公司)RNA 抽提试剂盒说明书的步骤进行,提取组织总RNA,紫外光检测样品吸光度,A260/A280为1.95~2.10。应用RT-PCR法(试剂盒购于大连宝生物工程有限公司)检测mRNA的表达,50 ℃ 30 min,94 ℃预变性2 min,PCR扩增29个循环(94 ℃变性30 s,退火30 s,72 ℃延伸4 min)。KCNH2引物(257 bp):上游5′-TGA AGG AGA CGG AGG AG-3′,下游5′-CAG AGC CGA AGA TGA GC-3′,(退火温度57.2 ℃);KCNE2引物(157 bp):上游5′-TAC TAC GTC ATC CTG TAC C-3′,下游5′-TGA CTC TTG TAT TTC CCT TGC -3′,(退火温度56.0 ℃);β-actin引物(498 bp):上游5′-GGC TAC AGC TTC ACC ACC AC-3′;下游5′-TACT CCT GCT TGC TGA TCC AC-3′(退火温度60 ℃);1.5%琼脂糖电泳分析PCR产物,应用凝胶成像系统观察记录结果,用光密度扫描计算KCNH2电泳条带灰度积分/B-actin电泳条带灰度积分和KCNE2电泳条带灰度积分/B-actin电泳条带灰度积分,进行半定量分析。
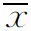
2 结 果
2.1动物存活情况 AMI组中9只存活6只,另外3只于术中发生室颤,经心内除颤无效死亡;SH组中7只,1只因麻醉意外死亡,其余6只存活。
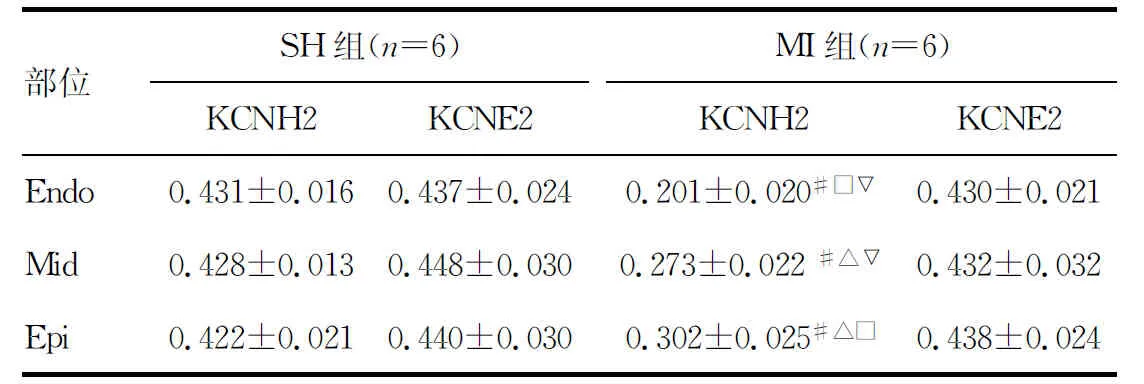
表1 两组不同部位KCNH2及KCNE2
#:P<0.05,与SH组比较;△:P<0.05,与MI组Endo比较;□:P<0.05,与MI组Mid比较;▽:P<0.05,与MI组Epi比较。
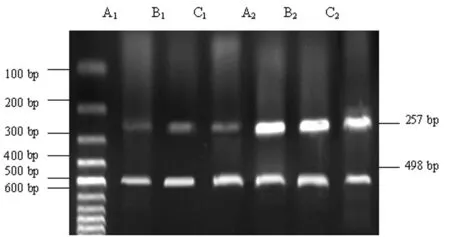
图1 MI组和SH组梗死边缘区3层心肌的KCNH2 mRNA(257 bp)与β-actin(498 bp)RT-PCR电泳图
2.2两组猪心肌KCNH2和KCNE2基因mRNA表达的变化 KCNH2和KCNE2基因表达在SH组左心室内层(Endo)、中层(Mid)和外层(Epi)心肌间没有差异,与SH组比较,AMI后梗死边缘区3层心肌KCNH2 mRNA表达均明显下降(P<0.05),而且3层心肌间的基因表达呈不均一性(P<0.05),KCNE2 mRNA表达量无显著性差异,结果见表1,图1、2。

MI组,A1:Endo;B1:Mid;C1:Epi。SH组,A2:Endo;B2:Mid;C2:Epi。
图2 MI组和SH组梗死边缘区3层心肌的KCNE2 mRNA(157 bp)与β-actin (498 bp)RT-PCR电泳图
3 讨 论
IKr是HERG/KCNH2和KCNE2表达的两种蛋白质共同形成功能性K+通道,KCNH2本身单独可产生一种小的快速激活外向K+电流,KCNE2本身并不能产生任何离子电流,但它的存在主要影响通道的门控性和药理学性质。目前,关于HERG及其调节亚基KCNE2基因突变可引起LQTs综合征的研究较多,但在MI后HERG及其调节亚基KCNE2基因的表达有何改变,这些改变在心律失常中所起的确切作用尚不是很清楚。
有研究表明,在心肌缺血初始的短时间内,先出现IK的抑制,此为细胞的代偿性保护性反应被激发的表现,随缺血持续出现IK增大(主要是IKr)则为损伤性反应的表现。心肌缺血时时间依赖性K+流(包括IK)和KATP的开放又是造成细胞内K+丢失外流的主要途径[6],由此形成恶性循环,持续缺血最终使细胞内外K+平衡完全失调。同时由于IK的增大,可加快心肌细胞复极,使动作电位时程及ERP缩短,心肌细胞电生理特性发生改变。由此可见,MI后IKr电流的电生理特性发生了改变,这可能是心肌梗死后易发心律失常的机制之一。本研究发现,KCNH2和KCNE2基因表达在SH组左心室Endo、Mid和Epi心肌间没有差异,这与Arun等[7]及Kaori等[8]对快速延迟整流K+通道在左室心肌3层间表达的研究结果相一致。而MI 24 h后KCNH2 mRNA的表达量在边缘区降低,KCNH2 mRNA表达水平的下调,可以造成有功能的快速延迟整流K+通道的数目减少,有助于IKr电流的减小,可能是心肌细胞在恢复期的一种代偿性保护性反应,使膜K+电流变小,K+外流减少,促进急性缺血所造成的细胞内外K+平衡失调的恢复。但是IKr电流的减小,可使心室肌细胞APD延长,心肌细胞电生理特性改变,易于形成触发活动,产生心律失常。同时KCNH2 mRNA的表达在左心室梗死边缘区Endo、Mid 和Epi心肌之间产生了明显的差异,使空间异质性增大,可导致复极不均一,复极离散度增大,易于形成折返发生心律失常。
虽然本研究显示KCNE2 mRNA表达水平在两组间没有变化,而且KCNE2本身并不能产生任何离子电流,但它的存在影响通道的门控性和药理学性质,当KCNH2 mRNA的表达在左心室梗死边缘区Endo、Mid和Epi心肌之间产生了明显差异时,KCNE2 mRNA表达水平没有产生相应的变化,使IKr在整体行为,对细胞外K+及抗心律失常药物的敏感性和通道的失活速率等方面发生改变,也可使空间异质性增大,导致复极不均一,复极离散度增大,易于形成折返发生心律失常;同时也可增加了电流的不稳定性和发生心律失常的易感性。
因此,K+通道KCNH2 mRNA表达的下调和在不同部位改变的不均一可能在电生理不稳定的维持和(或)恶化方面起一定的作用,但这种变化确切意义和KCNH2和KCNE2基因两者之间的相互作用还有待进一步深入研究。
[1]Olaf P.Ins and outs of cardiac voltage-gated potassium channels[J].Current Opinion Pharmacology,2009,(3):311-315.
[2]Shimizu W,Horie M.Phenotypic Manifestations of Mutations in Genes Encoding Subunits of Cardiac Potassium Channels[J].Circ Res,2011,109(1):97-109.
[3]Roden Dan M.Long-QT syndrome[J].N Eng J Med,2008,358 (2):169-176.
[4]Sanguinetti MC.ERG1 channelopathies[J].Pflügers Archiv Eur J Physiol,2010,60(2):265-276.
[5]Gao Z,Sun HY,Lau CP,et al.Evidence for cystic fibrosis transmembrane conductance regulator chloride current in swine ventricular myocytes[J].J Mol Cell Cardiol,2007,42(1):98-105.
[6]Rodriguez B,Ferrero JM Jr,Trénor B,et al.Mechanistic investigation of extracellular K+accumulation during acute myocardial ischemia:a simulation study[J].Am J Physiol Heart Circ Physiol,2002,283(2):H490-500.
[7]Arun S,Yoshinori N,Terentyev D,et al.Repolarization abnormalities and afterdepolarizations in a canine model of sudden cardiac death[J].Am J Physiolo Regul Integr Compa Physiol,2008,295(5):R1463-1472.
[8]Soma K,Nagaoka K,Kuwahara M,et al.Abundant expression of KCNE1 in the left ventricle of the miniature pig[J].Heart Vessels,2011,26(3):353-356.

