超顺磁氧化铁纳米粒子特性研究
赵戎蓉,鲁芳
基于特殊的物理和化学性质,纳米材料目前已成为表面工程学研究的理想材料。纳米粒子作为肿瘤治疗中的靶向给药载体可以提高药物的靶向作用。因此,对纳米粒子的修饰,将促进其在生物医学中的应用。以超顺磁性粒子(superparamagnetic iron oxide nanoparticles,SPION)为载体的微粒靶向递送系统已成为比较热门的研究方向[1]。
SPION 由于其磁性核心的特性,可以通过外部磁铁有针对性地到达特定位置。20 世纪 70 年代末期,外部磁场控制磁性载体的观点被认同,随后以各种磁性纳米和磁性微粒子作为载体,用于药物在体内的靶向投递的研究相继见诸报道[2]。SPION 由两部分组成:磁性核心(通常是 Fe3O4、Fe2O3和 γ-Fe2O3)和具有生物相容性的聚合物或多孔生物相容聚合物涂层。该涂层可以被功能化羧基、生物素、抗生物素蛋白、碳二亚胺和其他分子修饰[3],从而起到抗原-抗体偶联以及靶向作用。此外,聚合物涂层还可以通过共价结合,吸附或包埋药物实现药物的投递[4]。到目前为止,载体优化的目标是:①减少药物的细胞毒性,从而降低药物副作用;②减少用量,达到靶向给药目的。
1 SPION 的稳定性及表面修饰
由于诊断和治疗的需要,SPION 已在生物学和医学领域被广泛应用。SPION 具有胶体特性,稳定性取决于粒子的大小及粒子与界面的空间位阻和库仑排斥作用。SPION颗粒足够小能够抵消引力造成的沉降,在中性 pH 环境和生理盐水中也很稳定。另一方面,在制备和合成后期进行生物相容性聚合物涂层,既能避免生物降解,也起到防止粒子聚集,提高其稳定性的目的。
SPION 稳定性主要由 3 个因素控制:疏水/亲水性、磁性和范德华力。由于纳米粒子的疏水作用,SPION 往往聚集成微米簇,加之磁偶极相互作用,微米簇将进一步聚集。在外部磁场下,这些微米簇可能会出现进一步的磁化从而增加聚集[5]。SPION 的稳定性关系到药物的释放效果,磁性和范德华力是 SPION 固有的性质,较难改变。因此,通过表面修饰调节其疏水/亲水性就显得至关重要。明胶、右旋糖酐、聚氨基酸、淀粉、白蛋白、脂质体、壳聚糖、乙基纤维素等天然分散剂已被广泛用于水介质中对 SPION 的分散。表面修饰分子应该具有生物相容性和生物降解性。表面活性剂分为疏水性、亲水性和双亲性 3 类,其中油酸、月桂酸、烷烃磺酸和烷烃膦酸等表面活性分子具有双亲性,可提高 SPION 在溶液中的稳定性,常用作 SPION 的表面修饰[6]。十六烷、甲苯、正己烷等疏水基表面活性剂分子修饰SPION 后易溶于有机溶剂,但无法实现其在生物体中的应用。所以,用亲水表层包埋疏水表层,从而获得双亲聚合物外壳,则可改变 SPION 的生物相容性[7]。Wang 等[8]将疏水表面涂层的 SPION 插入 α-环糊精中,则 SPION 就能从有机相扩散至水相。各种聚合物,如乙烯联合醋酸乙烯酯(poly ethylene-co-vinyl acetate)、聚乙烯吡咯烷酮(PVP)、聚乳酸、乙醇酸、聚乙二醇(PEG)和聚乙烯醇(PVA)可作为水相中纳米粒子的涂层材料。Euliss 等[9]采用聚乙二醇反向乳液方法并以 Disperbyk 120 和四甲基氢氧化铵进行表面修饰,从而合成了亲水性磁性纳米颗粒。此外,Park等[10]报道在超临界水中用石墨碳包裹 Fe2O3和 γ-Fe2O3,从而实现其在水介质中的稳定性。
氧化铁被公认为是无毒的,但部分涂层材料具有毒副作用,故涂层材料的选择十分重要。表 1 介绍了几种涂层材料,以下着重介绍二氧化硅在表面修饰中的作用。由于二氧化硅的亲水性,经硅涂层后的纳米粒子能够均匀分散在水溶液中,且其具有生物相容性。Philipse 等[11]首先报道了用溶胶凝胶法制备非晶硅涂层磁性纳米。在高于二氧化硅等电点(pH 2)时,硅涂层带负电荷,且二氧化硅羟基(硅羟基组:Si-OH)可与有机物共价键连接,通过静电作用分离生物分子。Bruce 和 Sen[12]报道了大规模合成无定形硅用于磁性纳米颗粒修饰。在 pH 13 条件下,将硅酸缓慢加入磁铁矿溶液中,用稀盐酸调 pH 值至 10。核-壳磁铁纳米颗粒包被一层薄的硅壳,通过控制硅酸与磁铁矿溶液的比例,确定DNA 的结合和洗脱。Sen 等[13]用表面加热法制备球形和管状多孔的二氧化硅磁性颗粒用于细胞、核酸的提取。近日,Deng 等[14]用加热法制备微孔 SPION 用于胰蛋白酶的固定。
2 形状、大小、粒度分布及表面电荷
SPION 形状、大小和粒度分布是其生物应用的重要参数。Mahmoudi 等[15]采用多场有限元模型研究外加磁场下血管内不同大小和形态的 SPION 的运动情况。仿真结果表明,磁场强度和 SPION 物理性质均能影响其在血管运动中的波动和幅度,进而推测,具有较小波动和较宽幅度的速度场更有利于药物投递。
Varanda 等[16]报道,SPION 磁化强度、表面曲率与颗粒大小呈线性。小于 100 nm 的磁性颗粒具有较高的有效表面积(更容易吸附)、较低的沉积速率,有利于向组织扩散,并且能逃离网状内皮系统(RES)的吞噬,从而延长其在循环系统中的保留时间,又能达到避免毛细血管栓塞的效果。其中直径大于 10 nm 的颗粒在正常生理条件下无法穿透血管内皮细胞,但在病理条件下,能穿透如炎症或肿瘤等病理部位。
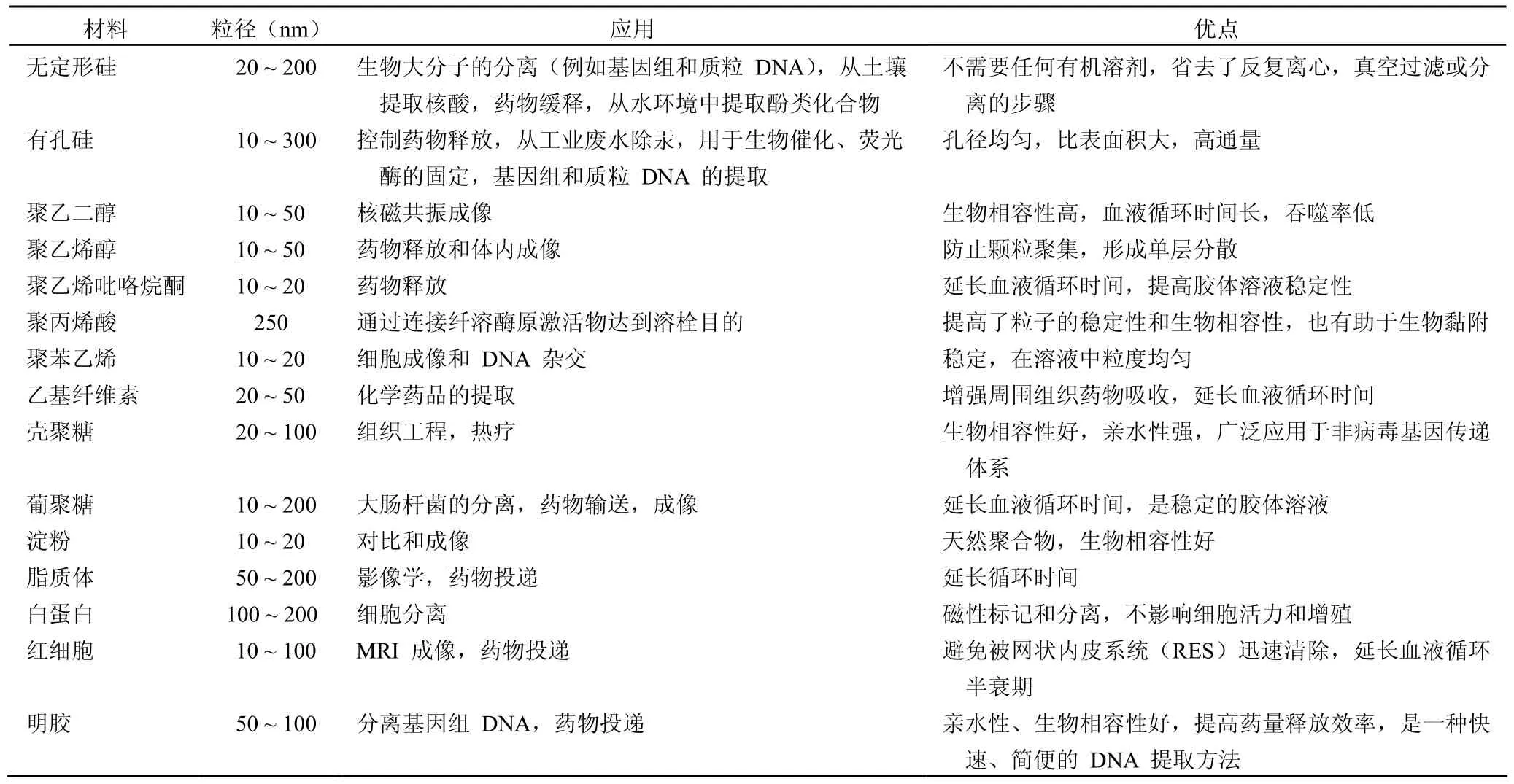
表 1 用于 SPION 的修饰材料
当载药纳米粒子进入血液循环,血浆蛋白对其的吸附作用与粒子的大小、形态和表面电荷相关。表面以聚乙二醇和叶酸修饰的载药粒子已被证实能有效地抑制体内蛋白质的吸附。由于组织巨噬细胞对入侵微生物和颗粒的高度敏感,大于 200 nm 的颗粒容易被内皮吞噬系统吞噬,因此不适合作为载体[17]。大小介于 10 ~ 100 nm 的 SPION 是最有效的药物输送载体[18]。也有研究报道,颗粒较小且具有较高亲水性的纳米颗粒,能延长在生物体内存留时间[19]。Lee 等[20]报道了聚[3-(三甲硅基丙基)甲基丙烯酸-r-聚乙二醇甲基丙烯酸]涂层的 SPION 可作为稳定的抗蛋白质的磁共振成像探针。结果同时表明,经聚合物涂层的 SPION 循环周期延长。
最近,Osaka 等[21]报道了在不同细胞系中 SPION 表面电荷与细胞吸收效率的关系。针对人乳腺癌细胞,带有正电荷 SPION 相比带负电荷的 SPION 更容易被细胞吞噬;对于脐静脉内皮炎细胞,正负电荷的 SPION 被吞噬差异不大。因此,SPION 被摄取的原因不仅取决于其表面特性,还取决于摄取作用细胞的类型。
3 SPION 的毒性
Mahmoudi 等[22]对 PVA 修饰的 SPION 细胞毒性进行研究,选择的细胞株为小鼠成纤维细胞和人白血病细胞。结果表明,SPION 无毒性或毒性很小。另外,Karlsson等[23]研究了浓度为 20 和 40 mg/ml 的 SPION 在人肺癌细胞中的毒性,结果显示,SPION 既没有对 DNA 造成损伤,也没有在细胞内产生活性氧化物,但是检测出少量氧化DNA。另一项研究证实,SPION 对细胞周期的影响仅在G0/G1间隔期[24]。最近,Mahmoudi 等[25]观察到当 SPION作用细胞后胞内有气泡产生且细胞粒度增加。有人提出,自溶可能是导致细胞毒性的原因。在体外细胞毒性研究中,由于 SPION 对蛋白质的吸附,蛋白质有可能引起细胞毒性,进而导致判断错误。
由于 SPION 与蛋白质相互作用,使蛋白质结构发生变化,从而导致生物损伤,如纤维性颤动、产生新抗原位点、蛋白质功能缺失等。具体而言,SPION 作用的蛋白质变性可能会暴露新的抗原位点,导致一个新的免疫反应发生[26]。Cedervall 等[27]采用体积排阻色谱(SEC)、表面等离子体共振(SPR)和等温滴定量热法研究血浆蛋白与不同磁性粒子的结合/分解率和亲和力。Lynch 等[28]也试图确定和量化不同大小纳米系统与蛋白质连接的问题。上述方法对 SPION的体内实验有指导意义,有助于分析到底是 SPION 还是蛋白质引起的细胞毒性。
4 展望
磁性纳米材料具有无创或微创、靶向性强、生物相容性好、治疗效果好等优点,可用于疾病诊断和治疗中的多个环节,对癌症的早期诊断与治疗有着重要的意义。多功能磁性纳米生物材料的研究及其应用已逐渐成为国内外关注的热点,这些应用涉及到生物化学、电子学、磁学、生物学等学科,是多学科的交叉,目前在医药应用技术中,磁性技术已经成为其他技术的有力补充。
[1] Mahmoudi M, Simchi A, Imani M, et al. Templated growth of superparamagnetic iron oxide nanoparticles by temperature programming in the presence of poly (vinyl alcohol). Thin Solid Films,2010, 518(15):4281-4289.
[2] Alexiou C, Arnold W, Klein RJ, et al. Locoregional cancer treatment with magnetic drug targeting. Cancer Research, 2000, 60(23):6641-6648.
[3] Koneracká M, Kopčanský P, Timko M, et al. Direct binding procedure of proteins and enzymes to fine magnetic particles. J Mol Catalysis B Enzymatic, 2002, 18(1-3):13-18.
[4] Arbab AS, Janic B, Haller J, et al. In vivo cellular imaging for translational medical research. Curr Med Imaging Rev, 2009, 5(1):19-38.
[5] Hamley IW. Nanotechnology with soft materials. Angew Chem Int Ed Engl, 2003, 42(15):1692-1712.
[6] Gaihre B, Khil MS, Lee DR, et al. Gelatin-coated magnetic iron oxide nanoparticles as carrier system: drug loading and in vitro drug release study. Int J Pharm, 2009, 365(1-2):180-189.
[7] Pellegrino T, Manna L, Kudera S, et al. Hydrophobic nanocrystals coated with an amphiphilic polymer shell: a general route to water soluble nanocrystals. Nano Lett, 2004, 4(4):703-707.
[8] Wang Y, Wong JD, Teng X, et al. “Pulling” nanoparticles into water:phase transfer of oleic acid stabilized monodisperse nanoparticles into aqueous solutions of alpha-cyclodextrin. Nano Lett, 2003, 3(11):1555-1559.
[9] Euliss LE, Grancharov SG, SO'Brien S, et al. Cooperative assembly of magnetic nanoparticles and block copolypeptides in aqueous media.Nano Lett, 2003, 3(11):1489-1493.
[10] Park KC, Wang F, Morimoto S, et al. One-pot synthesis of iron oxide–carbon core–shell particles in supercritical water. Mater Res Bull, 2009, 44(7):1443-1450.
[11] Philipse AP, van Bruggen MP, Pathmamanoharan C. Magnetic silica dispersions preparation and stability of surface-modified silica particles with a magnetic core. Langmuir, 1994, 10(1):92-99.
[12] Bruce IJ, Sen T. Surface modification of magnetic nanoparticles with alkoxysilanes and their application in magnetic bioseparations.Langmuir, 2005, 21(15):7029-7035.
[13] Sen T, Sebastianelli A, Bruce IJ. Mesoporous silica-magnetite nanocomposite: fabrication and applications in magnetic bioseparations.J Am Chem Soc, 2006, 128(22):7130-7131.
[14] Deng Y, Deng C, Qi D, et al. Synthesis of core/shell colloidal magnetic zeolite microspheres for the immobilization of trypsin.Advanced Materials, 2009, 21(13):1377-1382.
[15] Mahmoudi M, Shokrgozar MA, Simchi A, et al. Multiphysics flow modeling and in vitro toxicity of iron oxide nanoparticles coated with poly (vinyl alcohol). J Physical Chem C, 2009, 113(6):2322-2331.
[16] Varanda LC, Jafelicci M, Tartaj P, et al. Structural and magnetic transformation of monodispersed iron oxide particles in a reducing atmosphere. J Appl Phys, 2002, 92(4):2079-2085.
[17] Moghimi SM, Hunter AC, Murray JC. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacological Reviews, 2001, 53(2):283-318.
[18] Gupta AK, Gupta M. Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials, 2005, 26(18):3995-4021.
[19] Moghimi SM, Hunter AC, Murray JC. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacol Rev, 2001,53(2):283-318.
[20] Lee H, Lee E, Kim do K, et al. Antibiofouling polymercoated superparamagnetic iron oxide nanoparticles as potential magnetic resonance contrast agents for in vivo cancer imaging. J Am Chem Soc,2006, 128(22):7383-7389.
[21] Osaka T, Nakanishi T, Shanmugam S, et al. Effect of surface charge of magnetite nanoparticles on their internalization into breast cancer and umbilical vein endothelial cells. Colloids Surf B Biointerfaces, 2009,71(2):325-330.
[22] Mahmoudi M, Simchi A, Milani AS, et al. Cell toxicity of superparamagnetic iron oxide nanoparticles. J Colloidd Interface Sci,2009, 336(2):510-518.
[23] Karlsson HL, Cronholm P, Gustafsson J, et al. Copper oxide nanoparticles are highly toxic: a comparison between metal oxide nanoparticles and carbon nanotubes. Chem Res Toxicol, 2008, 21(9):1726-1732.
[24] Mahmoudi M, Simchi A, Imani M. Cytotoxicity of uncoated and polyvinyl alcohol coated superparamagnetic iron oxide nanoparticles.J Phys Chem C, 2009, 113(22):9573-9580.
[25] Mahmoudi M, Simchi A, Imani M, et al. A new approach for the in vitro identification of the cytotoxicity of superparamagnetic iron oxide nanoparticles. Colloids Surf B Biointerfaces, 2010, 75(1):300-309.
[26] Nel AE, Mädler L, Velegol D, et al. Understanding biophysicochemical interactions at the nano-bio interface. Nat Mater,2009, 8(7):543-557.
[27] Cedervall T, Lynch I, Lindman S, et al. Understanding the nanoparticle protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles. Proc Natl Acad Sci U S A,2007, 104(7):2050-2055.
[28] Lynch I, Cedervall T, Lundqvist M, et al. The nanoparticle-protein complex as a biological entity; a complex fluids and surface science challenge for the 21st century. Adv Colloid Interface Scie, 2007,134-135:167-174.

