哇巴因抑制乳腺癌细胞增殖与雌激素受体亚型介导的信号通路有关
牛秀珑,王 越,徐瑞成
(中国人民武装警察部队后勤学院1.天津市职业与环境危害生物标志物重点实验室、2.免疫学教研室,天津 300162)
哇巴因是一种植物来源的强心苷类固醇(cardiotonic steroids,CSs),是细胞膜钠钾ATP酶(Na+,K+-ATPase,NKA)的特异性配体和抑制剂。近年来有证据显示,哇巴因尚有可能作用于雌激素受体(estrogen receptor,ER)发挥生物学活性。首先,哇巴因是一种类固醇衍生物,与几种ER配体如17β-雌二醇(17β-estradiol,E2)、乙炔雌二醇(ethinyl estradiol,EE)结构相似,即均具有一个共同的类固醇母核结构。其次,在调节NKA方面哇巴因与E2、EE的某些功能相似,如哇巴因与EE均可抑制几种组织的NKA活性[1-2]。以计算机为基础的排列分析表明ERα的323-395氨基酸序列与NKA的α亚单位部分相似[3],提示ERα的323-395序列是哇巴因潜在结合位点,类似序列也在ERβ上发现。同时,哇巴因[4]与E2[5]均可介导共同的信号转导通路,如PI3K/Akt通路等。此外,近期一项筛选研究表明,哇巴因尚具有抗雌激素活性[6]。
乳腺癌为雌激素依赖性肿瘤,其ER亚型ERα和ERβ的表达状态及比率是影响乳腺癌发生、发展及内分泌疗效的重要因素[7]。研究发现[8],人乳腺癌细胞也可表达NKA,低浓度哇巴因可抑制人乳腺癌细胞增殖[9]。本文选择兼有两种ER亚型表达的人乳腺癌细胞株MCF-7为研究对象,首先确定低浓度哇巴因对乳腺癌细胞增殖的抑制作用是否依赖于ER,在此基础上进一步探讨ER亚型在哇巴因介导的增殖抑制中的作用。本文可为阐明哇巴因等CSs药物抗乳腺癌治疗的机制奠定基础。
1 材料与方法
1.1 材料 人乳腺癌细胞株 MCF-7(ERαhigh/ ERβhigh)为本室保存;哇巴因购自美国Sigma公司,无水乙醇溶解成浓度为0.001 mol·L-1的贮存液,-20℃避光保存,实验时用无血清培养基稀释(乙醇终浓度控制在<0.1%);RPMI 1640培养基为美国Gibco公司产品;优质胎牛血清(FBS)购自中美合资兰州民海生物工程有限公司;纯ER阻断剂ICI 182,780、MTT、DMSO为美国Sigma公司产品;小干扰 RNA(siRNA)pGenesil-ERα-siRNA、pGenesil-ERβ-siRNA、pGenesil-scramble-siRNA(阴性对照)均以质粒pGenesil-1为载体,由武汉晶赛生物科技公司设计合成;脂质体LipofectamineTM2 000、G418为美国Invitrogen公司产品;BCA蛋白定量试剂盒、化学发光底物检测试剂盒购自美国 Pierce公司;抗ERα单克隆抗体、抗ERβ单克隆抗体(兔源性,1∶300稀释)购自加拿大Millipore公司;抗β-actin多克隆抗体(小鼠源性,1∶1 000稀释)购自美国Santa Cruz公司;HRP标记的羊抗兔二抗、羊抗小鼠二抗(1∶3 000稀释)购自美国KPL公司。
1.2 方法
1.2.1 MTT法检测细胞增殖活性 取对数生长期MCF-7细胞接种96孔板,接种密度为4×103/孔,37℃、5%CO2孵箱培养24 h后弃去培养液,更换含有1%FBS的培养液培养24 h使细胞同步化。加入不同终浓度的哇巴因(0.001、0.01、0.1、1、10、100、1 000、10 000 nmol·L-1)作用24 h,每个浓度设5个复孔,同时以药物稀释液为对照组。1 700 r ·min-1离心10 min,弃上清,加入MTT(0.5 g· L-1,PBS配制)100 μl/孔继续孵育4 h,离心弃上清后加入DMSO 100 μl/孔,振荡混匀,酶标仪测定波长为570 nm的吸光度值(A570)。计算细胞存活率/%=A实验组/A对照组×100%。
1.2.2 ER阻断剂处理细胞 细胞接种方法同上,取哇巴因作用明显的剂量(1、10、100、1 000 nmol· L-1),按上述方法行MTT检测,在加入哇巴因之前先加入终浓度为100 μmol·L-1的ER阻断剂ICI 182,780 37℃作用30 min,同时设立ICI 182,780药物稀释液为对照组。
1.2.3 RNA干扰技术沉默ERα或ERβ基因表达采用脂质体法分别将干扰ERα或ERβ基因表达的质粒,即 pGenesil-ERα-siRNA(简称 siERα)、pGenesil-ERβ-siRNA(简称siERβ)和无效干扰序列pGenesil-scramble-siRNA(简称HK,阴性对照)导入MCF-7细胞。3种质粒的 RNA干扰序列如下: siERα sense 5'-CTCATCCTCTCCCACATCA-3',antisense 5'-TGATGTGGGAGAGGGATGAG-3';siERβ sense 5'-TCCCTGCTGTGATGAATTA-3',antisense 5'-TAATTCATCACAGCAGGGC-3';HK sense 5'-GACTTCATAAGGCGCATGC-3',antisense 5'-GCATGCGCCTTATGAAGTC-3'。按照脂质体 LipofectamineTM
2 000说明书进行细胞稳定转染,转染后48h更换选择培养基(无抗生素、含20%FBS的RPMI 1640培养液,经预实验测定G418压力筛选浓度为100 mg ·L-1),连续培养15 d后,无限稀释法挑选阳性克隆扩大培养,Western blot技术检测干扰效果。建立的细胞稳定表达株命名为:M/HK(ERαhigh/ERβhigh,阴性对照)、M/siα(ERα基因沉默细胞株,ER表达状态:ERαlow/ERβhigh)、M/siβ(ERβ基因沉默细胞株,ER表达状态:ERαhigh/ERβlow)。
1.2.4 蛋白印迹(Western blot)技术检测ER蛋白表达 取对数生长期细胞1×106,接种于60 mm细胞培养皿,培养24 h后常规提取各组细胞的总蛋白。以BCA检测定量。将40 μg蛋白经10%SDSPAGE凝胶电泳分离后,电转移至PVDF滤膜。滤膜经5%脱脂奶室温封闭1 h→一抗4℃温和震荡过夜→TBST洗涤3次→HRP标记二抗室温温育1 h→TBST洗涤3次后,经化学发光底物检测试剂盒检测信号强度。结果应用 Bio-Rad公司的 Quantity One软件进行分析,以β-actin作为内参照,以靶蛋白/β-actin灰度的比值作为蛋白的相对表达丰度,进行半定量检测以确定干扰效果。对照细胞MCF-7、M/HK和ER基因沉默细胞M/siα、M/siβ分别按“1.2.1”所示方法进行MTT检测。
1.3 统计学分析 实验数据采用SPSS 11.0统计软件包进行处理。计量资料以±s的形式表示,组间比较应用单因素方差分析(One-way ANOVA)。
2 结果
2.1 哇巴因对MCF-7细胞增殖活性的影响 MTT检测结果显示(Fig 1),哇巴因可明显抑制MCF-7细胞的增殖活性。在0.1~1 000 nmol·L-1浓度范围内,该抑制作用具有剂量依赖性(P<0.05)。与对照组相比,0.1、1、10、100、1 000 nmol·L-1浓度组的P值分别为0.008、0.008、0.006、0.000和0.000,因此在后续实验中,以1、10、100、1 000 nmol·L-1作为哇巴因的有效剂量。
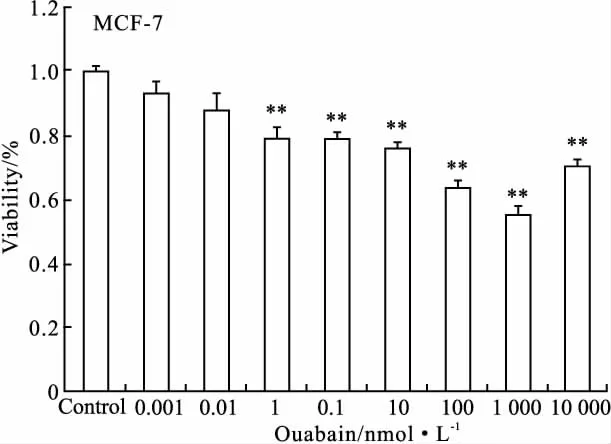
Fig 1 Effects of ouabain on the proliferation of MCF-7
2.2 ER阻断剂部分阻断哇巴因的增殖抑制作用
为了观察哇巴因对MCF-7细胞的增殖抑制作用是否由ER途径介导,我们在加入哇巴因(1、10、100、1000 nmol·L-1)前30 min先用ER阻断剂ICI 182,780(100 μmol·L-1)处理细胞(ER阻断剂预处理之细胞命名为M/ICI),而后应用MTT法检测细胞存活率。结果如Fig 2所示,ICI 182,780作用后,哇巴因对细胞的增殖抑制作用减弱,以1、10、100 nmol·L-1组最为明显(与相应浓度未经ER阻断剂预处理之MCF-7细胞相比,P值分别为0.007、 0.000和0.000),提示哇巴因对MCF-7细胞的增殖抑制作用可经由ER途径介导。
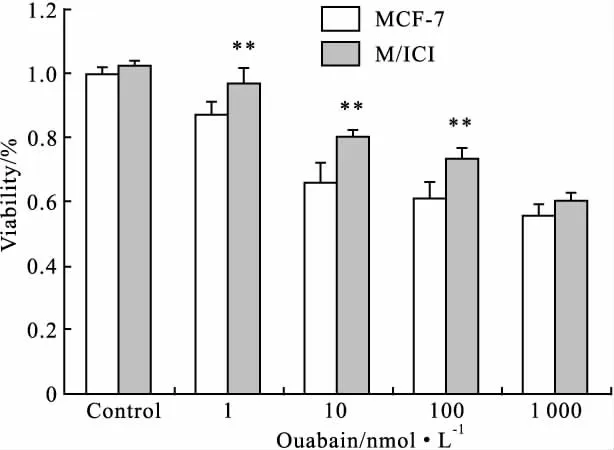
Fig 2 Effects of ICI 182,780 on the inhibitory activity of ouabain
2.3 RNA干扰技术构建ERα/ERβ不同表达状态的乳腺癌细胞株 为进一步观察哇巴因对MCF-7细胞的增殖抑制作用是经由ERα或ERβ或二者共同介导,我们采用RNA干扰技术构建了ERα/ERβ不同表达状态的MCF-7细胞稳定表达株。应用Western blot技术鉴定,结果如Fig 3A和3B所示,MCF-7细胞稳定转染siERα或siERβ后,所筛阳性克隆中ERα或ERβ蛋白表达水平的最高抑制率分别为(77.7±3.3)%和(68.3±2.1)%,而阴性对照质粒(HK)转染细胞株的ER表达水平没有变化。说明经RNA干扰后成功构建ERα/ERβ不同表达状态的乳腺癌细胞株,命名为:M/HK(ERαhigh/ ERβhigh,阴性对照)、M/siα(ERαlow/ERβhigh)、M/siβ (ERαhigh/ERβlow)。
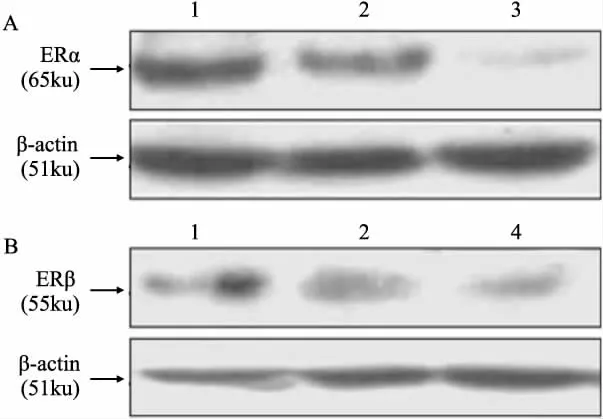
Fig 3 Expressions of ER isoforms in MCF-7 after RNA interference
2.4 哇巴因对MCF-7细胞的增殖抑制作用主要由ERα介导 应用哇巴因处理MCF-7及其稳定转染的细胞克隆,并用MTT技术检测细胞增殖活性。结果如Fig 4所示,MCF-7与M/HK的细胞存活率差异无显著性(P>0.05);与MCF-7相比,哇巴因对M/siα细胞的增殖抑制明显减弱(1、10、100 nmol· L-1浓度组P<0.001,1 000 nmol·L-1浓度组P= 0.008),M/siβ细胞则在10 nmol·L-1(P=0.007)和1 000 nmol·L-1浓度组(P=0.000)表现出差异。提示,在低浓度时(1、10、100 nmol·L-1),哇巴因主要经由ERα途径介导增殖抑制活性,干扰ERα表达可部分阻断哇巴因的抑制活性(与ER阻断剂的阻断结果相似)。

Fig 4 Effects of ER isoforms on the inhibitory activity of ouabain
3 讨论
强心苷类固醇药物(也称洋地黄类药物)是从植物中提取的类固醇衍生物,是细胞膜NKA的天然抑制因子,包括地高辛、洋地黄毒苷和哇巴因等,自发现至今一直作为正性肌力药物用于心衰及房颤的治疗。流行病学调查表明[10],长期服用CSs药物的心脏病患者患白血病、淋巴瘤的几率低于正常对照人群;因心脏原因接受CSs药物治疗的乳腺癌患者,其死亡率和复发率也远低于不接受CSs药物治疗的患者;提示CSs药物用于肿瘤治疗的潜在价值。近10年来,大量体外实验表明[9,11-14]CSs可抑制包括肺癌细胞株、乳腺癌细胞株、前列腺癌细胞株、肝癌细胞株等在内的肿瘤细胞增殖,并诱导细胞凋亡;此外,CSs类药物在自然界含量丰富,种类多样,故成为抗肿瘤化合物研究的一个热点[15]。
尽管CSs可介导抗肿瘤作用,但长期服用CSs可能对心脏产生的毒副作用仍旧限制了这类药物在肿瘤治疗领域的发展。相关研究表明[16],哇巴因在低浓度范围内即可对肿瘤细胞发挥明显的增殖抑制作用;本研究也证实,哇巴因在0.1~1 000 nmol· L-1浓度范围内可以剂量依赖性方式明显抑制MCF-7细胞的增殖活性。这种抗肿瘤活性的有效浓度(纳摩尔级)明显低于同类药物产生心脏毒性的作用浓度,可在不抑制NKA离子转运功能的情况下引起胞内信号转导,继而调节肿瘤细胞的增殖、分化、凋亡[16-17],因此CSs类药物可作为高效、安全的抗肿瘤药物进行研究。
NKA,又称钠泵,是CSs在体内的特异性受体,一定浓度的哇巴因与NKA亚单位的特异性结合可抑制NKA的离子转运功能,导致细胞膜维持极化状态的能力下降,引起胞膜去极化,胞外钙内流增加。但研究显示[16-17],介导抗肿瘤活性的低浓度哇巴因并不引起细胞膜的去极化变化,表明该浓度范围的哇巴因并未抑制胞膜上NKA的活性,因此哇巴因可能通过NKA和(或)其他受体启动胞内信号转导通路,继而影响细胞增殖及凋亡相关蛋白的表达,从而抑制肿瘤细胞增殖并诱导细胞凋亡。本研究结果证实,哇巴因对人乳腺癌MCF-7细胞的增殖抑制作用可被ER阻断剂ICI 182,780部分阻断,提示哇巴因可通过ER信号通路对MCF-7细胞发挥作用;应用哇巴因作用于本室构建的ER亚型不同表达状态的乳腺癌细胞,进一步证明哇巴因经ER对MCF-7细胞的增殖抑制作用主要由ERα介导。近年来研究认为,雌激素的作用分为两种,一种是长期(long term)的“基因组(genomic)”作用,由经典的细胞内ER介导,通过与雌激素反应元件结合,并与其它转录因子相互作用,从而调节敏感基因的表达;另一种是快速或短期(short term)的“非基因组(nongenomic)”作用,由膜相关ER通过激活多种信号转导通路所介导,其中与 NKA信号转导通路共有的(crosstalk)可能有 NF-κB和 Ras/Raf/MEK/ERK等[18-19]。提示哇巴因等CSs可能部分通过膜ER途径尤其是ERα抑制乳腺癌细胞增殖,这种增殖抑制作用可能通过它们共同的胞内信号转导通路来实现,NKA结合ER可能是未来开发抗乳癌药物的潜在重要靶点。
CSs作为一种新型抗肿瘤药物,目前已进入临床实验阶段。来源于牛角瓜属类植物的半合成CSs——UNBS1450可通过减少细胞内ATP生成、破坏细胞骨架、促进自噬效应等方式抑制神经胶质瘤细胞的增殖和转移,在欧洲已进入临床Ⅱ期试验[20]。我们的前期工作证明,植物来源的哇巴因和动物来源的华蟾毒配基可作用于肝癌HepG2细胞,减少CyclinA1/CDK2/PCNA复合体的生成、上调细胞周期负调控因子p21CIP1的表达并引起细胞周期S期阻滞[13-14]。本研究证实,哇巴因主要通过ERα信号通路对雌激素依赖性肿瘤如乳腺癌发挥抗肿瘤效应,NKA结合ER可能是未来开发抗乳癌药物的潜在重要靶点。
[1] Schwarz S M,Bostwick H E,Medow M S.Estrogen modulates ileal basolateral membrane lipid dynamics and Na+-K+-ATPase activity[J].Am J Physiol,1988,254(5Pt1):G687-94.
[2] Sato T,Tanaka K,Ohnishi Y,et al.Effects of steroid hormones on(Na+,K+)-ATPase activity inhibition-induced amnesia on the step-through passive avoidance task in gonadectomized mice[J].Pharmacol Res,2004,49:151-9.
[3] Baker M E.Computer-based search for steroid and DNA binding sites on estrogen and glucocorticoid receptors[J].Biochem Biophys Res Commun,1986,139(1):281-6.
[4] Barwe S P,Anilkumar G,Moon S Y,et al.Novel role for Na,KATPase in phosphatidylinositol 3-kinase signaling and suppression of cell motility[J].Mol Biol Cell,2005,16:1082-94.
[5] Liao J K.Cross-coupling between the oestrogen receptor and phosphoinositide 3-kinase[J].Biochem Soc Trans,2003,31:66-70.
[6] Baker M E.Computer-based search for steroid and DNA binding sites on estrogen and glucocorticoid receptors[J].Biochem Biophys Res Commun,1986,139:281-6.
[7] 牛秀珑,毛立群,王 越,等.IFN-γ和IL-4对乳腺癌细胞MCF-7生长特性及雌激素受体亚型的影响[J].中华肿瘤防治杂志,2011,18(20):1581-4.
[7] Niu X L,Mao L Q,Wang Y,et al.Effects of IFN-γ and IL-4 on the growth and the strogen receptors ubtypes of breast cancer cell MCF-7[J].Chin J Cancer Prev Treat,2011,18(20):1581-4.
[8] Kometiani P,Liu L,Askari A.Digitalis-induced signaling by Na+/K+-ATPase in human breast cancer cells[J].Mol Pharmacol,2005,67:929-36.
[9] Winnicka K,Bielawski K,Bielawska A,et al.Apoptosis-mediated cytotoxicity of ouabain,digoxin and proscillaridin A in the estrogen independent MDA-MB-231 breast cancer cells[J].Arch Pharm Res,2007,30(10):1216-24.
[10]Gheorghiade M,Adams K F Jr,Colucci W S.Digoxin in the management of cardiovascular disorders[J].Circulation,2004,109 (24):2959-64.
[11]Frese S,Frese-Schaper M,Andres A C,et al.Cardiac glycosides initiate Apo2L/TRAIL-induced apoptosis in non-small cell lung cancer cells by up-regulation of death receptors 4 and 5[J].Cancer Res,2006,66(11):5867-74.
[12]Gasper R,Vandenbussche G,Goormaghtigh E.Ouabain-induced modifications of prostate cancer cell lipidome investigated with mass spectrometry and FTIR spectroscopy[J].Biochim Biophys Acta,2011,1808(3):597-605.
[13]徐忠伟,王凤梅,徐瑞成,等.Na+/K+-ATP酶α1亚单位小干扰RNA和哇巴因诱导肝癌HepG2细胞S期阻滞及其机制[J].中华医学杂志,2010,90(12):813-7.
[13]Xu Z W,Wang F M,Xu R C,et al.Effect of Na+/K+-ATPase alpha1 siRNA and ouabain upon cell cycle in human hepatoma HepG2 cell and its mechanism[J].Nat Med J China,2010,90 (12):813-7.
[14]高默杰,徐忠伟,徐瑞成,等.钠钾泵抑制剂通过调节细胞周期相关蛋白的生成介导肝癌HepG2细胞周期S期阻滞与凋亡[J].中国药理学通报,2010,26(4):452-6.
[14]Gao M J,Xu Z W,Xu R C,et al.The linkage between cell cycle S phase arrest and apoptosis on human hepatocellular carcinoma HepG2 induced by Na+,K+-ATPase inhibitors via regulating proteins associated with cell cycle[J].Chin Pharmacol Bull,2010,26(4):452-6.
[15]Newman R A,Yang P,Pawlus A D,et al.Cardiac glycosides as novel cancer therapeutic agents[J].Mol Interv,2008,8(1):36-49.
[16]Winnicka K,Bielawski K,Bielawska A,et al.Antiproliferative activity of derivatives of ouabain,digoxin and proscillaridin A in human MCF-7 and MDA-MB-231 breast cancer cells[J].Biol Pharm Bull,2008,31(6):1131-40.
[17]Aizman O,Uhlén P,Lal M,et al.Ouabain,a steroid hormone that signals with slow calcium oscillations[J].Proc Natl Acad Sci USA,2001,98(23):13420-4.
[18]Tang W,Wang W,Zhang Y,et al.Tumour necrosis factor-related apoptosis-inducing ligand(TRAIL)-induced chemokine release in both TRAIL-resistant and TRAIL-sensitive cells via nuclear factor kappa B[J].FEBS J,2009,276(2):581-93.
[19]Wang Z,Zheng M,Li Z,et al.Cardiac glycosides inhibit p53 synthesis by a mechanism relieved by Src or MAPK inhibition[J].Cancer Res,2009,69(16):6556-64.
[20]Lefranc F,Kiss R.The sodium pump alphal subunit as a potential target to combat apoptosis-resistant glioblastomas[J].Neoplasia,2008,10(3):198-206.

