GPCR偏向性配体介导的选择性功能
刘路路,蔡 欣,张 宁,白 波,陈 京
(济宁医学院神经生物学研究所,山东济宁 272000)
G蛋白偶联受体(G protein-coupled receptor,GPCR),又称七次跨膜受体,是受体超家族中最普遍的一类。GPCR通过应答多种胞外刺激,参与调控大部分生理和疾病过程。因此,长期以来GPCR都被作为药物研发的作用靶标。传统观念认为激动剂作用受体只通过G蛋白的活化来启动下游复杂的信号网络。近些年人们意识到,GPCR介导的完整信号网络并非通过单纯的线性G蛋白-第二信使依赖性级联反应实现。一些GPCR可以偶联不同亚型的G蛋白,甚至可以与非G蛋白信号效应器作用。例如,GPCR激酶(G proteincoupled receptor kinases,GRKs)和β-arrestins的功能不再局限于控制GPCR的脱敏、内化和循环,也可作为多功能衔接蛋白直接作用于GPCR来介导GPCR的某些特异信号途径[1]。
“偏向性配体”这一概念的提出,为GPCR介导的复杂信号网络的研究打开了新的视野,也为药物研发带来了新的启发。传统的配体作用模式认为,激动剂作用于受体的功效是平衡无偏向的,可以同时作用于G蛋白和β-arrestin信号通路。现在发现配体作用于受体的方式是多样的。偏向性配体可以选择性地稳定受体构象中的一种亚型。结合β-arrestin和G蛋白偏向配体,可以选择性的增强或抑制GPCR介导的信号网络中的某一信号途径。根据这一理论的研究已经发现了一些真实存在治疗功效的偏向性配体类药物。因此,本文基于GPCR的G-蛋白和β-arrestin依赖性信号,对偏向性配体作用于GPCR的生理学作用和药物学潜能以及研究偏向性配体的新技术作进一步综述。
1 偏向性配体
传统观念认为,GPCR的配体能平衡的作用于某一受体下游的多种信号途径,根据配体作用于受体的效率可将配体分为:全效激动剂、部分激动剂、中性对抗剂和反向激动剂。全效激动剂和部分激动剂具有稳定受体活化构象的功效,反向激动剂稳定受体的非活化构象,而中性对抗剂则对这两种构象的平衡不发挥任何效应(Fig 1a)。由此可知,GPCR激动剂激活的不同信号途径的多层次反应总是相互关联的。
然而近些年,许多实验现象不能被这一理论诠释,多种配体在激活不同信号途径时呈现“不平衡效应”。他们能够导致受体选择性的与不同亚型的G蛋白或β-arrestin进行相互作用,从而偏向某些信号途径,甚至此信号途径与受体信号活化的状态相矛盾。例如,在某一信号途径作为对抗剂或反向激动剂的配体,在另一信号途径中很可能就是自发的激动剂。此类配体被命名为“偏向性激动剂”“选择性功能配体”或“偏向性配体”[2]。最早有关偏向配体的例子是由毒蕈碱的乙酰胆碱受体两种激动剂证明:卡可林(carbachol)和匹罗卡品(pilocarpine)。受体结合卡可林能产生由Gαs和Gαq介导的平衡反应,但是受体结合匹罗卡品不能激活Gαs,只能激活Gαq介导PLC活化[3]。因此证实,偏向性配体可以选择性增强或降低GPCR信号网络中的某些途径。
1.1 G-蛋白和β-arrestin介导的信号 GPCR信号网络包括G蛋白介导的信号途径和β-arrestin介导的信号途径。G蛋白介导的信号途径,又称G蛋白-第二信使依赖性级联反应,激动剂结合到GPCR上,激活G蛋白,引起Gα亚基上GDP与GTP的交换,并伴随Gα亚基与Gβγ亚基的分离。这一分离加速了第二信使系统相关产物和信号的生成,从而激活PKC/PKA信号通路。此后,活化的GPCR主要通过arrestin介导的脱敏作用被定向降解或再循环到细胞表面(Fig 1a)。
近年证实,β-arrestin同样可以作为多功能的衔接蛋白来支撑多种信号蛋白传递信号(如:MAPK、EGFR、P13K等)[4],见Fig 1b,c。并且,跟据其发挥功能是否依赖G蛋白,可将β-arrestin参与的信号转导分为G蛋白依赖型和G蛋白非依赖型(又称β-arrestin依赖型)。前者主要指GPCR的脱敏作用。激动剂活化 GPCR后,GRKs通过磷酸化GPCR的尾部和胞质环,增强激动剂-受体和β-arrestin的亲和力。之后β-arrestin易位到受体复合物中,阻断受体与G蛋白的相互作用,随后受体-β-arrestin复合物内吞到网格蛋白-内陷小窝中,完成GPCR的脱敏、内化、再循环途径。并非所有的信号转导都需要依赖G蛋白。例如,表达β2-肾上腺素能受体(β2-adrenergic receptor,β2AR)的HEK293细胞中,胞外信号调节激酶1/2(extracellular signal-regulated kinase,ERK)的活化可以依赖Gs-Gi/PKA途径,也可以通过不依赖G蛋白的β-arrestin途径进行。β-arrestin依赖型ERK活化途径具有与G蛋白依赖型不同的特点。首先,Gs-Gi依赖型ERK磷酸化反应迅速,在2~5 min内到达高峰,持续时间短暂。β-arrestin依赖型ERK磷酸化信号起始较缓慢,在5~10 min到达峰值,信号持续30 min后略有衰减;其次,它们具有不同的调控机制和抑制蛋白。Gs-Gi依赖型信号对百日咳毒素(PTX)Gi抑制剂和H-89(PKA抑制剂)十分敏感,而对RNA干扰导致的β-arrestin内源性缺失不敏感。β-arrestin依赖型信号则对PTX和H-89不敏感,对SiRNA引起的β-arrestin缺失十分敏感,其介导的ERK磷酸化信号途径主要受GRK5/6的募集作用影响。
1.2 G-蛋白/β-arrestin偏向性配体和偏向性受体 现已鉴别出许多优先选择G蛋白或β-arrestin介导信号途径的G蛋白偏向性配体或β-arrestin偏向性配体[5]。G蛋白偏向性配体可以选择性增强GPCR的G蛋白信号,缺少β-arrestin介导的信号转导。分离的Gβγ亚基可以激活GRK2/3,募集βarrestin进行受体的脱敏和内化作用。β-arrestin偏向性配体则可以增强β-arrestin介导的信号和内化作用,而缺少G蛋白的激活(Fig 2)。除偏向性配体外,通过突变关键残基也可以产生偏向性受体。偏向性配体偏好某种反应,偏向受体只能通过限定的途径传递信号。例如,血管紧张素Ⅱ的1型受体(angiotensinⅡtype 1A receptor,AT1AR)的突变体AT1AR (DRY/AAY)[6],AT1AR偏向受体中G偶联区域的高保守DRY序列已经突变为AAY,呈现β-arrestin信号的偏向性。而且β2AR的突变体β2AR(TYY)也含有3个决定G蛋白偶联的关键残基发生突变,呈现受体偏向性。现已证实G蛋白或β-arrestin偏向性配体是一类较普遍的可以选择性调节GPCR药理学的配体,他们具有重要的药物学价值[7]。
2 偏向配体的作用机制
2.1 受体构象 为什么平衡的配体能通过受体的控制来激活所有信号途径,而偏向性配体只能激活最敏感的信号途径?偏向性配体的出现,提出了许多不能用传统的两种受体构象状态-模型理论解释的受体激活问题。受体的偏向性配体选择性的偶联潜在下游信号通路中的部分信号,暗示它必会稳定或诱导一种与平衡配体不同的受体构象。这一理论否定了受体只存在单一激活构象的观念,恰恰相反的是存在多种激活构象。
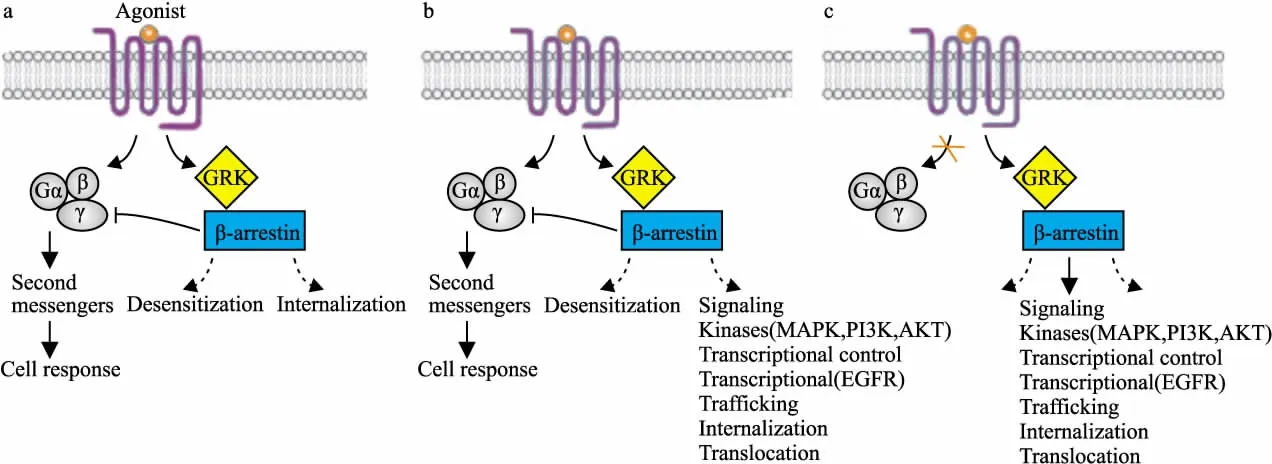
Fig 1 G protein and β-arrestin-mediated signaling
配体作用功效的不同可能是由于影响受体构象变化的程度不同引起。不同功效的配体可选择独特的前受体构象结合,结合后诱导前受体构象发生变化,从而给予首选状态的构象以额外的稳定性来亲和其下游信号蛋白(如G-蛋白/ β-arrestin)[8]。偏向性配体至少从3个方面影响受体产生介导偏向信号的构象:(a)配体结合口袋的结构。研究GPCR的晶体结构发现,受体除存在1个位于跨膜螺旋Ⅲ(transmembrane helixⅢ,TM3)、Ⅳ、Ⅴ、Ⅵ和Ⅶ之间的主要结合口袋外,还存在1个由跨膜螺旋Ⅰ、Ⅱ、Ⅲ和Ⅶ决定的次要配体结合口袋。TM2上缠绕有保守的脯氨酸是次要配体结合口袋的重要特征,它可能是决定配体偏向性的定量因素[9],利用已知的偏向性配体和适合的偏向性受体突变体系统等精密实验正在研究这一现象。(b)受体中心区域的全面重排。用X射线对比β2AR的活化与非活化构象的变化,发现TM6的胞质端产生相对较大向外性移动,也可看到TM5和TM7的重排[10-11]。(c)受体胞内末端构象的变化[12]。应用结合荧光蛋白的技术研究精氨酸抗利尿激素受体(V2R)的功能选择性,发现AVP(Gs和β-arrestin-2的激动剂)可以诱导V2R的TM6-第3个胞内环(icl3)和TM7-假定第8螺旋(H8)上的荧光蛋白寿命变长,且与C端距离变小;MCF14(Gs激动剂/arrestin抑制剂)只诱导TM6上荧光蛋白寿命和距离的变化。SR121463(Gs反向激动剂/arrestin部分激动剂)诱导TM6上荧光蛋白寿命产生与AVP和MCF相反的变化,同时TM7-H8上的荧光蛋白寿命与AVP相似。这表明TM6-icl3和TM7-H8很可能是激活胞内伴侣的分子开关,配体选择性的功效依赖于配体触发TM6-icl3和TM7-H8区域的能力。
因此平衡的配体有能力稳定所有向下游途径传递信号的受体激活构象。而偏向配体只稳定那些增强特定亚型信号效应的构象,选择性的靶向作用于有利的信号甚至是阻碍或终止有害的受体激活作用。
2.2 G-蛋白与β-arrestin的竞争 G蛋白和β-arrestin之间存在竞争也可能是偏向性配体选择性启动信号途径的重要机制。G蛋白和β-arrestin在GPCR上具有相似的结合位点(IL2、NIL3、CIL3),这表明β-arrestin与G蛋白具有竞争受体复合物的能力[13]。虽然G蛋白和β-arrestin的竞争存在于任何时间点,但只有当β-arrestin与受体复合物的亲和力高到足以使G蛋白从受体上解偶联才可观察到。激动剂结合前,β-arrestin与受体的亲和力相对较低,这时基本上没有βarrestin介导的GPCR信号。β-arrestin偏向性配体结合后,受体发生构象变化,β-arrestin与G蛋白竞争受体的能力增强。此时,若β-arrestin优先于G蛋白与受体结合时,会激活G蛋白非依赖的β-arrestin信号途径;若G蛋白先结合受体,便激活G蛋白依赖的β-arrestin信号途径。
2.3 受体和信号转导分子复合物的结构 稳定的配体-受体复合体形成后,GRK2/3和GRK5/6很可能是调控G蛋白和β-arrestin依赖途径的开关(Fig 2)。偏向配体稳定特定受体构象之后,独特的GRK介导GPCR的磷酸化C末端产生不同“条形码”,这些“条形码”指导信号转导分子β-arrestin的构象变化,来控制相互作用形式和相关功能[14]。GRK2/3是细胞溶质蛋白,他们的募集和活化需要Gβγ亚基的分离,因此激活G蛋白依赖信号。受体C端特异的丝氨酸(Ser)和苏氨酸(Thr)位点进行磷酸化,能募集β-arrestin导致脱敏和内化作用(Fig 2b)。相反,GRK5/6是质膜伴随蛋白,它的激活不需要G蛋白。GRK5/6依赖的磷酸化“条形码”通过加强β-arrestin连接受体和胞内信号的桥梁作用,使β-arrestin直接传递GPCR的信号(Fig 2c)。因此,配体激活不同GRK的能力也能影响G蛋白和β-arrestin信号的竞争。
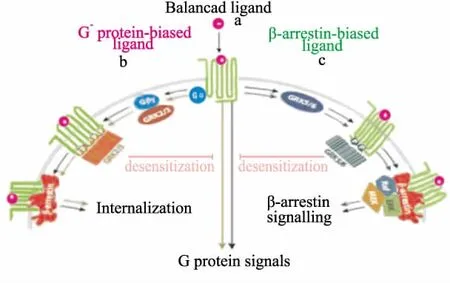
Fig 2 GRK-mediated phosphorylation“bar code”converts ligand-induced conformation of the GPCRs
3 偏向性配体的治疗潜能
近10年来,开发GPCR偏向配体成为治疗药物研发的重要策略。并已鉴定出大量可以选择性激活G蛋白和β-arrestin的GPCR偏向性配体[15],它们可能或真实存在药物研发和治疗方面的潜力。
3.1 β肾上腺素能受体(β-AR)与心血管疾病 β-AR与多种心血管活动途径密切相关。早期β-arrestin1基因敲除小鼠的大量研究,有力地说明心脏中β-AR的脱敏作用与β-arrestin1有关。临床上,常使用β-激动剂多巴酚丁胺来为严重心衰的病人提供收缩性支持,但是却能快速诱导耐药性的生成。若鉴别出可以限制β-arrestin1介导的脱敏作用及下游信号调控的G蛋白偏向激动剂,便会提供更持久而有效的治疗方法。
近期研究发现β-AR还可介导心脏内β-arrestin1和βarrestin2依赖的信号,激活表皮生长因子受体EGFR,发挥心脏保护作用。但是大量涉及Gs信号的β-AR慢性激活作用会产生心脏毒素作用。由此推断β-arrestin的偏向配体可作为心脏毒素(G蛋白信号)的经典抑制剂,在保护心脏β-arrestin信号的同时,有利于治疗。而且最近已鉴别出β1AR和β2AR的β-arrestin-偏向性配体:β-抑制剂卡维地洛[16]。
3.2 烟酸受体(GPR109A)调节脂质的内环境稳态 烟酸是一种有效治疗血脂障碍的药物,它可以提高HDL-胆固醇含量、降低甘油三酯的含量,却因受面红等不良副作用的制约,明显地降低了病人的适应性。烟酸诱导的面红等不良反应在β-arrestin1基因敲除小鼠中明显降低,同时脂解效应未受损坏,这说明G蛋白-偏向性配体能够维持血脂内有益的效应,并避免 β-arrestin介导的面红现象。近期鉴别出GPR109A偏向激动剂具有抗脂(肪)肝的作用,并可明显降低面红等不良反应[17]。这些复合物还能阻碍受体的内化作用和ERK的活化,这可能是不激活β-arrestin信号而引起的。
3.3 CCR5与自身免疫性疾病 人类免疫缺陷病毒(human immunodeficiency virus,HIV)需要通过细胞表面复合受体(如CCR5或CXCR4趋化因子受体)来贴近和进入目标细胞。CCR5-向性的病毒是感染早期的主要类型,含有CCR5纯合截断突变体(CCR5-D32)的病人对HIV有抵抗力[18]。AOPRANTES,一种被修饰的CCR5配体,可以像内源性RANTES一样提高受体的内化作用,且能阻止内化的CCR5再循环。更高效的AOP-RANTES衍生物可能会更有效的防止HIV感染外周血单核细胞。这些配体很可能通过改变β-arrestin的活性来调节CCR5的运输。因此,能够修饰或改变β-arrestin调控的CCR5运输的偏向配体,可能成为治疗HIV的新方法之一。
4 偏向性配体类药物研发的新技术
目前发现,存在潜在药效的药物几乎都是经由非传统的途径传递信号。例如,偏向由β-arrestin介导的信号途径的受体和相应激动剂类药物不断被鉴定出。因此了解研究偏向性配体的技术,可以为此类药物研发提供更有效的工具。β-arrestin介导的信号的发现在为鉴定GPCR药物作用机制方面提供新的理论依据的同时,也为重新评定用于研发的GPCR药物的技术提供了必要的条件。传统方法多聚焦于辩别由Gα和Gβγ亚基介导的信号反应,这些分析方法不能描绘复合体作用细胞信号的完整画面。近年来出现了许多聚焦于β-arrestin聚集和信号的新技术可以从分布、距离、构象变化等不同层次研究偏向性配体类药物的作用机制。
①再分布分析法(redistribution assays)。β-arrestin要不断的募集到细胞表面以便于GPCR的内化作用,目前已设计出恒温器再分布测定方法和多孔磁芯测定方法等多种检测技术,用于研究在配体刺激条件下标记有荧光蛋白的GPCR或β-arrestin的再分布情况以及受体的运输途径。
通过β-arrestin的再分布检测分析发现,刺激以前,受体通常定位在细胞膜上,β-arrestin则大部分分布在胞质内。不同配体作用条件下标记有荧光蛋白的β-arrestin产生两种募集形式。在A型受体中,β-arrestin易位到细胞膜而受体则内化到快速再循环的内涵体中(如:β2AR)。在B型受体中,βarrestin与受体共同内化到慢速循环的内涵体中(如: AT1AR)[19]。而延长的β-arrestin与受体共同内化作用会抑制GPCR的复敏,可能对信号途径的选择作用产生极大的影响。
②距离分析法(proximity assays)。距离分析法多用于研究在配体作用条件下,GPCR的C末端与G蛋白或β-arrestin的相互作用。此类分析技术多结合高处理筛选技术,而且要在GPCR和G蛋白/β-arrestin上标记报告分子。
在共振能量转移(resonance energy transfer,RET)分析系统中,将供体探针和受体探针分别附加到受体和β-arrestin上,β-arrestin募集时,通过荧光共振能量转移(fluorescence resonance energy transfer,FRET)中光线刺激荧光蛋白或生物发光共振能量转移(bioluminescence resonance energy transfer,BRET)中化学底物的刺激,供体探针产生发射光,最终致使能量转移到受体探针上。
在基于酶互补作用的分析技术中,受体和偶联蛋白上分别标记两个功能互补的酶作用片段,例如在β-arrestin募集作用中,β-arrestin和受体作用时会形成功能健全的酶基团。距离分析法可在活细胞条件下,精确检测出配体刺激受体与哪种信号蛋白偶联,从而鉴别优先选择G蛋白还是β-arrestin介导的信号通路。
③构象分析法(conformation assays)。偏向性配体可以刺激受体产生与平衡性配体不同的受体构象。研究GPCR和β-arrestin构象的变化特征便于理解偏向性配体的活性和结合特点。
传统方法采用X射线检测在激动剂刺激条件下GPCR结构的重排现象,例如,X射线技术已用于研究β2AR的构象变化,但这种方法不够精密。近几年,RET技术已被广泛应用于检测活化受体状态的胞内环和片段构象特征的检测[20]。例如,已用FRET技术研究多形态突变的β1AR构象变化,证实改变 β-arrestin构象是筛选伴随特异信号途径GPCR结合构象的有效方法。最近基于RET技术又设计了一种新的发光共振能量转移技术(luminescence resonance energy transfer,LRET),简称LRET技术。这一技术通过在突变受体(如:Flag标记)的螺旋环和尾部标记不同的荧光蛋白,通过检测不同荧光蛋白的寿命和相互作用距离来确定配体诱导的受体构象的改变。上述提到的V2R构象检测正是利用这一技术实现:Flag-V2R-A267C-C358A-荧光砷素螺旋结合剂(fluorescein arsenical helix binder,FlAsH)突变体作为TM6传感器,Flag-V2R-S330C-C358A-FlAsH突变体作为TM7-H8传感器[21]。C末端标记的FlAsH荧光基团作为能量供体,TM6和TM7-H8上标记的Lumi4-Tb作为能量受体,通过检测各传感器上的发光放射衰减便可确定受体的结构变化。
5 结语
β-arrestin和G-蛋白介导和调控的GPCR完整信号网络,均参与许多生理和病理生理过程。因此,市场上近50%的医疗药物作用于GPCR发挥疗效。与传统的G-蛋白信号相比,β-arrestin介导的信号是GPCR研究的新领域[20],这一方面的研究必将揭示出更多β-arrestin的生物学作用。更令人感兴趣的是,偏向性配体能够在受体水平区分β-arrestin和G-蛋白的功能,从而选择性地激活GPCR所衔接的信号。如果能辨别出β-arrestin和G-蛋白的信号在健康和疾病状态下的作用,那么β-arrestin和G-蛋白偏向性配体作为药物的治疗潜能不仅能提高药物的特异性疗效,而且会很大程度的减少药物的不良反应。
目前,偏向性配体高于非偏向性配体的治疗优势虽已非常清楚,但其仍需在临床相关系统得到证实。全方位的从生物化学和生理学角度了解β-arrestin和G-蛋白介导的信号,有可能会发现更多的靶向作用位点。应用一系列位置再分布、距离测定和构象分析等方法和技术,在辨别不同配体结合特征、受体构象变化、蛋白偶联和信号转导方面发挥了重要的作用。设计更接近活体细胞甚至是活体动物背景下的GPCR研究方法,对偏向性配体类药物的筛选也是极为重要的。
[1] Rajagopal S,Rajagopal K,Lefkowitz R J.Teaching old receptors new tricks:biasing seven-transmembrane receptors[J].Nat Rev Drug Discov,2010,9(5):373-86.
[2] Violin J D,Lefkowitz R J.β-arrestin-biased ligands at seven-transmembrane receptors[J].Trends Pharmacol Sci,2007,28(8):416-22.
[3] Fisher A,Heldman E,Gurwitz D,et al.Selective signaling via unique M1 muscarinic agonists[J].Ann N Y Acad Sci,1993,695: 300-3.
[4] Luttrell L M,Gesty-Palmer D.Beyond desensitization:physiological relevance of arrestin-dependent signaling[J].Pharmacol Rev,2010,62(2):305-30.
[5] DeWire S M,Violin J D.Biased ligands for better cardiovascular drugs:dissecting G-protein-coupled receptor pharmacology[J].Circ Res,2011,109(2):205-16.
[6] Gáborik Z,Jagadeesh G,Zhang M,et al.The role of a conserved region of the second intracellular loop in AT1 angiotensin receptor activation and signaling[J].Endocrinology,2003,144(6):2220-8.
[7] Kenakin T,Miller L J.Seven transmembrane receptors as shapeshifting proteins:the impact of allosteric modulation and functional selectivity on new drug discovery[J].Pharmacol Rev,2010,62 (2):265-304.
[8] Reiter E,Ahn S,Shukla A K,et al.Molecular mechanism of βarrestin-biased agonism at seven-transmembrane receptors[J].Annu Rev Pharmacol Toxicol,2012,52:179-97.
[9] Rosenkilde M M,Benned-Jensen T,Frimurer T M,et al.The minor binding pocket:a major player in 7TM receptor activation[J].Trends Pharmacol Sci,2010,31(12):567-74.
[10]Ziegler N,Batz J,Zabel U,et al.FRET-based sensors for the humanM1-,M3-,and M5-acetylcholine receptors[J].Bioorg Med Chem,2010,19(3):1048-54.
[11]Kahsai A W,Xiao K,Rajagopal S,et al.Multiple ligand-specific conformations of the β2-adrenergic receptor[J].Nat Chem Biol,2011,7(10):692-700.
[12]Bokoch M P,Zou Y,Rasmussen S G,et al.Ligand-specific regulation of the extracellular surface of a G-protein-coupled receptor[J].Nature,2010,463(7277):108-12.
[13]Zheng H,Chu J,Qiu Y,et al.Agonist-selective signaling is determined by the receptor location within the membrane domains[J].Proc Natl Acad Sci U S A,2008,105(27):9421-6.
[14]Nobles K N,Xiao K,Ahn S,et al.Distinct phosphorylation sites on the β2-adrenergic receptor establish a barcode that encodes differential functions of β-arrestin[J].Sci Signal,2011,4(185): ra51.
[15]Whalen E J,Rajagopal S,Lefkowitz R J.Therapeutic potential of β-arrestin-and G protein-biased agonists[J].Trends Mol Med,2011,17(3):126-39.
[16]Zheng H,Loh H H,Law P Y.Agonist-selective signaling of G protein-coupled receptor:mechanisms and implications[J].IUBMB Life,2010,62(2):112-9.
[17]Semple G,Skinner P J,Gharbaoui T,et al.3-(1H-tetrazol-5-yl)-1,4,5,6-tetrahydro-cyclopentap-yrazole(MK-0354):a partial agonist of the nicotinic acid receptor,G-protein coupled receptor 109a,with antilipolytic but no vasodilatory activity in mice[J].J Med Chem,2008,51(16):5101-8.
[18] Oppermann,M.Chemokine receptor CCR5:insights into structure,function,and regulation[J].Cell Signal,2004,16(11): 1201-10.
[19]Hanyaloglu A C,von Zastrow M.Regulation of GPCRs by endocytic membrane trafficking and its potential implications[J].Annu Rev Pharmacol Toxicol,2008,48:537-56.
[20]蔡 欣,白 波,陈 京.G蛋白偶联受体高阶寡聚化和信号转导中蛋白复合体的时空动态检测进展[J].中国药理学通报,2012,28(1):8-12.
[20]Cai X,Bai B,Chen J.Space-time dynamic detection of higher-order G protein-coupled receptor oligomers and protein complex in signalling[J].Chin Pharmacol Bull,2012,28(1):8-12.
[21]Rahmeh R,Damian M,Cottet M,et al.Structural insights into biased G protein-coupled receptor signaling revealed by fluorescence spectroscopy[J].Proc Natl Acad Sci U S A,2012,109(17):6733-8.

