穿透性Sox2蛋白的质粒构建及功能鉴定
丁道芳,王 瑧,李晓锋,徐乐勤,梁倩倩,王拥军
(1.上海中医药大学龙华医院脊柱病研究所,上海 200032;2.复旦大学肿瘤医院中心实验室,上海 200433)
诱导多能干细胞(induced pluripotent stem cells,iPS cells)最初由日本科学家于2006年利用病毒载体将Oct4、Sox2、Klf4和c-Myc 4个转录因子的组合转入体细胞中,使其重编程而得到的类似胚胎干细胞的一种细胞[1]。进一步的研究发现转录因子Sox2和Oct4是诱导iPS细胞生成的必要的转录因子[2]。
iPS细胞将有希望成为病人治疗用靶细胞来源,因此其安全性成为首要关注问题,其次效率也是目前研究的重点之一。目前获得iPS细胞大多采用病毒的方式,此种方法可以有效的得到iPS细胞,但同时由于病毒的引入增加致癌的风险。在此基础上,出现修饰性Sox2和Oct4蛋白,即在Sox2等基因的C末端加9~11个精氨酸肽,再将这些蛋白纯化或者细胞的裂解物加入到细胞培养基中,这些已经修饰后的蛋白肽可以直接进入细胞,从而将这些体细胞转变成iPS细胞[3-4]。蛋白转导的方式可以规避这些风险,但这些蛋白的活性及效率也将成为问题,亟待解决。在本研究中,采用了目前最高效的蛋白表达载体和真核细胞表达方式,使表达的蛋白量增加,并对表达出的蛋白进行通透和促增殖的功能进行鉴定,以确定得到的Sox2通透性蛋白具有活性。本文以Sox2基因为例,研究通透性蛋白的表达和功能鉴定,为进一步得到安全的iPS细胞奠定基础。
1 材料与方法
1.1 细胞培养 小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)取自怀孕13 d左右孕鼠的胚胎,培养于含10%胎牛血清的高糖DMEM培养基中,本实验所用细胞均为3代内。293T细胞培养于含10%胎牛血清的DMEM高糖培养基中。
1.2 主要仪器、试剂 核酸蛋白凝胶成像系统(天能公司),荧光倒置显微镜(Olympus公司),蛋白电泳和转膜系统(Biorad公司)。DNA markerⅢ(天根生物公司),Sox2抗体(Santacruz,美国),PCNA(Proteintech公司),GAPDH抗体(CST公司)。
1.3 试验方法
1.3.1 构建重组质粒pPYCAG-9R-Sox2 通过PCR方法在Sox2基因(实验室保存)的N端加上9个精氨酸的多肽。9R-Sox2扩增用的引物,上游序列为5'CCG AGATCT ATG CGC AGA CGC CGC AGA CGC AGA CGC CGC TAT AAC ATG ATG GAG3',下游序列为5'AAT CTC GAG TCA CAT GTG CGA CAG GGG CAG3'。扩增后的基因序列通过亚克隆至pPYCAG载体上。在9R-Sox2融合基因的N端和C端分别引入BglII和XhoI酶切位点,经酶切后连接至经同样酶切的pPYCAG载体上。
1.3.2 细胞转染和阳性克隆筛选 pPYCAG-9RSox2重组质粒4 μg和10 μl脂质体2 000分别稀释于100 μl无血清DMEM培养基中,5 min后两者混匀,加入293T细胞中,4 h细胞换液,培养于含10% FBS的DMEM中。由于pPYCAG载体携带嘌呤霉素抗性基因,具有嘌呤霉素抗性,根据这一特性杀死未转染pPYCAG-9R-Sox2重组质粒的细胞。转染72 h后,加嘌呤霉素2 mg·L-1维持至1周。得到表达9R-Sox2的阳性克隆细胞。对照为pPYCAG转染的293T细胞。
1.3.3 细胞免疫荧光鉴定蛋白表达 表达9RSox2的阳性克隆细胞,PBS清洗两次,4%多聚甲醛室温固定15 min,PBS漂洗3次,用5%BSA的封闭液(含0.2%Trition X-100)室温封闭1 h后,加入羊来源的Sox2抗体(1∶200),37℃作用2 h,PBS漂洗3次,每次5 min,加入FITC标记的抗山羊二抗(1∶200),避光37℃反应1 h,PBS漂洗3次,每次5 min,接着用DAPI染色,室温5 min,PBS漂洗,荧光显微镜观察拍照。对照为转染空质粒pPYCAG的293T细胞。
1.3.4 细胞蛋白提取 收集表达9R-Sox2的阳性细胞,重悬于裂解液(100 mmol·L-1HEPES,pH 8.2,50 mmol·L-1NaCl,5 mmol·L-1MgCl2,1 mmol·L-1DTT,蛋白酶抑制剂),直径10 cm培养皿,细胞长满加300 μl裂解液,冰上放置30 min,超声裂解,裂解液于4℃,15 000×g离心15 min。取上清液分装,于-80℃冰箱放置备用。同时提取转染空质粒pPYCAG的293T细胞的蛋白,作为后续试验的对照。
1.3.5 Western blot 12%的聚丙烯酰胺凝胶分离蛋白,以100V恒压电泳2 h。经200 mA恒流压转膜2 h,转移目的蛋白至PVDF膜(美国Millipore公司),用含5%BSA室温封闭1 h。用封闭液稀释一抗至适当浓度,4℃孵育过夜。一抗分别为兔抗PCNA(1∶1 000)、GAPDH(1∶1 000)。TBST洗膜3次之后,用红外标记的相应二抗室温孵育2 h。TBST洗膜3次之后,用红外标记的相应二抗室温孵育2 h。TBST洗膜3次,于Odyssey仪器上扫描和分析结果。
2 结果
2.1 PCR扩增9R-Sox2基因及构建Ppycag-9RSox2重组子 PCR扩增9R-Sox2基因,长度为987 bp,如Fig 1A。Ppycag-9R-Sox2转化入大肠杆菌中扩增并抽提质粒,挑选4个细菌克隆抽质粒后,酶切鉴定表明9R-Sox2已连接至pPYCAG载体上,如Fig 1B。

Fig 1 Construction of recombinant plasmid pPYCAG-9R-Sox2
2.2 表达9R-Sox2融合蛋白的阳性细胞克隆筛选和鉴定 pPYCAG-9R-Sox2转染至293T细胞中,经2 mg·L-1嘌呤霉素筛选1周,细胞免疫荧光鉴定细胞9R-Sox2蛋白表达,所有的细胞核均标记为绿色,说明表达9R-Sox2蛋白(Fig 2A),DAPI标记细胞核为蓝色荧光(Fig 2B),Fig A和Fig B融合后,发生重叠(Fig 2C),表明9R-Sox2表达在所有的细胞核,尽管Sox2前面加了9R短肽,但仍未改变其转录因子的特性。在对照细胞中未见有Sox2表达(Fig 2A',2B'和2A'B')。
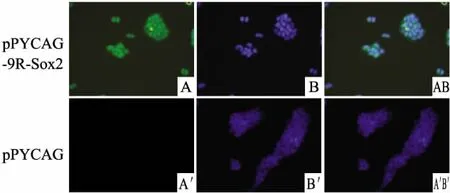
Fig 2 9R-Sox2 expression in 293T cells
2.3 9R-Sox2细胞通透和对成纤维细胞促增殖效应 小鼠成纤维细胞分为两组,分别弃去小鼠成纤维细胞培养基,加入含9R-Sox2细胞裂解液和转染空质粒的细胞裂解液,37℃培养箱放置1 h,PBS清洗3次以上,一组细胞用于细胞免疫荧光检测,一组细胞加入培养基继续培养,48 h后检测PCNA的表达量。细胞免疫荧光检测结果显示,9R-Sox2已定位于小鼠成纤维细胞核(Fig 3A,3B,3AB),表明9RSox2已穿透细胞细胞膜进入核内,对照组未见Sox2表达(Fig 3A',3B',3A'B')。Western blot结果显示,细胞经含9R-Sox2裂解物处理后,PCNA相对于对照组表达明显上调。
3 讨论
目前对于体细胞重编程成iPS细胞,重编程的效率成为首要需解决的问题。解决措施主要有添加TGF-β、MEK和GSK3信号通路抑制剂和Wnt/βcatenin激活剂而达到提高重编程的效率[5-8],但仍通过病毒的方式得到iPS细胞,安全性成为主要问题。近年来采用蛋白重编程代替病毒转导的方式,即表达具有穿透性的蛋白,加入成纤维细胞的培养基中,这些蛋白可直接进入细胞,经过重编程获得安全可靠的iPS细胞。在这些研究中,已有原核细胞表达重组蛋白,但由于蛋白表达存在翻译后修饰,此过程影响蛋白的活性和其生物学功能,蛋白的活性影响到其功能的发挥,也影响到重编程的效率。在此基础上,采用真核表达的方式得到活性高的表达蛋白,但由于表达系统的低效,蛋白表达量也会影响重编程的效率。因此,当重编程提高时,iPS细胞的安全性存在问题;而当安全性问题解决时,重编程的效率被降低。针对这些存在的问题,在本课题的研究中,采用目前最高效的蛋白表达系统表达通透性的蛋白并对其功能进行鉴定。
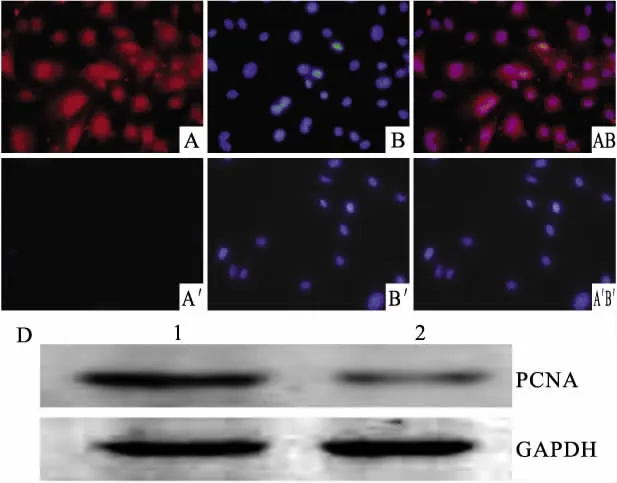
Fig 3 The cell-penetrated function of 9R-Sox2 and its proliferative effect on MEFs
由于Sox2蛋白转录因子活性特点,可表达并定位于细胞核中,而纯化的Sox2蛋白即使加入细胞培养基中,也不会穿透细胞膜进入细胞核中发挥作用。通过多聚酶链反应(PCR)扩增小鼠的Sox2基因,同时在其N端融合了9个精氨酸短肽,可以自由穿过细胞膜,使其具备细胞穿透功能[9]。扩增后的9RSox2基因克隆至高效表达载体pPYCAG上,此载体具有如下特点:最强的融合启动子;在含大T抗原的细胞中如293T细胞,随着细胞的分裂,此表达载体不断的复制,从而实现最高效的表达。
重组质粒pPYCAG-Sox2转染至293T细胞中,为进一步保证所有细胞表达9R-Sox2蛋白,细胞转染后进行抗性基因筛选,进一步使蛋白表达量提高。除了蛋白表达量影响细胞重编程效率,蛋白的活性也是重要因素之一。对表达9R-Sox2蛋白的细胞裂解,得到的蛋白混合物,对其进行活性和功能的检测,加入至成纤维细胞中,作用1 h后换液,再进行细胞免疫荧光鉴定,和对照细胞相比,经过9R-Sox2蛋白的混合物处理的成纤维细胞在细胞核位置有Sox2蛋白存在,表明9R-Sox2蛋白具备穿透功能。Sox2为细胞转录因子,对细胞的增殖有促进作用[10],对蛋白混合物处理48 h后的细胞进行增殖的检测。增殖细胞核抗原(PCNA)仅在增殖的细胞中合成和表达,可作为细胞增殖的可靠的评价指标[11-12]。PCNA在含9R-Sox2蛋白混合物组表达明显上调,进一步说明9R-Sox2进入细胞内发挥功能。
本研究在提高蛋白表达量的同时,也验证了表达的蛋白具备细胞通透及促进靶细胞增殖的功能,为深入研究蛋白重编程提供依据及细胞学基础。
[1] Takahashi1 K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,126:663-76.
[2] Huangfu D,Osafune K,Maehr1 R,et al.Induction of pluripotent stem cells from primary human fibroblasts with only Oct4 and Sox2[J].Nat Biotechnol,2008,26:1269-75.
[3] Zhou H,Wu S,Joo J Y,et al.Generation of induced pluripotent stem cells using recombinant proteins[J].Cell Stem Cell,2009; 4(5):381-4.
[4] Kim D,Kim C H,Moon J I,et al.Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J].Cell Stem Cell,2009,4(6):472-6.
[5] Silva J,Barrandon O,Nichols J,et al.Promotion of reprogramming to ground state pluripotency by signal inhibition[J].PLoS Biol,2008,6:e253.
[6] Li W,Wei W,Zhu S,et al.Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors[J].Cell Stem Cell,2009,4:16-9.
[7] Huangfu D,Maehr R,Guo W,et al.Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds[J].Nat Biotechnol.2008,26:795-7.
[8] Marson A,Foreman R,Chevalier B,et al.Wnt signaling promotes reprogramming of somatic cells to pluripotency[J].Cell Stem Cell.2008,3:132-5.
[9] Wu H Y,Tomizawa K,Matsushita M,et al.Poly-arginine-fused calpastatin peptide,a living cell membrane-permeable and specific inhibitor for calpain[J].Neurosci Res.2003,47(1):131-5.
[10]Lin F,Lin P,Zhao D,et al.Sox2 targets cyclinE,P27 and surviving to regulate-independent human prostate cancer cell proliferation and apoptosis[J].Cell Prolif.2012,45(3):207-16.
[11]盛 瑞,顾振纶,谢梅林,等.EGCG抑制心肌肥厚胶原生成和细胞增殖[J].中国药理学通报,2006,22(9):1095-9.
[11]Sheng R,Gu Z L,Xie M L,et al.EGCG inhibition against colleen accumulation and cell proliferation in cardiac hypertrophy[J].Chin Pharmacol Bull,2006,22(9):1095-9.
[12]仇 炜,雷宇华,苏 明,等.下调PCNA和VCAM-1表达参与山奈酚抑制人前列腺癌细胞增殖[J].中国药理学通报,2011,27(4):553-7.
[12]Qiu W,Lei Y H,Su M,et al.Kaempferol inhibits proliferation of hum an prostate cancer PC-3 cells via down-regulation of PCNA and VCAM-1[J].Chin Pharmacol Bull,2011,27(4):553-7.

