CCH1或MID1基因缺失对白念珠菌药物耐受性及致病性的影响
王慧,芦广庆,杨宝鹏,王帆,喻其林,徐宁,程欣欣,邢来君,李明春
1 南开大学微生物学系 分子微生物学与技术教育部重点实验室,天津 300071
2 农业部环境保护科研监测所,天津 300191
白念珠菌Candida albicans是医院获得性真菌病的主要感染源之一,也是深部真菌感染的首要病原菌,引起的致死率可达38%~49%[1-2]。临床上,在白念珠菌感染的治疗过程中,凸显的严重问题就是菌株对各类药物产生的抗药性,尤其是对唑类药物[3]。在光滑念珠菌Candida glabrata和酿酒酵母中,对唑类药物的耐受性都是受到Ca2+信号调控的[4-5],当暴露于抗真菌药物下时,细胞膜的稳定性受到干扰,导致胞内Ca2+浓度上升[6]。
钙细胞存活 (Calcium cell survival,CCS)[7]途径是 Bonilla等首次在酿酒酵母中发现的一个钙信号转导途径,通过 Cch1-Mid1钙通道引发Ca2+内流,并借助钙信号的传递,激活钙调神经磷酸酶 (Calcineurin,CaN) 及其下游转录因子Crz1p来介导细胞参与多种外界压力下的存活。通常情况下,Cch1和Mid1组成蛋白复合体[8],Cch1是核心,作为复合体的催化亚基,而Mid1作为调节亚基辅助Cch1完成钙通道复合体的功能,二者缺一不可。在酿酒酵母中,内质网压力能够通过 Mpk1途径激活 Cch1-Mid1钙离子通道,引起胞内 Ca2+浓度的上升,变化的 Ca2+与CaM结合,进而激活CaN[9]。因此,Cch1和Mid1对CaN的激活具有调控作用,之后借助胞内Ca2+的转运体,降低胞内的Ca2+水平,同时也调控着这些胞内钙泵的活性。
CCS途径中的CaN参与抗真菌药物的耐受性[10],其催化亚基Cna1或调节亚基Cnb1任何一个的缺失都会对抗真菌药物表现出强烈的敏感性,同时对白念珠菌菌株毒力也具有减弱的作用,有研究表明,对唑类药物例如氟康唑FLUC呈现耐受性的菌株往往具有更强的致病性[11],可见白念珠菌的药物耐受性与致病性之间有密切的关系。研究发现,作用于 CaN的免疫抑制剂环孢菌素 (Cyclosporin A,CsA) 或他克莫司(FK506) 与氟康唑 (FLUC) 的联合使用具有杀灭真菌的作用,而FLUC的单独使用仅仅具有抑制真菌的作用[12]。CCS途径对于真菌在唑类药物压力下的存活发挥着重要作用,缺少 CCS途径的酵母在仅仅能抑制细胞生长的唑类药物浓度下就死亡了[13],CCS途径中其他成员或是尚未鉴定出来的新成员也有可能参与到药物耐受性中。是否 Cch1-Mid1也参与白念珠菌的药物耐受性?我们将利用微量液基稀释法和药物平板敏感性试验进行研究,并进一步通过建立小鼠系统感染模型的方法研究CCH1或MID1基因的缺失对菌株毒力的影响。
1 材料与方法
1.1 菌株、质粒和引物
实验使用的菌株和质粒见表1,引物见表2。
1.2 主要试剂
CIAP碱性磷酸酶、各种限制性内切酶、Taq DNA聚合酶等购自宝生物大连有限责任公司;RPMI1640培养基粉末购自GBCO公司;5-氟乳清酸 (5-FOA) 购自北京鼎国生物技术有限责任公司;氟康唑 (FLUC)、伊曲康唑 (ITRA) 等唑类药物购自Sigma公司;盐酸维拉帕米 (Vpi)、盐酸特比萘芬 (TER) 等药物购自中国药品生物制品检定所;其余有机试剂和药品均为国产分析纯,所有引物均由北京奥科公司合成。

表1 本实验使用的菌株和质粒Table 1 Strains and plasmids used in this study

表2 本实验所用的引物Table 2 Primers used in this study
1.3 培养基
白念珠菌培养使用的所有培养基 (SC-ura除外) 均添加终浓度为80 mg/L的尿苷。YPD培养基:1%酵母浸出粉,2%蛋白胨,2%葡萄糖。SC培养基:0.67%无氨基酵母氮源,0.2%氨基酸混合物粉末,2%葡萄糖。5-氟乳清酸 (5-FOA)培养基 (1 L):6.7 g无氨基酵母碳源,20 g葡萄糖,0.8 g尿苷,2 g无氨基酸混合粉末,20 g琼脂粉,1 g 5-氟乳清酸 (5-FOA)。RPMI 1640培养基:2.080 g RPMI 1640粉末,6.906 g苯磺酸 (MOPS),40 mL 10%葡萄糖溶液,加蒸馏水定容到200 mL,混匀后用1 mol/L NaOH溶液调pH至7.0,使用前进行抽滤除菌。
1.4 白念珠菌CCH1和MID1基因回补质粒的构建
设计一对带有PstⅠ酶切位点的引物CCH1-5RC和CCH1-3RC,以NKC18基因组DNA为模板,扩增获得一条8.7 kb的片段,其中包括1 kb的启动子、CCH1基因的ORF区和终止子区。将该片段用PstⅠ进行酶切,纯化后与同样经过PstⅠ内切酶消化过,并经碱性磷酸酶CIAP去磷酸化处理的白念珠菌表达质粒pCR4进行连接,然后将连接产物转化大肠杆菌,并在 LB+Amp的固体培养基中筛选转化子,获得正确的质粒pCR4-CCH1。pCR4-MID1质粒的获得需要设计一对带有 BamHⅠ和 KpnⅠ酶切位点的MID1-5RC和MID1-3RC引物,同样以NKC18基因组DNA为模板,进行PCR扩增,获得一条3.1 kb包含MID1基因1 kb启动子、ORF区和终止子区的片段。将该片段用BamHⅠ和KpnⅠ进行双酶切,纯化后与同样经过 BamHⅠ/KpnⅠ消化过的pCR4质粒进行连接,转化大肠杆菌并获得正确的质粒pCR4-MID1。
1.5 药物平板敏感性试验
挑取不同实验菌株的单菌落,接种至 5 mL YPD液体培养基中,30 ℃过夜培养,再转接至30 mL YPD液体培养基中使起始OD600约为0.1,30 ℃培养大约4~5 h到对数生长期,加入药物氟康唑或伊曲康唑至各预计的终浓度,在37 ℃进行振荡培养。分别在预先设定的时间点:0、5、10、20、30、60、90 min时取样,每次取5 μL点在固体YPD平板上,点样后,37 ℃培养24 h,观察并拍照。
1.6 微量液基稀释法
依照酵母菌敏感性测定 CLSI-M27-A2方案[15]的微量液基稀释法对野生型菌株和其他各缺失菌株进行药物敏感性测定。
1.7 小鼠感染模型的建立
进行毒力分析建模的小鼠为ICR雌性小鼠,鼠龄为6~8周。注射用的各菌株在SC培养基中过夜培养并转接至新鲜培养基中再培养3~4 h,然后取适量菌液离心后悬浮于1 mL 0.9%生理盐水中,用血球计数板计数。分别用生理盐水将各株注射用菌株的菌液浓度调至 5×106cells/mL。用0.25 mL注射器和4号针头注射小鼠尾静脉,每只小鼠注射0.1 mL菌液,每种菌株注射10只小鼠。随后每天对小鼠的死亡情况进行观察和记录,观察周期为30 d。通过绘制小鼠的存活率曲线,利用SPSS软件进行Kaplan-Meier Test统计学分析,来判定不同菌株的毒力变化情况。
2 结果与分析
2.1 白念珠菌CCH1和MID1基因回补缺失菌株的构建
质粒pCR4含有的选择标记为URA3,缺失菌株cch1Δ/Δ (cch1::CCH1/cch1:: URA3-dpl200)和 mid1Δ/Δ (mid1::MID1/mid1:: URA3-dpl200)中的URA3标记必须被消除后,才能使用构建的pCR4-CCH1和pCR4-MID1质粒用于相应基因的回补。分别将cch1Δ/Δ和mid1Δ/Δ缺失菌株涂布于含有5-FOA和尿苷的SC培养基中,用于标记的弹出。3 d后挑取转化子,提取基因组并以CCH1/MID1-5det和CCH1/MID1-3det为引物,检测基因型。对于没有去除URA3标记的菌株,PCR得到两条带,分别为ARG4和URA3标记带[14];而对于去除URA3标记的菌株,ARG4标记带保留,由于缺失菌株中的URA3-dpl200片段两端含有同源序列,在 5-FOA选择压力下能够将自身环化,从基因组中弹出一部分,使检测带变短。如图 1所示,对于 URA3标记消除的cch1Δ/Δ菌株,PCR检测正确的结果为 2.3 kb (ARG4) 和1.0 kb (泳道1,2);对于mid1Δ/Δ菌株,PCR检测正确的结果为2.4 kb (ARG4) 和750 bp (泳道3,4),表明我们获得了正确的URA3标记被消除的菌株 cch1::ARG4/cch1::dpl200 和mid1::ARG4/mid1:: dpl200,分别命名为 NKC61和NKC60。

图1 URA3标记消除的cch1Δ/Δ和mid1Δ/Δ菌株的鉴定Fig. 1 PCR analysis of URA3 dropping out in cch1Δ/Δ and mid1Δ/Δ strains. 1−4: genomic DNA from cch1Δ/Δ and mid1Δ/Δ strains were used as templates for PCR detection; 5: NKC18 was used as template with primers MID1-5detect and MID1-3detect (1.7 kb); M: DNA marker Ⅲ.
将pCR4和pCR4-CCH1分别转化NKC61菌株,再将pCR4和pCR4-MID1分别转化NKC60菌株,在SC-Ura选择性培养基中筛选转化子,分别以CCH1/MID-RC1 和CCH1/MID1-RC2为检测引物进行转化子的 PCR验证,该引物从CCH1和MID1基因所敲除的那部分序列中设计选取,鉴定结果如图2所示:对于cch1Δ/Δ+CCH1回补菌株,扩增得到 1.0 kb的片段;对于mid1Δ/Δ+MID1回补菌株,扩增得到824 bp的片段;而转化空质粒的 cch1Δ/Δ+pCR4 和mid1Δ/Δ+pCR4菌株,PCR扩增没有能够得到目的条带,依此鉴定并获得了正确的回补缺失菌株cch1Δ/Δ+CCH1和 mid1Δ/Δ+MID1,并将该菌株分别命名为NKC53和NKC55。
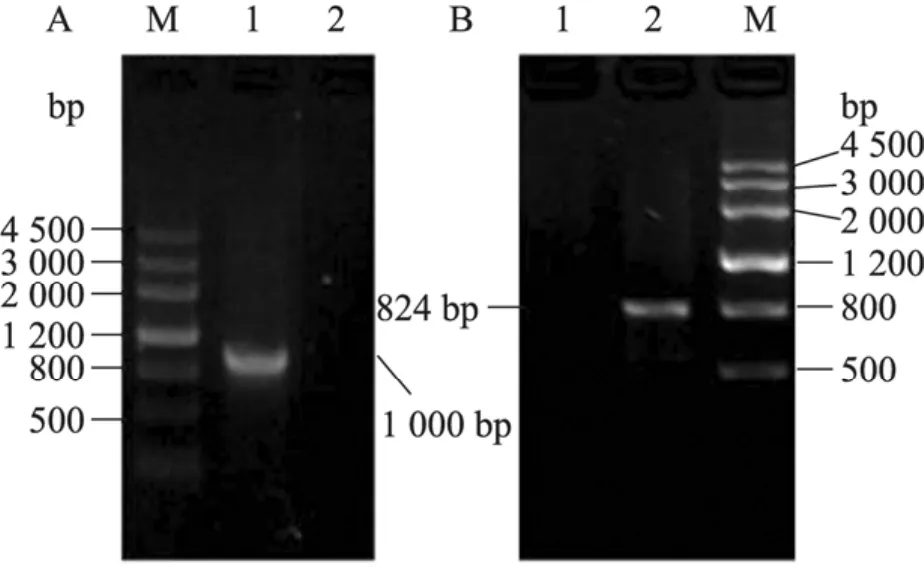
图2 回补缺失菌株 cch1Δ/Δ+CCH1和 mid1Δ/Δ+ MID1的鉴定Fig. 2 PCR analysis of cch1Δ/Δ and mid1Δ/Δ recomplementation. M: markerⅢ. (A) 1: cch1Δ/Δ+ CCH1 (1.0 kb); 2: cch1Δ/Δ+pCR4. (B) 1: mid1Δ/Δ+ pCR4; 2: mid1Δ/Δ+MID1 (824 bp). Genomic DNA from all strains was used as templates with primers CCH1/MID-RC1 and CCH1/MID1-RC2.
2.2 CCH1或MID1基因的缺失对药物敏感性的变化
为了更方便地对药敏实验结果进行比较分析,使用从临床分离的耐药型和敏感型的白念珠菌,作为实验对照组。以ATCC22019作为质控菌株,如表3所示,质控菌株对FLUC的MIC值为2或4 mg/L,对ITRA的MIC值为0.064或0.128 mg/L,均在CLSI M27-A2规定的范围内[16],证明操作无误,测定结果准确可靠。用微量液基稀释法测定菌株对药物的敏感性时,通常用以下标准进行界限判定:以 FLUC对菌株的MIC≤8 mg/L为敏感,16~32 mg/L为剂量依赖性敏感,MIC≥64 mg/L为耐药;以ITRA对菌株的MIC≤0.12 mg/L为敏感,0.25~0.5 mg/L为剂量依赖性敏感,≥1 mg/L为耐药。表3的结果显示:1) 对照组CA03997和CA90菌株的MIC测定结果均符合以上判定标准,分别为药物耐受菌和敏感菌,保证了实验体系没有问题;2) 野生型菌株对FLUC和ITRA药物的敏感性可以界定为剂量依赖性敏感;3) cch1Δ/Δ 和mid1Δ/Δ缺失菌株对FLUC和ITRA均表现出药物敏感性,并接近于敏感菌CA90的MIC值;4) 回补缺失菌株cch1Δ/Δ+CCH1和mid1Δ/Δ+MID1对药物的敏感性也在接近剂量依赖性敏感的范围,接近于野生型菌株的水平,表明Cch1-Mid1参与了白念珠菌对唑类药物耐受性的调控。
我们同时也利用固体平板药物敏感性试验,观察并分析了上述不同菌株对药物 FLUC敏感性的变化。将处于对数生长期的细胞转移至添加有8 mg/L FLUC的YPD培养基中,在37 ℃振荡培养,并且按图3所示的不同时间点进行取样,分别取样5 μL,点种在YPD固体平板上。37 ℃静置培养16 h后,观察结果如图3所示:cch1Δ/Δ和mid1Δ/Δ缺失菌株对FLUC表现出高度的敏感性,菌体生长状况与敏感菌相似;CCH1和MID1基因的回补对这种敏感表型具有恢复作用,但不能恢复至与野生型菌株相似的敏感表型;以上结果再次表明CCH1和MID1基因的缺失与FLUC药物敏感性有关。

表3 各菌株对唑类药物的敏感性Table 3 Susceptibility of C. albicans strains to azoles
2.3 CCH1和MID1基因参与药物耐受的机制推测

图3 FLUC药物平板敏感性试验Fig. 3 Susceptibility assay to FLUC.

图4 Ca2+对药物抗真菌活性的调节作用Fig. 4 Calcium modulation of antifungal drug activity.
Cch1-Mid1钙通道调控 Ca2+的内流,而CCH1和 MID1基因的缺失对药物表现出敏感性,Ca2+的浓度调节很可能与药物耐受性有关,所以我们在药物FLUC、ITRA和TER作用的基础上,分别添加0.05 mol/L或0.25 mol/L的Ca2+、0.5 mmol/L钙螯合剂EGTA或32 mg/L钙通道阻滞剂维拉帕米Vpi,利用划线培养的方法,对以上不同菌株的生长情况进行了比较,来研究CCH1和MID1基因参与药物耐受的机制。培养基放置于30 ℃培养,3 d后观察结果,如图4所示:1) 在对照组所在列,除野生型菌株和耐药菌CA03997外,其他各缺失菌株和敏感菌CA90对唑类药都表现出不同程度的敏感性;2) 低浓度0.05 mol/L Ca2+的添加抑制了唑类药物对白念珠菌的抗真菌活性,与对照组相比,所有菌株的生长状况有所好转,表明少量 Ca2+的存在帮助细胞获得了一定程度的对唑类药物的耐受性;3) 高浓度0.25 mol/L Ca2+、EGTA或Vpi的添加,与对照组相比,都增强了唑类药物对各菌株的抑制作用,使菌株的生长状况变得更差了;4) 然而,低浓度和高浓度Ca2+的添加都抑制了丙烯酰胺类药物TER的作用活性,但EGTA或Vpi的添加却同样也对 TER活性有增强作用,菌株表现出对药物更加敏感。综合以上结果表明:不同的 Ca2+浓度能够通过改善或抑制药物的抗真菌活性,来间接调节白念珠菌对药物的耐受性,虽然对唑类药物和丙烯酰胺类药物耐受的调控方式不同,但可以确定的是CCH1和MID1基因参与药物耐受性的调控,也是通过对Ca2+浓度变化的间接调节来实现的。
2.4 CCH1或MID1基因的缺失对白念珠菌毒力的影响
白念珠菌的药物耐受性和致病性之间有密切关系,所以我们通过建立小鼠系统感染模型的方法来进一步分析CCH1和MID1基因在影响菌株毒力方面的作用。在实验中,共饲养 50只小鼠,将这些小鼠随机平均分成1~5组,各组小鼠通过尾静脉分别注射野生型菌株、cch1Δ/Δ+ CCH1和mid1Δ/Δ+MID1回补菌株以及cch1Δ/Δ和mid1Δ/Δ缺失菌株,每种菌株注射10只小鼠,然后每天观察并记录小鼠的存活情况,观察周期为30 d。利用Kaplan-Meier Test进行统计学分析,判定不同组小鼠之间的生存差异,结果表明:注射野生型菌株、cch1Δ/Δ+CCH1和 mid1Δ/Δ+ MID1小鼠的平均存活时间分别为 12.2、14.6、15 d,统计学分析结果显示,在野生型菌株和回补菌株之间没有统计学差异 (P=0.306或0.233),然而注射cch1Δ/Δ和mid1Δ/Δ缺失菌株小鼠的平均存活时间为22.9 d和21.3 d,与野生型菌株之间存在差异,并且差异在极显著水平 (P<0.01) (图5)。实验结果表明,CCH1和MID1基因的缺失导致菌株的毒力大大降低。

图5 感染不同菌株的小鼠存活中位数分析Fig .5 Virulence assay of C. albicans strains.
3 讨论
CCS途径在介导酵母细胞存活的过程中发挥着非常广泛的作用,在这个途径中,钙调神经磷酸酶的功能在许多真核细胞中已被证实,并且有证据表明Cch1-Mid1钙通道能够通过调控Ca2+的内流,对钙调神经磷酸酶产生激活作用[7,13]。最初的 Ca2+波动引起一系列相关应答来帮助细胞在压力环境下存活,说明Cch1p和Mid1p在保证细胞存活方面发挥着最为基础的作用,因此,在我们的工作中,重点对白念珠菌 CCS途径中CCH1和MID1基因缺失所引起的药物耐受性和菌株毒力的变化进行研究。
CCH1和 MID1基因参与药物耐受性的调控,可以理解为通过调节Ca2+的作用,参与介导细胞在药物压力下的存活。这在我们的实验中也得到证实,CCH1和MID1基因的缺失在药物作用下表现的更为敏感,使用Ca2+的螯合剂EGTA或钙通道阻滞剂 Vpi联合抗真菌药物一起作用时,能够改善药物作用。所以,以此确定 CCS途径通过对 Ca2+的调节,间接参与了药物耐受性。小鼠感染模型实验证明cch1Δ/Δ和mid1Δ/Δ菌株的毒力明显比野生型菌株弱,这与许多基因缺失突变对菌株毒力的影响非常相似。白念珠菌毒力的形成也是多种因素累积的效果,比如蛋白酶的分泌[11],细胞表面黏附素的合成[17]等。当细胞在接受外界持续和难以预知的生物或物理因子干扰的时侯,包括温度、环境pH、离子毒力、氧化胁迫压力和药物作用等,白念珠菌在借助适当的途径来感知和应答这些环境信号的同时,就会引起细胞自身的生理学、形态以及粘附特性的改变,从而提高细胞对环境变化的适应性,因此表现为菌株毒力发生变化。在我们的实验中同时也发现cch1Δ/Δ和mid1Δ/Δ菌株并不是完全毒力丧失,只是毒力减弱了,但仍然能够对小鼠产生致死性的感染。这表明小鼠体内的这种环境可能诱导了其他一种或几种途径促进了 cch1Δ/Δ和mid1Δ/Δ菌株的菌丝形成,或者与钙调神经磷酸酶的作用有关。总之,CCH1和MID1基因在参与白念珠菌药物耐受性和致病性调控方面发挥着重要作用。白念珠菌的致病性与药物耐受性之间有密切的关系。分泌型天冬氨酸蛋白酶 (Sap) 目前被认为是白念珠菌主要的毒力因子之一[18],与白念珠菌的黏附力和组织侵袭有关。研究发现对药物呈现耐受性的菌株比药物敏感株具有更大的毒性,而且耐药株在FLUC浓度逐渐增加的环境下生长会导致剂量依赖性的体外分泌型天冬氨酸蛋白酶产量增加[19],以及耐药基因 MDR1的过度表达。Fekete-Forgacs等将FLUC敏感型的野生型白念珠菌诱导为耐FLUC的实验变异株,发现变异株的Sap分泌明显强于自然分离菌株[20],在临床白念珠菌耐药和致病性的研究中,更多的是用蛋白酶活力作为反映耐药菌株毒力和致病性强弱的直接指标[21]。所以,在我们的实验中,是否在那些对药物呈现敏感性的 cch1Δ/Δ和
mid1Δ/Δ菌株中,分泌型天冬氨酸蛋白酶的产量也会表现为降低,还有待进一步研究证实。
致谢:本实验中的部分菌株和质粒由明尼苏达大学Dr. Dana Davis教授和江南大学蒋伶活教授惠赠,在此表示衷心感谢!
[1] Koh AY, Köhler JR, Coggshall KT, et al. Mucosal damage and neutropenia are required for Candida albicans dissemination. PLoS Pathog, 2008, 4(2): e35.
[2] Ruhnke M, Maschmeyer G. Management of mycoses in patients with hematologic disease and cancer——review of the literature. Eur J Med Res, 2002, 7(5): 227−235.
[3] Andes D, Forrest A, Lepak A, et al. Impact of antimicrobial dosing regimen on evolution of drug resistance in vivo: fluconazole and Candida albicans. Antimicrob Agents Chemother, 2006, 50(7): 2374−2383.
[4] Edlind T, Smith L, Henry K, et al. Antifungal activity in Saccharomyces cerevisiae is modulated by calcium signalling. Mol Microbiol, 2002, 46(1): 257−268.
[5] Kaur R, Castaño I, Cormack BP. Functional genomic analysis of fluconazole susceptibility in the pathogenic yeast Candida glabrata: roles of calcium signaling and mitochondria. Antimicrob Agents Chemother, 2004, 48(5): 1600−1613.
[6] Patterson RL, van Rossum DB, Gill DL. Storeoperated Ca2+entry: evidence for a secretion-like coupling model. Cell, 1999, 98(4): 487−499.
[7] Bonilla M, Cunningham KW. Mitogen-activated protein kinase stimulation of Ca2+signaling is required for survival of endoplasmic reticulum stress in yeast. Mol Biol Cell, 2003, 14(10): 4296−4305.
[8] Peiter E, Fischer M, Sidaway K, et al. The Saccharomyces cerevisiae Ca2+channel Cch1pMid1p is essential for tolerance to cold stress and iron toxicity. FEBS Lett, 2005, 579(25): 5697−5703.
[9] Aramburu J, Heitman J, Crabtree GR. Calcineurin: a central controller of signalling in eukaryotes. EMBO Rep, 2004, 5(4): 343−348.
[10] Sanglard D, Ischer F, Marchetti O, et al. Calcineurin A of Candida albicans: involvement in antifungal tolerance, cell morphogenesis and virulence. Mol Microbiol, 2003, 48(4): 959−976. [11] Wu T, Wright K, Hurst SF, et al. Enhanced extracellular production of aspartyl proteinase, a virulence factor, by Candida albicans isolates following growth in subinhibitory concentrations of fluconazole. Antimicrob Agents Chemother, 2000, 44(5): 1200−1208.
[12] Li Y, Sun SJ, Guo QJ, et al. In vitro interaction between azoles and cyclosporin A against clinical isolates of Candida albicans determined by the chequerboard method and time-kill curves. J Antimicrob Chemother, 2008, 61(3): 577−585.
[13] Bonilla M, Nastase KK, Cunningham KW. Essential role of calcineurin in response to endoplasmic reticulum stress. EMBO J, 2002, 21(10): 2343−2353.
[14] Wang H, Xu N, Xing LJ, et al. Effect of CCH1 and MID1 in calcium influx under alkaline pH and its regulation by Crz1p transcription factor in Candida albicans. Chin J Biotech, 2011, 27(6): 917−925.王慧, 徐宁, 邢来君, 等. 碱性pH条件下白念珠菌钙离子通道CCH1和MID1基因对钙内流的影响及Crz1p转录因子对其的调控作用. 生物工程学报, 2011, 27(6): 917−925.
[15] CLSI/NCCLS, Reference method for broth dilution antifungal susceptibility testing of yeasts. Approved standard M27-A2. National Committee for Clinical Laboratory Standards, 2002.
[16] Pfaller MA, Messer SA, Bolmström A, et al. Multisite reproducibility of the Etest MIC method for antifungal susceptibility testing of yeast isolates. J Clin Microbiol, 1996, 34(7): 1691−1693.
[17] Krasowska A, Murzyn A, Dyjankiewicz A, et al. The antagonistic effect of Saccharomyces boulardii on Candida albicans filamentation, adhesion and biofilm formation. FEMS Yeast Res, 2009, 9(8): 1312−1321.
[18] Schaller M, Januschke E, Schackert C, et al. Different isoforms of secreted aspartyl proteinases (Sap) are expressed by Candida albicans during oral and cutaneous candidosis in vivo. J Med Microbiol, 2001, 50(8): 743−747.
[19] Costa CR, Jesuíno RSA, de Aquino Lemos J, et al. Effects of antifungal agents in sap activity of Candida albicans isolates. Mycopathologia, 2010, 169(2): 91−98.
[20] Fekete-Forgács K, Gyüre L, Lenkey B. Changes of virulence factors accompanying the phenomenon of induced fluconazole resistance in Candida albicans. Mycoses, 2000, 43(7/8): 273−279.
[21] Jayatilake JAMS, Samaranayake YH, Cheung LK, et al. Quantitative evaluation of tissue invasion by wild type, hyphal and SAP mutants of Candida albicans, and non-albicans Candida species in reconstituted human oral epithelium. J Oral Pathol Med, 2006, 35(8): 484−491.

