NMDA受体NR2B亚型基因对海马成年新生神经元形态发生的影响1)
李志军,易陈菊,唐 娜
成年神经发生(adult neurogenesis)在哺乳动物前脑持续存在,脑卒中、癫痫、创伤、环境刺激、情绪等因素均会影响成年后神经发生。行为学证据表明[1,2],海马成年神经发生对于海马某些形式的学习、记忆以及情绪调节非常重要。成年新生神经元,具有长时程增强(long term potention,LTP)、动作电位诱发阈值降低、兴奋性增高等神经活性[3]。海马癫痫为神经兴奋性增加的最常见的形式之一,也可以诱发增加成年神经发生:在红藻氨酸注射诱发的癫痫模型[4]和癫痫的点燃激发模型均能观察到神经发生增加[5]。而在匹罗卡品诱发癫痫模型中,通过阻滞成年神经发生可以减少自发性复发性癫痫的发生[6]。因此,海马神经活性与成年神经发生之间存在着紧密的双向联系。
而NMDA受体依赖型的长时程增强是成年神经发生中神经活性、突触可塑性的重要证据,被认为是海马空间记忆的神经生物机制[7,8]。Ge等[3]研究发现,LTP是依赖于 NMDA 受体NR2B亚型基因的。因此,研究NMDA受体NR2B亚型基因对海马成年新生神经元发育成熟过程的影响,对于进一步探讨新生神经元的功能、神经活性、海马依赖的学习和记忆分子机制,以及未来可能的治疗策略,均具有非常重要意义。
本研究建立海马成年新生神经元NR2B基因敲除模型,观察NR2B基因敲除对成年新生神经元细胞形态、树突、棘突发育等的影响,进一步阐明NR2B基因在海马成年发生中的重要作用。
1 材料与方法
1.1 实验动物与分组 经基因型鉴定后的清洁级成年健康NR2Bfl/fl转 基 因 小 鼠[9](NR2B 基 因 被loxp 序 列 标 记 ),C57BL/6野生型小鼠(wild type,WT),同济医学院实验动物中心提供,体重20 g~30 g。NR2Bfl/fl转基因小鼠为实验组,C57BL/6小鼠为WT对照组。1.2 实验方法
1.2.1 海马成年新生神经元NR2B基因敲除模型制作 运用逆转录病毒基因标记技术,利用Cre-loxp重组酶体系,建立海马成年新生神经元单细胞NR2B基因敲除模型。本实验采用的是逆转录病毒载体 Moloney-RSV-pGFP:T2aCre(Dr.Wolfgang Kelsch馈赠):带有一个来源于Rous sarcoma virus内源性启动子RSV;p GFP与Cre基因由T2a序列连接,T2a序列保证了GFP基因与Cre基因的同时高效率表达[10]。
当逆转录病毒注射入成年神经发生部位时(海马齿状回颗粒下层),感染带有loxp打靶基因NR2B的神经祖细胞/母细胞,当Cre酶激活时,Cre-loxp重组酶系统工作从而产生海马新生单细胞NR2B基因敲除模型。当Cre在NR2Bfl/fl转基因小鼠海马齿状回表达后,GFP+阳性神经元为NR2B基因敲除海马新生神经元(ΔNR2B神经元)。野生型小鼠作为对照。
1.2.2 小鼠海马齿状回立体定位注射 Isofluran(Baxter)吸入麻醉(0.5 m L/100 g),固定小鼠于立体定位仪上(Kopf921,德国)。麻醉以及手术期间用加热毯持续加热,保持体温37℃~37.5℃。根据海马齿状回立体坐标定位(前囟向后2 mm,旁开1.3 mm,深1.8 mm),用牙科钻钻孔,在双侧海马各注射1 m L病毒(RSV-palmGFP:T2aCre)。
1.2.3 组织漂片制作和免疫组织化学染色 在逆转录病毒注射后17 d予以经心脏4%多聚甲醛灌注取脑。组织漂片(150 μm)于3%H2O2室温处理20 min~25 min。2%Triton X100室温破膜1 h。5%BAS+0.2%Triton X100室温封闭1 h。1抗工作液4度孵育24 h(兔抗EGFP 1∶1000,Invitrogen)。生物素标记的抗兔二抗(1∶500,Vector Laboratories),室温孵育4 h。辣根酶标记的工作液A+B(Vector Laboratories Burlingame,CA,USA):各1∶500+1%Triton X100用1×PBS稀释,孵育2 h~3 h。滴加DAB工作液200μL(5 mg/m L DAB)+800μL PBS+0.67μL 30%H2O2,显色满意后以PBS终止反应。各主要步骤间均以1×PBS漂洗3次~4次。
1.2.4 海马成年新生神经元形态重建 采用Olympus BX51显微镜系统和Neurolucida(MBF Bioscience)软件分析系统对DAB标记的GFP阳性细胞进行胞体、树突、棘突重建。Sholl分析[11]用来累计计算以胞体为中心,每间隔30μm直径范围内棘突(protrusions)密度和树突交叉(dendritic intersections)的数目,后者反映了树突复杂度(dendritic complexity)。
1.3 统计学处理 实验数据以均数±标准差(±s)表示。采用GraphPad Prism 5和SPSS for Windows统计软件处理。P<0.05为有统计学意义。
2 结 果
2.1 NR2Bfl/fl转基因小鼠基因型检测 NR2Bfl/fl转基因小鼠与C57BL/6野生小鼠配种。新生小鼠在1周内进行基因型确定。NR2Bfl/fl转基因小鼠条带大小为353bp,野生型的条带在231bp。详见图1。

图1 NR2Bfl/fl小鼠以及野生型小鼠和杂合子小鼠基因型鉴定图
2.2 NR2B基因敲除对海马成年新生神经元形态发生的影响
选择在逆转录病毒注射17 d后(17dpi)观察海马成年新生神经元形态,是因为出生后17 d左右为海马颗粒细胞棘突的发生峰值时间[12]。通过Neurolucida系统软件对GFP-DAB标记的颗粒细胞进行树突、棘突重建(WT,n=3;NR2Bfl/fl,n=3)。研究发现,ΔNR2B神经元在17 dpi时已经形成相对正常的树突分支,外形与WT神经元无异。而且WT与ΔNR2B神经元树突分支总长度类似(t=1.939,P=0.07)。而 ΔNR2B神经元树突棘突数目显著减少(t=3.806,P=0.0071)。详见图2。
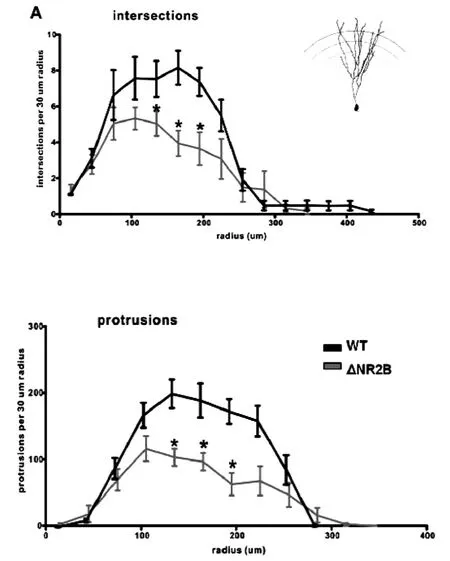
图3 Sholl分析对树突复杂度的统计

图2 NR2B基因敲除对海马成年新生神经元形态发生的影响
2.3 Sholl分析对树突复杂度的统计 对树突全长进行Sholl分析统计,观察在以胞体为中心原点,向四周放射状的每30μm范围内的树突交叉和棘突的分布密度。观察了WT、ΔNR2B神经元树突全长范围内的树突交叉和棘突数目。而后对每个观察点之间进行组间比较(ANOVA分析)。结果显示,在 WT、ΔNR2B神经元顶端树突,树突交叉和棘突数目均呈现相似的分布趋势:随着离胞体的距离渐远,树突交叉和棘突逐渐增加,在105μm~165μm直径处达到高峰,然后越往树突末梢,数目逐渐下降。相对于WT神经元来说,ΔNR2B神经元105μm~135 μm,135μm~165μm,165μm~195μm处树突交叉以及棘突密度均显著减少(P<0.05)。而在其他的观察点树突交叉、棘突的分布差异无统计学意义(P>0.05)。提示NR2B依赖型的树突交叉和棘突分布在这些区域。进一步分析发现,WT神经元 各记录点之间组间比较,树突交叉:F(8,80)=12.95,P=2.29×10-11;棘 突:F(8,89)=17.25,P=1.87×10-15。ΔNR2B神经元组间比较:树突交叉:F(8,80)=4.32,P=0.00027;棘突:F(8,89)=9.79,P=5.98×10-10。结果均提示树突交叉和棘突分布组间差异明显。详见图3。
3 讨 论
NMDA受体是兴奋性谷氨酸离子通道,介导中枢神经系统的信号传导。它由2个功能亚单位NR1和两个调节亚单位NR2(NR2A-D)组成。在胚胎期内,NR2B表达非常广泛;但在成年后NR2B表达局限于包括海马、皮层的前脑结构。NR2B全脑敲除模型或C末端截断模型均导致动物在出生立即死亡[13,14]。NR2B基因在胚胎期重点表达、决定胚胎期动物存活的特点,以及特异性的发育分布模式,引起了广泛的关注。
本课题组前期研究工作中发现,NMDA受体NR2B亚型基因在起源于侧脑室旁室管膜下区(subventricular zone)的嗅球成年新生神经元的生存,整合以及兴奋性神经网络的功能维持中起着至关重要的作用。因此,发源于海马齿状回颗粒下层的成年新生神经元是否遵循同样的生存规律值得深入探讨。
结果显示,海马成年新生神经元的树突生长并不依赖于NMDA受体NR2B亚型基因。表现为在新生神经元快速分化整合到原有神经网络的阶段,ΔNR2B和WT神经元均生成了形态类似、长度相近的树突。而近期研究结果亦有类似发现,NR2B基因对海马成年新生神经元和大脑Barrel皮层卫星细胞形态发育的影响不大,ΔNR2B神经元形成了与WT神经元相似长度的树突[15]。与此同时,另外两篇研究报道显示,NMDA受体的另一功能亚型NR1对大脑皮层锥体神经元的树突发生影响不大[16,17]。因此,NMDA 受体,包括 NR2B亚型在内,对神经元的树突长度影响甚微[15]。
然而,成年新生神经元NMDA受体NR2B亚型基因敲除显著减少棘突发生,表现在总棘突数目的下降;Sholl分析进一步显示,在树突的某些亚区域,NR2B依赖型的棘突发生减少尤为明显。由于棘突的形成在空间上受树突分枝的限制,早期的树突发展的模式变化可以限制后期棘突的分布[12];因此,当局部区域树突复杂性减低之后,会在相应的区域影响棘突的发育。在我们的观察中的确观察到类似的NR2B依赖的功能亚区。
Ultanir等[16]同样在NR1基因敲除的皮层锥体细胞中观察到棘突密度下降。这些类似的改变可能来自于NR1和NR2B亚单位共同作用于同样的突触后结构,并影响下游可能的级联信号反应。离体组织培养研究发现[18-20],树突上的棘突发生可以被谷氨酸或者LTP-诱发的刺激以一种NMDA受体依赖的方式激发。研究进一步指出,棘突的发生先于突触的形成,新发生的棘突更倾向于与原有的突触相关联,从而形成多突触结构[21]。如果该假设成立,那么NMDA受体信号通道可能在维持突触的稳定性中的作用更为关键。Alvarez等[22]在体外细胞培养的研究中,通过Si-RNA介导的NR1基因敲除,同样引起了棘突密度减低以及棘突失稳。近期在对海马CA3区锥体细胞研究发现,NR2B缺失会影响Actin细胞骨架蛋白的稳定性和动力学特性,而Actin是树突棘突上最主要的细胞骨架成分,因此,该研究认为NR2B与突触后巨分子复合物的互动是影响棘突稳定性的一个重要因素[23]。
Espinosa等[15]同时观察到树突发生模式的变化,例如海马新生NR2B缺陷神经元形成多分支树突;大脑皮层第4层Barrel皮层的星形兴奋性神经元将其突触延伸至毗邻的Barrel,与此同时,WT神经元树突延伸仅局限于一个Barrel。胚胎期NR2B和NR1基因敲除[13,24],以及皮层特异性 NR1基因敲除能引起皮层Barrel的缺失[16]。这些模式的改变可能来源于NMDA受体失活之后所相关联的下游的级联反应的阻滞[24]。本研究中没有观察到类似的树突发生模式的改变,尚需更进一步完善的研究。
[1]Deng W,Saxe MD,Gallina IS,etal.Adult-born hippocampal dentate granule cells undergoing maturation modulate learning and memory in the brain[J].J Neurosci,2009,29(43):13532-13542.
[2]Saxe MD,Battaglia F,Wang JW,etal.Ablation of hippocampal neurogenesis impairs contextual fear conditioning and synaptic plasticity in the dentate gyrus[J].Proc Natl Acad Sci USA,2006,103(46):17501-17506.
[3]Ge S,Yang CH,Hsu KS,etal.A critical period for enhanced synaptic plasticity in newly generated neurons of the adult brain[J].Neuron,2007,54(4):559-566.
[4]Steiner B,Zurborg S.Differential 24 h responsiveness of Prox1-expressing precursor cells in adult hippocampal neurogenesis to physical activity,environmental enrichment,and kainic acid-induced seizures[J].Neuroscience,2008,154(2):521-529.
[5]Smith PD,Mc Lean KJ,Murphy MA,etal.Seizures,not hippocampal neuronal death,provoke neurogenesis in a mouse rapid electrical amygdala kindling model of seizures[J].Neuroscience,2005,136(2):405-415.
[6]Jung KH,Chu K,Kim M,etal.Continuous cytosine-b-D-arabinofuranoside infusion reduces ectopic granule cells in adult rat hippocampus with attenuation of spontaneous recurrent seizures following pilocarpine-induced status epilepticus[J].Eur J Neurosci,2004,19(12):3219-3226.
[7]Martin SJ,Grimwood PD,Morris RG.Synaptic plasticity and memory:An evaluation of the hypothesis[J].Annu Rev Neurosci,2000,23:649-711.
[8]Niewoehner B,Single FN.Impaired spatial working memory but spared spatial reference memory following functional loss of NMDA receptors in the dentate gyrus[J].Eur J Neurosci,2007,25(3):837-846.
[9]von Engelhardt J,Doganci B,Seeburg PH,etal.Synaptic NR2A-but not NR2B-containing NMDA Receptors Increase with Blockade of Ionotropic Glutamate Receptors[J].Frontiers in Molecular Neuroscience,2009,2:19.
[10]Eterina NL,Levenson EA,Ehrenfeld E.Viable polioviruses that encode 2A proteins with fluorescent protein tags [J].J Virol,2010,84:1477-1488.
[11]Sholl D.Dendritic organization in the neurons of the visual and motor cortices of the cat[J].J Anat,1953,87(4):387-406.
[12]Zhao C,Teng EM,Summers RG,etal.Distinct morphological stages of dentate granule neuron maturation in the adult mouse hippocampus[J].J Neurosci,2006,26(1):3-11.
[13]Kutsuwada T,Sakimura K,Manabe T,etal.Impairment of suckling response,trigeminal neuronal pattern formation,and hippocampal LTD in NMDA receptor epsilon 2 subunit mutant mice[J].Neuron,1996,16:333-44.
[14]Sprengel R,Suchanek B,Amico C,etal.Importance of the intracellular domain of NR2 subunits for NMDA receptor function in vivo[J].Cell,1999,92:279-289.
[15]Espinosa JS,Wheeler DG,Tsien RW,etal.Uncoupling dendrite growth and patterning:Single-cell knockout analysis of NMDA receptor 2B[J].Neuron,2009,62:205-217.
[16]Ultanir SK,Kim JE,Hall BJ,etal.Regulation of spine morphology and spine density by NMDA receptor signaling in vivo[J].Proc Natl Acad Sci USA,2007,104:19553-19558.
[17]Adesnik H,Li G,During MJ,etal.NMDA receptors inhibit synapse unsilencing during brain development[J].Proc Natl Acad Sci USA,2008,105:5597-5602.
[18]Toni N,Buchs PA,Nikonenko I,etal.LTP promotes formation of multiple spine synapses between a single axon terminal and a dendrite[J].Nature,1999,402:421-425.
[19]Engert F,Bonhoeffer T.Dendritic spine changes associated with hippocampal long-term synaptic plasticity[J].Nature,1999,399:66-70.
[20]Maletic-Savatic M,Malinow R,Svoboda K.Rapid dendritic morphogenesis in CA1 hippocampal dendrites induced by synaptic activity[J].Science,1999,283:1923-1927.
[21]Knott GW,Holtmaat A,Wilbrecht L,etal.Spine growth precedes synapse formation in the adult neocortex in vivo[J].Nature Neurosci,2006,9:1117-1124.
[22]Alvarez VA,Ridenour DA,Sabatini BL.Distinct structural and ionotropic roles of NMDA receptors in controlling spine and synapse stability[J].J Neurosci,2007,27:7365-7376.
[23]Akashi K,Kakizaki T,Kamiya H,etal.NMDA receptor Glu N2B(GluR epsilon 2/NR2B)subunit is crucial for channel function,postsynaptic macromolecular organization,and actin cytoskeleton at hippocampal CA3 synapses[J].J Neurosci,2009,29(35):10869-10882.
[24]Li Y,Erzurumlu RS,Chen C,etal.Whisker-related neuronal patterns fail to develop in the trigeminal brainstem nuclei of NMDAR1 knockout mice[J].Cell,1994,76:427-437.
——壮肾

