表面展示鸡传染性支气管炎病毒M 41株S1蛋白的重组假型杆状病毒的构建
陈筱薇,樊惠英,林文耀,程晓亮,叶 昱,陈春丽,2,廖 明
(1华南农业大学兽医学院,农业部动物疫病防控重点实验室,广东广州 510642;2四川农业大学动物医学院,四川雅安 625000)
鸡传染性支气管炎(Infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起鸡的一种急性、高度接触性呼吸道传染病.本病于1931年在美国首次发现.在我国,邝荣禄于1972年在广东首次发现后,北京、上海等地相继有报道,目前已成为养鸡业中危害最大的传染病之一.IBV基因组编码N、M、E和S 4种蛋白.其中S蛋白由S1和S2两种糖多肽构成,S1蛋白是IBV最重要的保护性抗原,可诱导血凝抑制抗体和大部分病毒中和抗体的产生,还可以在鸡体内诱导I特异的细胞毒性T淋巴细胞(Cytotoxic T Lymphocyte,CTL)的免疫应答反应,关于IBV基因工程疫苗的研究,基本集中在S1基因上[1-4].在杆状病毒表面展示系统中用于和外源蛋白发生融合的囊膜糖蛋白gp64,是出芽型病毒(Budded virus,BV)特有的结构蛋白,由N末端信号肽和成熟蛋白(跨膜区TM和胞质区CTD)组成[5],介导病毒和昆虫细胞的融合及侵染过程.gp64被开发成杆状病毒表面展示系统来展示不同的目的蛋白,外源基因片段插入到病毒囊膜蛋白的信号肽与成熟蛋白之间,表达加工时信号肽被切除,形成的N端融合蛋白借助杆状病毒稳定地表达并展示于感染细胞或病毒粒子的表面,筛选得到表达有目的蛋白的重组杆状病毒.目前,杆状病毒表面展示系统已经被开发用于进行基因工程亚单位疫苗的研制[6-7].据此,本研究通过修饰外源基因,构建表面展示传染性支气管炎病毒M41株S1蛋白的重组杆状病毒,为传染性支气管炎病毒基因工程疫苗的研究提供新的选择.
1 材料与方法
1.1 材料
1.1.1 毒株与细胞 IBV-M41毒株由华南农业大学农业部动物疫病防控重点实验室分离并保存.Sf9昆虫细胞为GIBCO BRL公司产品.
1.1.2 菌种与质粒 pFsatbacTMDual为GIBCO BRL公司产品,pBACsurf-1为美国Novagen公司产品.大肠埃希菌DH5a、DH10Bac菌株由华南农业大学农业部动物疫病防控重点实验室保存.
1.1.3 主要试剂 ExTMTaq DNA多聚酶、dNTP,为大连宝生物工程公司产品,T4DNA连接酶和各种限制性内切酶等工具酶均为NEB(NEW ENGLAND BioLabs)公司产品.DNA凝胶纯化试剂盒为Promega公司产品.质粒抽提试剂盒为天根生化科技(北京)有限公司产品.昆虫细胞培养基(Grace’s)和LipofectamineTM2000转染试剂为美国Invitrogen公司产品.胎牛血清为奥地利PAA公司产品,抗IBV M41 S1的单克隆小鼠腹水为上海艾比玛生物医药有限公司产品,FITC标记山羊抗小鼠IgG为Sigma公司产品.
1.2 方法
1.2.1 重组质粒pBACsurf-dS1的构建 根据M41株序列设计合成1对扩增S1基因的引物PS1、PS2,上下游引物引入相同的酶切位点XmaⅠ引物序列如下,由Invitrogen公司合成.

扩增片段为1 542 bp,扩增的片段不含有S1基因的信号肽(SP).回收PCR产物并用XmaⅠ酶切,并将其克隆到同样用XmaⅠ酶切的表面展示载体pBACsurf-1,获得重组质粒pBACsurf-dS1.
1.2.2 重组转移质粒pFastBac-gp64-dS1的构建
以获得的重组质粒pBACsurf-dS1中gp4ss-dS1-gp64m序列,分别在上、下游引物的5'端引入限制性内切酶Eco RⅠ、XbaⅠ,利用 PCR方法扩增 gp4sshis-qS1-gp64m基因.

扩增片段为3 129 bp.将PCR产物回收并用Eco-RⅠ、XbaⅠ双酶切后,将其克隆到同样用 Eco RⅠ、XbaⅠ双酶切后的载体pFsatbacTMDual,构建重组转座质粒pFastBac-gp64-dS1(图1).
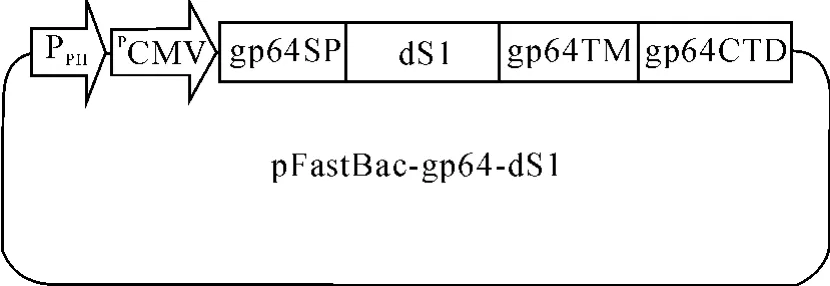
图1重组转座质粒pFastBac-gp64-dS1Fig.1 Construction of recombinant donor plasmid pFastBacgp64-dS1
1.2.3 重组穿梭载体Bacmid-gp64-dS1的获得 取2~5μL重组质粒 pFastBac-gp64-dS1与100μL DH10Bac大肠埃希菌感受态细胞混合,冰浴30 min后,于42℃ 45 s水浴进行热激,然后冰浴2 min,加入900μL LB液体培养基(高盐),37℃振摇培养4 h,按10-1、10-2、10-3稀释细胞后,各取100 μL 涂布于三抗高盐LB平板(Kan、Gen和Tet),37℃培养24~48 h,通过蓝白斑筛选、纯化白色阳性菌落,提取重组Bacmid质粒,以M13上下游引物进行PCR鉴定.
1.2.4 重组杆状病毒BV-dS1的获得 提取纯化Bacmid-gp64-dS1,利用脂质体 LipofectamineTM2000转染Sf9昆虫细胞,于28℃培养,待出现细胞病变后,收集培养物上清液即获得了重组杆状病毒BV-dS1.
1.2.5 重组杆状病毒BV-dS1感染Sf9昆虫细胞
细胞转染前1 d,将形态良好、生长旺盛的Sf9昆虫细胞以1×105孔-1的量接种到6孔板中,于37℃培养,待细胞长至单层,去除培养基,将10μL重组杆状病毒与1 mL昆虫细胞Grace’s培养液混和后,将此病毒感染液加入到Sf9昆虫细胞中,28℃培养2 h后,弃去感染液,并用PBS洗1遍,加入2 mL新鲜培养基,于37℃继续培养60 h后,用PBS洗涤,甲醇固定细胞后,以鼠抗M41株S1抗体为一抗,FITC标记的羊抗鼠IgG为二抗,进行间接免疫荧光试验.
2 结果
2.1 重组质粒pBACsurf-dS1的构建
对重组质粒pBACsurf-dS1进行XmaⅠ酶切鉴定,酶切后产生大小约为9 400和1 500 bp的2个片段,与预期大小一致(图2).在此基础上,进一步对pBACsurf-dS1进行测序,证实无碱基突变.
2.2 重组转移质粒pFastBac-gp64-dS1的构建
对重组质粒 pFastBac-gp64-dS1进行 Eco RⅠ、XbaⅠ双酶切鉴定,双酶切后产生大小约为5 400和3 100 bp的2个片段,与预期大小一致(图2).在此基础上,进一步对pFastBac-gp64-dS1进行测序,证实无碱基突变.
2.3 重组穿梭载体Bacmid-gp64-dS1的PCR鉴定
将重组转移质粒pFastBac-gp64-dS1转化DH10Bac感受态后,在含有三抗、IPTG和X-gal平板上进行筛选,待出现蓝白菌落后,挑选白色菌落,提取质粒用M13上下游引物进行PCR鉴定,PCR产物经0.01 g/mL的琼脂糖凝胶电泳后,在5 400 bp处可见特异性条带,证明gp4ss-his-qS1-gp64m基因与Bacmid已经成功地发生了特异性位点转座(图3).

图2 重组质粒pBACsurf-dS1、pFastBac-gp64-dS1的酶切鉴定Fig.2 Identification of transfer vector pBACsurf-dS1and pFastBac-gp64-dS1

图3 重组穿梭载体Bacmid-gp64-dS1的PCR鉴定Fig3 Identification of recombinant vector Bacmid-gp64-dS1 by PCR
2.4 重组杆状病毒BV-dS1的获得
利用脂质体转染法,将提取的重组穿梭载体Bacmid-gp64-dS1转染Sf9昆虫细胞,于28℃培养,待2~3 d后出现细胞病变,主要表现为细胞变大、变圆、膨胀、折光率增强等(图4).

图4重组杆状病毒BV-dS1感染Sf9昆虫细胞Fig.4 Sf9 cells infected by the recombinant baculovirus BV-dS1
2.5 重组杆状病毒BV-dS1的鉴定
重组杆状病毒感染Sf9昆虫细胞后,进行间接免疫荧光试验.结果表明,重组杆状病毒BV-dS1毒感染Sf9昆虫细胞细胞膜上能产生特异性免疫荧光,而杆状病毒野毒毒感染Sf9昆虫细胞未见任何特异荧光,表明重组杆状病毒能够在其感染的细胞表面表达S1蛋白(图5).

图5 BV-dS1感染Sf9昆虫细胞的间接免疫荧光试验Fig.5 Indirect immunofluoresent assay of Sf9 cells infected with BV-dS1 by IFA
3 讨论
S蛋白是IBV最重要的保护性抗原,其作用表现为刺激机体产生中和抗体,在病毒吸附细胞过程中发挥作用,在血清学分类上起决定性作用.S蛋白上存在8个抗原决定簇,其中S1上有6个,是重要的免疫原基因.S1蛋白在IBV最外层形成蘑菇状的突起,膜定位信号为N端第1~18位氨基酸,S1蛋白近N端第37~81位,第117~160位,第269~298位氨基酸构成了S1蛋白的抗原决定簇[8-9],该定位区域缺失不会影响S1蛋白的免疫原性.
杆状病毒是昆虫专一性的病原病毒,是目前为止发现最早、研究最多且实用意义很大的昆虫病毒,可作为一种新型的基因工程载体之一,具有目的基因容量大、蛋白表达效率高、翻译后修饰系统、操作简单等特点,以它作为载体所开展的基因工程疫苗方面的研究彰显了其广泛的应用前景[10-12].
杆状病毒载体目前的主要应用包括做为外源基因的转移载体及表面展示外源基因的载体等.作为外源基因的转移载体,杆状病毒将外源基因转导入动物细胞,使外源基因在其中瞬时高效表达[13-14].因此,杆状病毒作为基因转移载体,对于表达一些结构复杂的蛋白或同时表达多个基因,甚至携带整个病毒基因组,都体现了其他基因转移载体难以比拟的优势.但是,杆状病毒不能在动物细胞内复制,因此其在动物细胞中的表达持续时间较短,所需的病毒量大,疗效有限.杆状病毒作为表面展示外源基因的载体,将外源蛋白或多肽与杆状病毒的囊膜糖蛋白融合,使之在感染细胞的表面或病毒粒子的囊膜上获得有效的展示.杆状病毒表面展示系统除了具有杆状病毒载体的一般优点外,与亚单位疫苗比较,表达的蛋白在病毒表面,理论上能很好地刺激细胞免疫;而且使用纯化的杆状病毒可以减少佐剂生物用量,因为杆状病毒本身就可以作为佐剂刺激机体反应.目前,多种大分子的复杂真核蛋白已经在杆状病毒表面展示系统表达展示,在展示病毒蛋白方面,如SARS冠状病毒表面S蛋白、柏格(氏)鼠疟原虫环孢子蛋白,口蹄疫病毒A位点都被展示到杆状病毒粒子表面,免疫动物均能获得理想的免疫原性[15-17].另外,用杆状病毒表面展示系统生产目的蛋白,纯化过程特别简单,只需要超速离心得到重组杆状病毒即可同时获得目的蛋白,纯化费用低、操作简单、可以规模化生产,解决了目的蛋白纯化代价昂贵、程序复杂的现状[18].
本研究获得重组转移质粒pFastBac-gp64-dS1后,再通过细菌内同源重组将转移载体上的外源基因整合到穿梭质粒bacmid中,获得重组质粒后转染Sf9细胞拯救出重组杆状病毒,然后对重组杆状病毒在实验室条件进行稳定性试验,通过对重组杆状病毒的鉴定,证明了重组杆状病毒BV-dS1的构建成功.
本研究构建了能表面展示鸡传染性支气管炎病毒S1蛋白的重组假性杆状病毒,为研制既具备能诱导体液免疫应答及细胞免疫应答的全病毒灭活疫苗的优势、又具备亚单位疫苗的安全性的鸡传染性支气管炎的新型疫苗,提供一个可供选择的新策略.
[1]IGNJATOVIC J,GALLIL.Immune responses to structural proteins of avian infectious bronchitis virus[J].Avian Pathol,1995,24(2):313-332.
[2]SEO H S,WANG L,SMITH R,etal.The carboxyl-terminal 120-residue polypeptide of infectious bronchitis virus nucleocapsid induces cytotoxic T lymphocytes and protects chickens from acute infection[J].JVirol,1997,71(10):7889-7894.
[3]CLLISSON EW,PEIJian-wu,DZIELAWA J,etal.Cytotoxic T lymphocytes are critical in the control of infectious bronchitis virus in poultry[J].Dev Comp Immunol,2000,24(2/3):187-200.
[4]KWON H M,JACKWOOD M W.Molecular cloning and sequence comparison of the S1 glycoprotein of the Gray and JMK strains of avian infectious bronchitis virus[J].Virus Genes,1995,9(3):219-229.
[5]MARKOVIC I,PULYAEVA H,SOKOLOFF A.Membrane fusion mediated by baculovirus gp64 involves assembly of stable gp64 trimers intomultiprotein aggregates[J].JCell Biol,1998,143(5):1155-1166.
[6]YANG Ding-gang,CHUNG Yao-chi,LAI Yiu-kay,et al.Avian influenza virus hemagglutinin display on baculovirus envelope:cytoplasmic domain affects virus properties and vaccine potential[J].Mol Ther,2007,15(5):989-996.
[7]XU Xin-gang,TANG De-wen,CHIOU Ming-tong,et al.Baculovirus surface display of NS3 nonstructural protein of classical swine fever virus[J].JVirol Methods,2009,159(2):259-264.
[8]GELB J,Jr,KEELER C L,Jr,NIX W A,et al.Antigenis1 and S-1 genomic characterization of the delaware variant serotype of infectious bronchitis virus[J].Avian Dis,1997,41(3):661-669.
[9]GELB J,WEISMAN Y,LADMAN B S,et al.S1 gene characteristics and efficacy of vaccination against infectious bronchitis virus field isolates from the United States and Israel(1996 to 2000)[J].Avian Pathol,2005,34(3):194-203.
[10]FAN Hui-ying,PAN Yong-fei,FANG Liu-rong,et al.Construction and immunogenicity of recombinant pseudotype baculovirus expressing the capsid protein of porcine circovirus type 2 in mice[J].JVirol Methods,2008,150(1/2):21-26.
[11]HU Yu-chen,YAO Kun,WU Tong-yuan,et al.Baculovirus as an expression and/or delivery vehicle for vaccine antigens[J].Expert Rev Vaccines,2008,7(3):363-371.
[12]HUANG Hai-nan,XIAO Shao-bo,QIN Jun-ling,et al.Construction and immunogenicity of a recombinant pseudotype baculovirus expressing the glycoprotein of rabies virus in mice[J].Arch Virol,2011,156(5):753-758.
[13]HOFMANN C,SANDIG V,JENNINGSG,et a1.Efficient gene transfer into human hepatocytes by baculovirus vectors[J].Proc Natl Acad Sci,1995,92(22):10099-10103.
[14]罗琼,樊惠英,罗开健,等.表达鸡传染性支气管病毒S1蛋白的重组假型杆状病毒的构建[J].华南农业大学学报,2010,31(2):104-107.
[15]FENGQian,LIU Ying-ying,QU Xiu-xia,etal.Baculovirus surface display of SARS coronavirus(SARS-CoV)spike protein and immunogenicity of the displayed protein in mice models[J].DNA Cell Biol,2006,25(12):668-673.
[16]TAMIC,PERALTA A,BARBIERIR,et al.Immunological properties of FMDV-gp64 fusion proteins expressed on SF9 cell and baculovirus surfaces[J].Vaccine,2004,23(6):840-845.
[17]YOSHIDA S,KAWASAKIM ,HARIGUCHIN ,et al.A baculovirus dual expression system-based malaria vaccine induces strong protection against Plasmodium berghei sporozoite challenge inmice[J].Infect Immun,2009,77(5):1782-1789.
[18]许信刚,童德文,刘宏仁.猪瘟病毒囊膜蛋白在杆状病毒表面的展示及展示蛋白的免疫原性试验[J].西北农林科技大学学报,2009,37(12):73-79.
【责任编辑 柴 焰】

